
- •Физика Механика
- •Физика Механика
- •Лабораторная работа 11 определение коэффициента пуассона для воздуха методом адиабатического расширения
- •I.Теоретическое введение
- •Определение теоретического значения коэффициента Пуассона
- •II. Теория метода и описание установки
- •III. Порядок выполнения работы и обработки
Определение теоретического значения коэффициента Пуассона
Из молекулярно - кинетической теории известно, что внутренняя энергия одного моля равна
![]()
где i - число степеней свободы данного газа. Число степеней свободы определяет число независимых координат, полностью описывающих положение молекулы газа в пространстве. Для идеального одноатомного газа необходимы три координаты, описывающие поступательное движение такой молекулы в пространстве. Следовательно ему приписывают три степени свободы.
Молекула двухатомного идеального газа рассматривается как совокупность двух материальных точек-атомов, жестко связанных недеформируемой связью. Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Таким образом, двухатомный идеальный газ обладает пятью степенями свободы. Трехатомные и многоатомные нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения.
![]() подставляя это
выражение в (4)
подставляя это
выражение в (4)
получим
![]() (10)
(10)
С учетом (10) выражение (7) примет вид
![]() (11)
(11)
С учетом (10) и (11) получим теоретическое значение коэффициента Пуассона
![]() (12)
(12)
II. Теория метода и описание установки
Величину γ можно определить с помощью установки (рис.1),
с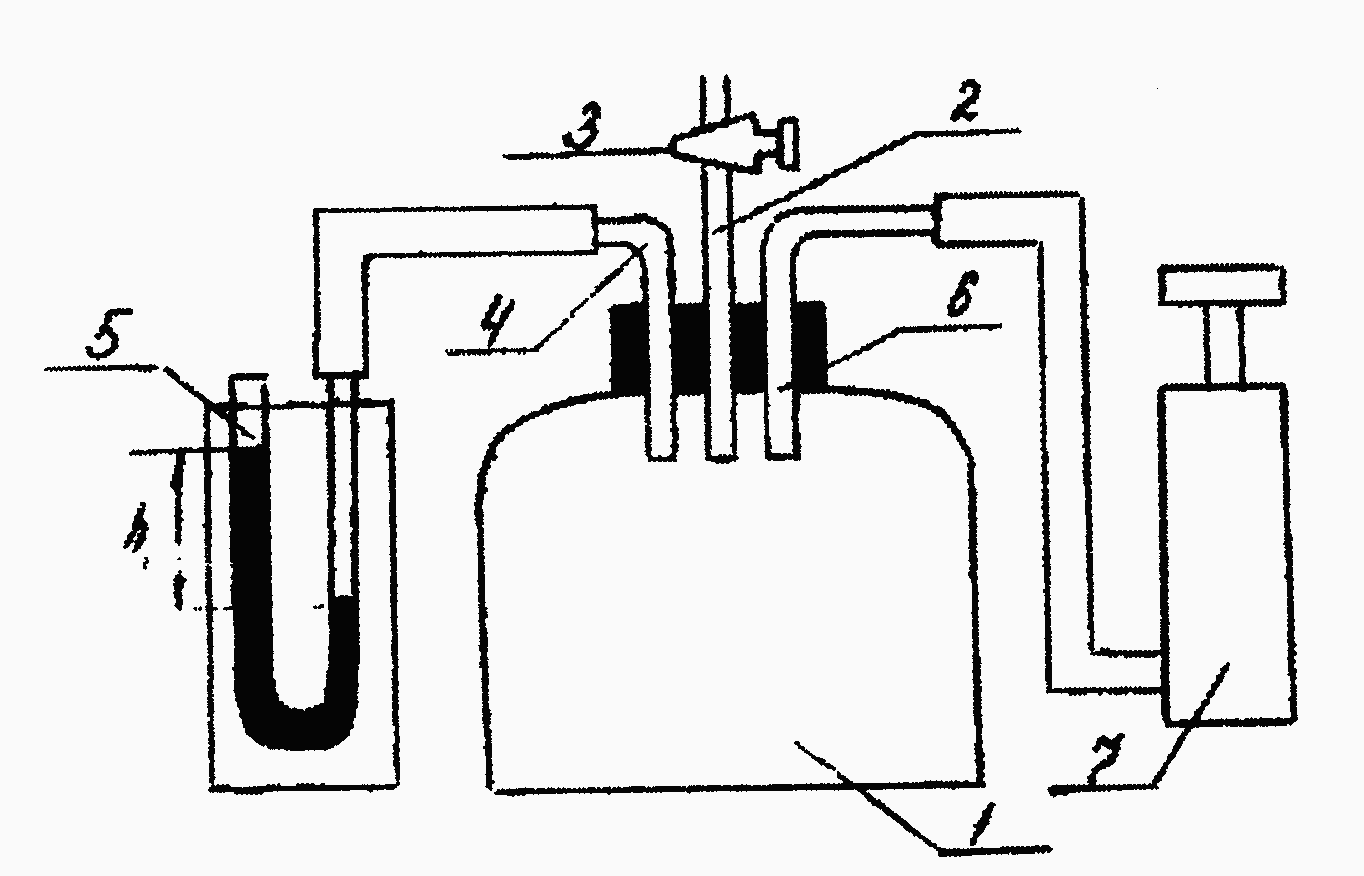 остоящей
из стеклянного баллона 1,герметично
зарытого пробкой, через пробку в баллон
пропущена трубка 2, на верхнем конце
которой имеется кран 3, соединяющий
полость баллона с атмосферой. Через
трубку 4, пропущенную через пробку в
баллон, полость баллона соединяется с
V-образным
манометром 5. Через трубку 6 полость
баллона соединяется с насосом 7.
остоящей
из стеклянного баллона 1,герметично
зарытого пробкой, через пробку в баллон
пропущена трубка 2, на верхнем конце
которой имеется кран 3, соединяющий
полость баллона с атмосферой. Через
трубку 4, пропущенную через пробку в
баллон, полость баллона соединяется с
V-образным
манометром 5. Через трубку 6 полость
баллона соединяется с насосом 7.
Рис.1
В баллон при закрытом кране накачивается воздух. Давление воздуха в баллоне повысится и станет равным
![]()
где h1 - избыток давления воздуха в баллоне над атмосферным давлением Н. Величина h1 измеряется манометром. Открывают на короткое время кран 3, чтобы давление в баллоне сравнялось с атмосферным (р2 = Н ), после чего закрывают кран.
Пусть масса воздуха поcле накачивания насосом в сосуде объемом V равна m. При открывании крана часть воздуха выходит. Обозначим массу вышедшего воздуха через Δm, тогда масса оставшегося воздуха
![]()
Масса воздуха m1, которая заключается в объеме V, занимала перед открытием крана меньший объем Vi. Так как процесс кратковременный и заметного теплообмена между газом и стенками баллона нет, то его можно считать адиабатическим. Согласно уравнению Пуассона (для массы газа равной m1) получим
![]() (13)
(13)
Вследствие адиабатического расширения температура газа понизилась, а затем в результате теплообмена, температура его через небольшой промежуток времени станет равной комнатной. При этом давление газа поднимается до величины
![]()
Начальное и конечное состояние газа наблюдается при одинаковой температуре. Поэтому на основании закона Бойля-Мариотта получим
![]() (14)
(14)
Решая уравнения (13) и (14) относительно у, получим
![]() (15)
(15)
Разложим lg p1 или lg p3 в ряд Тейлора, ограничившись в этом случае двумя первыми членами:
![]()
![]()
Подставляя эти значения в формулу (15), получим окончательно
![]() .
(16)
.
(16)
