
- •32. Галогеноводородные кислоты, их соли: строение, получение и химические свойства. Соединения, галогенов в положительной степени окисления. Биологическая роль галогенов.
- •3. Состояние вещества. Критерии, определяющие состояние вещества:
- •9. Ионная связь, ее свойства. Ионные кристаллические решетки и свойства веществ с ионной кристаллической решеткой. Поляризуемость и поляризующее действие ионов, их влияние на свойства веществ.
- •8.Ковалентная связь, ее свойства и основные характеристики.
- •7. Типы химической связи. Металлическая связь, общ. Физ. И химич. Свойства металлов.
- •12. Механизм процесса растворения. Тепловой эффект растворения. Растворимость твёрдых веществ в воде и других растворителях.
- •15. Состав и строение молекул воды. Полярность молекул. Водородная связь. Ассоциации молекул воды. Аномалии воды, их объяснение. Роль воды в биологических процессах.
- •16. Основные положения тэд. Причины и механизмы тэд с различным типом химической связи. Сольватация (гидратация) ионов.
- •17. Степень электролитической диссоциации. Сильные и слабые электролиты. Истинная и кажущаяся степень диссоциации. Коэффициент активности. Константа диссоциации.
- •19. Константы кислотности и основности. Электролитическая диссоциация воды. Ионное произведение воды, pH среды. Индикаторы. Буферные растворы. Гидролиз солей. Константа гидролиза.
- •20. Строение комплексных соединений, их классификация и номенклатура.
- •21. Электролитическая диссоциация комплексных соединений. Константа нестойкости. Образование и разрушение комплексных ионов в растворах. Кислотно-основные свойства комплексных соединений.
- •22. Классификация окислительно-восстановительных реакций. Правила составления уравнений окислительно-восстановительных реакций. Методы расстановки коэффициентов.
- •23. Электродный потенциал. Понятие о гальваническом элементе. Уравнение Нернста. Роль среды в протекании окислительно-восстановительных процессах.
- •25. Сера, ее аллотропные модификации. Бинарные соединения серы, их получение и строение молекул. Серная кислота, строение молекул, получение.
- •26. Свойства разбавленной и концентрированной серной кислоты (реакции с металлами и неметаллами). Представление о строении и химических свойствах других серосодержащих кислот.
- •28. Азотная и азотистая кислота, их соли: строение и получение. Химические свойства разбавленной и концентрированной азотной кислоты (реакции с металлами и неметаллами), нитратов и нитритов.
- •27. Азот, его бинарные соединения, их получение и строение молекул. Получение и свойства аммиака. Представления об азотных удобрениях.
- •31.Галогены, их бинарные соединения: получение и строение молекул. Особые свойства фтора и его соединений.
- •33. Металлы групп ia и iia: простые вещества, их реакционная способность. Строение, свойства и биологическая роль соединений щелочных и щелочноземельных металлов.
- •34. Металлы групп iiia и iva: простые вещества, их реакционная способность. Строение, свойства их бинарных соединений и гидроксидов.
- •1.Основные хим.Понятия: относительная молекулярная и атомная массы, моль, молярная масса, молярный объем, число Авогадро.
- •29.Фосфор его аллотропные модификации. Бинарные соединения фосфора, их получение и строение молекул.
9. Ионная связь, ее свойства. Ионные кристаллические решетки и свойства веществ с ионной кристаллической решеткой. Поляризуемость и поляризующее действие ионов, их влияние на свойства веществ.
ИOННАЯ СВЯЗЬ, тип химической связи, для к-рой характерно существ. перераспределение электронной плотности атомов в молекуле по сравнению со своб. атомами. Электронная плотность смещается от одного из атомов к другому атому (с высоким сродством к электрону), как если бы произошел перенос электрона от одного атома к другому. Хим. соединения с И. с. можно качественно описывать как образованные не атомами, а ионами, напр. Na+Cl-, Cs+F-, Li+(AlF4)-.
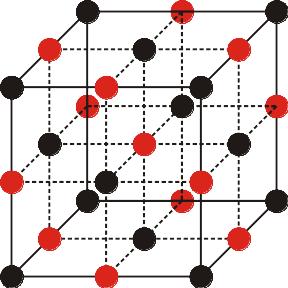
В кристаллич. решетке в-ва с И. с. каждый ион окружен противоположно заряженными ионами. Напр., в кристалле CsCl ион Cs+ окружен 8 эквивалентными ионами Сl-. Эксперим. и расчетные данные по распределению электронной плотности, энергии образования кристаллич. решетки и т. п. подтверждают существование в кристаллах с И. с. положительных и отрицат. ионов. При растворении в полярных р-рителях в-ва с И. с. обычно диссоциируют с образованием сольватир. ионов, ионных пар или кластеров. Идеальной И. с. практически не существует; принято говорить о ионном характере хим. связи либо о ее полярности, имея в виду степень переноса заряда между атомами или эффективный заряд атома в молекуле.
Св-ва вещ-в. Ионные кристаллы отличаются высокими температурами плавления. В расплавленном состоянии вещества, образующие ионные кристаллы, электропроводны. При растворении в воде эти вещества диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Кристаллическая решетка – каркас из упорядоченных частиц вещества, находящегося в кристаллическом состоянии.
Химическая связь |
Кристаллическая решетка |
Схема кристаллической решетки |
Cвойства |
Примеры |
ионная |
Ионная |
Cl− • |
Твердые, нелетучие, высокие Тпл и Ткип; хорошо растворимы в полярных растворителях. Хрупкие. |
Соли, основания и другие соединения металлов |
поляризуемость – способность ковал связи изменять свою полярность под влиянием внешнего электрического поля. Поляризуемость зависит от плотности перекрывания электронных облаков, а значит, от длины связи. Чем больше длина, тем легче она поляризуется.
Полярность связи и полярность молекулы совпадают для двухатомных молекул. Полярность оценивают значением μ – электрический момент диполя. Мю молекулы – векторная сумма мю связей и несвязывающих пар. В многоатомных молекулах полярность молекулы зависит от полярности связи.
Свойства соединений с ионной связью (Ткип. И плав., раст-ть, сила электролита) зависит от степени ионности связей, которая находится в обратной зависимости от: поляризующей способности катиона (способность его деформировать окружающие анионы) или поляризуемости аниона (способности аниона к деформации) – это все зависит от заряда и размера иона. Чем больше заряд катиона и меньше его размер, тем больше его поляризующая способность. Чем больше заряд аниона и больше его размер, тем больше его пяляризуемость. Чем выше ионность связи, тем в-во легче дисоциирует на ионы, тем больше его растворимость, тем выше его Ткип. и плав.

 Na+ •
Na+ •