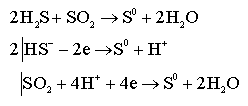3. Лиофильные и лиофобные золи
Лиофильные золи образуются самопроизвольно и не разрушаются со временем.
Лиофобные золи постепенно разрушаются из-за самопроизвольного слипания твердых частиц (коагуляция) или слияния жидких частиц (коалесценция) (при наличии стабилизатора эти процессы могут быть очень длительными).
Образование золя и строение его частиц
Пример 1 : Образование золя хлорида серебра AgCl (лиофобный коллоид): медленное приливание водного раствора хлорида натрия NaCl к водному раствору нитрата серебра AgNO3, взятому в избытке: Ag+ + Cl– = AgCl.
1) Образование агрегата (AgCl)n, в котором ионы расположены в том же порядке, что и в кристаллической решетке AgCl.
2) Агрегат (AgCl)n адсорбирует на своей поверхности те ионы, которые входят в него и находятся в растворе в избытке - Ag+ В результате адсорбции ионов Ag+ агрегат (AgCl)n со слоем ионов серебра приобретает положительный заряд.
Ионы, адсорбирующиеся на поверхности агрегата, придают частице заряд и называются потенциалопределяющими (в примере - Ag+).
Наличие одноименных зарядов на агрегатах препятствует их объединению и росту кристалла AgCl. Т.о. агрегаты AgCl с адсорбированными на них ионами приобретают состояние агрегативной устойчивости.
Агрегат (AgCl)n вместе с потенциалопределяющими ионами Ag+ составляет ядро.
3) К заряженному ядру притягиваются ионы противоположного заряда – противоионы. В примере: ионы, содержащиеся в растворе (но не входящие в состав агрегата), – нитрат-ионы NO3–.
Противоионы, непосредственно примыкающие к ядру, образуют адсорбционный слой противоионов.
Ядро + противоионы адсорбционного слоя - коллоидная частица, или гранула.
4) За адсорбционным слоем противоионов следует диффузный слой тех же противоионов. Противоионы диффузного слоя ориентируют вокруг себя полярные молекулы растворителя, создавая дополнительную сольватную (гидратную в случае H2O) оболочку.
Гранула с противоионами диффузного слоя – мицелла.
Знак заряда гранулы соответствует знаку заряда потенциалопределяющих ионов. ( в примере - Ag+).
Суммарно заряд коллоидной частицы (гранулы) = разности зарядов адсорбированных ионов и противоионов (m─ (m – x)).
Мицелла в отличие от гранулы электронейтральна.
Формула мицеллы гидрозоля хлорида серебра:
{[n(AgCl), mAg+, (m – x)NO3–]x++xNO3–}0.
В квадратные скобки заключена гранула (коллоидная частица). Ионы, указанные за квадратными скобками, составляют внешнюю часть мицеллы.
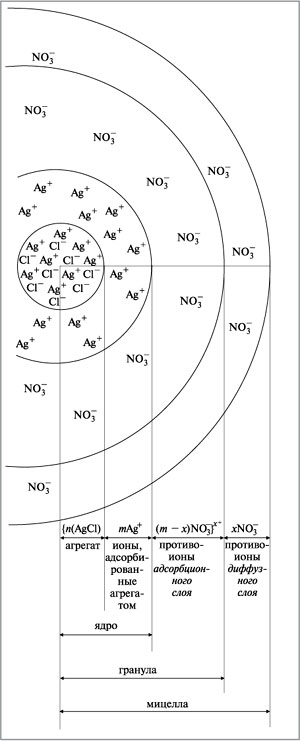
Рис. 1. Строение (разрез) мицеллы хлорида серебра
В лиофобных растворах растворитель входит в состав гидрофобных частиц как сольватная оболочка адсорбированных ионов. Поэтому формулу мицеллы можно изображать следующим образом:
{[n(AgCl), mAg+, (m – x)NO3–· yH2O]x++xNO3–·zH2O}0
Строение мицеллы и заряд гранулы зависят от способа получения коллоидного раствора.
Пример 2: Образование золя хлорида серебра AgCl ( в избытке не AgNO3, а NaCl): медленное приливание разбавленного раствора AgNO3 к раствору NaCl, взятому в избытке.
- На поверхности агрегата n(AgCl) будут адсорбироваться Cl–, имеющиеся в растворе в избытке (образуется слой потенциалопределяющих ионов)
- Противоионы адсорбционного и диффузионного слоев ионы - Na+
Состав мицеллы полученного гидрозоля:
{[n(AgCl), mCl–, (m – x)Na+]x– +xNa+}0.
Основу мицеллы составляет нерастворимое в данной среде ядро, микрокристалл или совокупность микрокристаллов.
Примеры образования дисперсной фазы.
Золь Fe(ОН)3. Прильем к раствору хлорида железа FеCl3 по каплям раствор гидроксида натрия NaОН до помутнения раствора или образования хлопьев малорастворимого гидроксида железа Fe(ОН) (в избытке Fe3+):
Fe3+ + 3OH– = Fe(ОН)3.
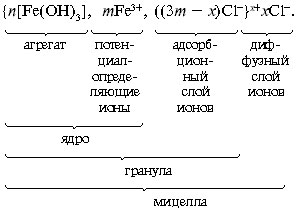
В слой потенциалопределяющих ионов могут входить не только ионы Fe3+, но и образующиеся при гидролизе ионы Fe(OH)2+, Fe(OH)2+ и др. Золь Al(ОН)3. Примерно таково же строение мицеллы.
Золь H2SiO3 Состав мицеллы кремниевой кислоты, образующейся при приливании к раствору силиката натрия (избыток) сильной кислоты:
{[nH2SiO3], mHSiO3–, (m – x)Na+}х–xNa+.
Слой ионов вокруг агрегата и противоинов адсорбционного и диффузного слоев представляет собой двойной электрический слой. Число положительных и отрицательных зарядов в нем одинаково, поэтому мицелла электронейтральна.
Между ядром и раствором возникает полный электрический потенциал или термодинамический φ(фи)-потенциал (электротермодинамический потенциал) – разность потенциалов, созданных всеми + и ─ зарядами мицеллы.
Другой потенциал - электрокинетический, или ξ (дзета)-потенциалом, существует между слоем ионов адсорбционного слоя и диффузного слоя
Составляет часть термодинамического потенциала и всегда меньше его
Добавление ионов, особенно многозарядных, может привести к их адсорбции в таких количествах, что произойдет перезарядка гранулы и изменение знака электрокинетического потенциала. Когда все противоионы находятся в адсорбционном слое, ξ -потенциал становится равным нулю Пример: [n(AgCl), mCl–,xNa+]0. Т.е. число противоионов в кол.частице может стать таким, что нейтрализует заряд зарядообразующих ионов .Подобное состояние называется изоэлектрическим состоянием (изоэлектрической точкой).
В изоэлектрическом состоянии электрокинетический потенциал равен нулю, и в этом состоянии дисперсные системы наименее устойчивы, частицы укрупняются, выпадают в осадок, и из ядра, играющего роль кристаллического зародыша, вырастает кристалл. Лиофильные системы в отличие от лиофобных в изоэлектрическом состоянии устойчивы (кроме некоторых белков).
Знак заряда коллоидной частицы устанавливается: 1 - по направлению ее движения к соответствующему электроду при пропускании постоянного электрического тока.
2 – по характеру взаимодействия окрашенных коллоидных частиц с целлюлозой бумаги. В водной среде капилляры целлюлозы заряжаются отрицательно, а находящаяся в них вода – положительно. Вдоль полоски фильтровальной бумаги (целлюлоза) по ее капиллярам могут передвигаться частицы, имеющие тот же заряд, что и целлюлоза, т.е. отрицательно заряженные частицы. Положительно заряженные частицы задерживаются на стенках капилляров в самом начале пути.
Подобный анализ - вариант хроматографического анализа на бумаге.
Положительный знак заряда имеют гранулы гидроксидов Fe(OH)3, Al(OH)3, Cr(OH)3, Ti(OH)3 и др.
Отрицательный знак заряда имеют гранулы некоторых гидроксидов, оксидов MnO2, SnO2, SiO2, золи кремниевой кислоты, сульфидов As2S3, PbS и других, коллоиды высокодисперсных металлов Au, Ag, Pt и серы S, а также глинистые коллоиды и гуминовые кислоты почвы.
Электрофорез - движение дисперсных частиц относительно дисперсионной среды (жидкой и газообразной) под действием электрического поля называется. В водной среде частица двигается к электроду, знак заряда которого противоположен знаку электрокинетического потенциала.
Электроосмос – перемещение дисперсионной среды под действием электрического поля: противоионы диффузного слоя притягиваются к соответствующему электроду и увлекают за собой жидкость дисперсионной среды.
Методы получения коллоидных растворов
1. методы конденсации (обмена; гидролиза; окисления – восстановления)
2 . методы диспергирования (в отдельную группу выделяется метод пептизации
Дисперсионные методы основаны на раздроблении твердых тел до частиц коллоидного размера и образовании таким образом коллоидных растворов.
Очистку золей проводят методом диализа, а используемые для этого устройства называют диализаторами. В них имеется полупроницаемая перегородка, через которую проходят ионы и молекулы низкомолекулярных веществ, но задерживаются крупные по размеру коллоидные частицы. Для ускорения этого процесса применяют электрическое поле и устройства называются электродиализаторами.
Метод отделения дисперсной фазы от дисперсионной среды фильтрованием коллоидных растворов через полупроницаемые мембраны называется ультра-фильтрацией.
МЕТОДЫ КОНДЕНСАЦИИ
1.1.МЕТОД ИОННОГО ОБМЕНА
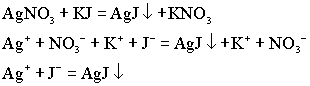
1.2. МЕТОД ГИДРОЛИЗА
Реакция гидролиза солей железа:
Fe3+ + H2O ↔ [Fe(OH)]2+ + H+ ,
Fe3+ + 2H2O ↔ [Fe(OH)2]+ + 2H+ ,
Fe3+ + 3H2O ↔ Fe(OH)3 + 3H+ .
1.3. МЕТОДЫ ОКИСЛЕНИЯ И ВОССТАНОВЛЕНИЯ
Рассмотрим образование гидрофобного золя на основе окислительно- восстановительной реакции. В данном случае ядром будет сера.