
- •27.Первичная, вторичная и третичная структура днк. Функциональная организация днк
- •28.Общая характеристика рнк. Виды рнк. Особенности структуры, синтеза и функции м-рнк, т-рнк и р-рнк..
- •29.Рибосомы. Генетический код и его свойства. Трансляция.
- •30.Регуляция синтеза белка у прокариот и эукариот. Мутации, их виды и последствия.
- •31.Ферментативный гидролиз белков. Протеолитические ферменты, их специфичность, активация.
- •32.Общая схема источников и расходования аминокислот в организме. Незаменимые аминокислоты. Общие пути катаболизма аминокислот.
- •33.Переаминирование аминокислот, его механизм, биологическое значение. Процессы дезаминирования и декарбоксилирования аминокислот.
- •34.Образование аммиака. Транспорт аммиака. Восстановительное аминирование. Амиды и их физиологическое значение.
- •35.Особенности обмена отдельных аминокислот и их роль в образовании важнейших биологически активных веществ.
33.Переаминирование аминокислот, его механизм, биологическое значение. Процессы дезаминирования и декарбоксилирования аминокислот.
ПЕРЕАМИНИРОВАНИЕ (трансаминирование), обратимый перенос аминогруппы из молекулы одного орг. соед. в молекулу другого. Наиб. роль переаминирование играет в биохимии в процессах метаболизма азотистых оснований в тканях животных и растений. Заключается в переносе аминогруппы от молекулы a-аминокислоты в молекулу a-кетокислоты, как правило с участием ферментов - аминотрансфераз (трансаминаз), напр. по р-ции:
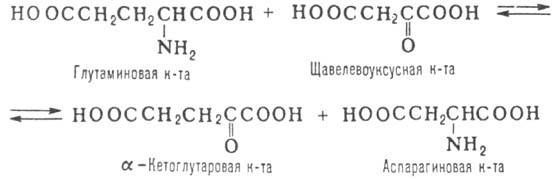
В живых организмах на р-циях такого типа основываются синтез и диссимиляция аминокислот.
Аминотрансферазы (более 50 разновидностей) содержат в качестве кофсрмента производные витамина В6-пири-доксаль-5'-фосфат (ф-ла I) и пиридоксамин-5'-фосфат (II). В основе каталитич. активности пиридоксаль-5'-фосфата лежит способность его формильной группы образовывать с аминокислотами шиффовы основания, легко гидролизующиеся до пиридоксамин-5'-фосфата и a-кетокислоты. Общая схема переаминирования с участием этих ферментов представляет собой сумму двух полуреакций:

А.E. Браунштейн и M. M. Шемякин в 1953 сформулировали общий механизм переаминирования в биол. системах, состоящий из ряда промежут. стадий. Подробно механизм переаминирования под действием аминотрансфераз рассмотрен в ст. Аспартатаминотранс· фераза.Нарушение нормального течения переаминирования в организме наблюдается при патологич. состояниях, напр. при инфаркте миокарда, заболеваниях печени. Контроль концентрации аминотрансфераз используется в этих случаях как ср-во диагностики. Переаминирование в организме подавляется противотуберкулезными лек. ср-вами (изониазидом, циклосерином и др.), а также при В6-авитаминозе.Переаминирование аминокислот может происходить и вне клетки в присут. пиридоксаль-5'-фосфата, однако скорость р-ции в 106 раз меньше. Специфичность действия определяется пространств, структурой субстрата, положением ионогенных групп белка, осуществляющих кислотно-основной катализ, и геометрией связывания субстрата.В орг. химии примером переаминирования может служить обмен одной аминогруппы в молекуле на другую при р-ции с аминами:
![]()
Сдвиг равновесия определяется разностью основностей исходных аминов и продуктов р-ции, а также соотношением концентраций реагентов. Проводят р-ции при повыш. т-ре в присут. катализаторов (к-ты, основания, нек-рые металлы или их оксиды) или без них; протекает обычно по механизму SN2. Каталитическое переаминирование в зависимости от агрегатного состояния катализатора осуществляют в жидкой фазе под давлением или в газовой фазе.К переаминированию относят также превращ. a-кетокислоты в a-амино-кислоту при нагр. с др. аминокислотой в водном р-ре (р-ция Хербста - Энгеля):
![]()
Аминокислоты, которые поступают в организм в количествах, превышающих потребности биосинтеза клеточных белков, не могут запасаться и подвергаются метаболическим превращениям. Наиболее распространенными и важными реакциями, в которых участвуют аминокислоты, являются трансаминирование (переаминирование), окислительное дезаминирование и декарбоксилирование.
Переаминирование представляет собой взаимопревращение α-аминокислоты и α-кетокислоты, катализируемое аминотрансферазой. В большинстве тканей млекопитающих имеются две аминотрансферазы - аналин-аминотрансфераза и глутамат-аминотранфераза. Они катализируют перенос аминогрупп от большинства α-аминокислот с образованием аланина (из пировиноградной кислоты) и глутаминовой кислоты (из α-кетоглутаровой кислоты). Каждая аминотрансфераза специфична к определенным парам α-амино-и α-кетокислот. Чаще всего в качестве акцепторной α-кетокислоты используется α-кетоглутаровая кислота:
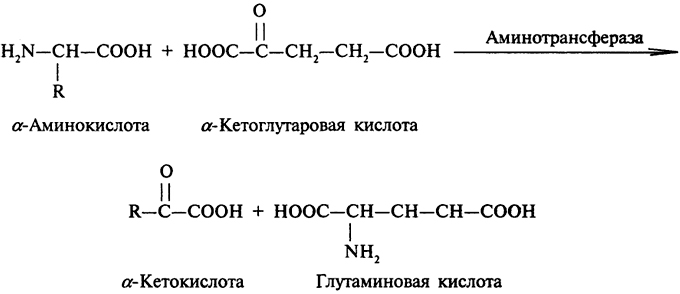
Большинство α-аминокислот являются субстратами аминотрансфераз, исключение составляют треонин, пролин и лизин.
Окислительное дезаминирование аминокислот происходит в клетках печени и почек. Продуктами окислительного дезаминирования аминокислот являются соответствующие α-кетокислоты. Этот процесс катализирует дегидрогеназа, коферментом которой может быть как НАД, так и НАДФ. Наиболее важной и распространенной является глутаматдегидрогеназа, катализирующая процесс:
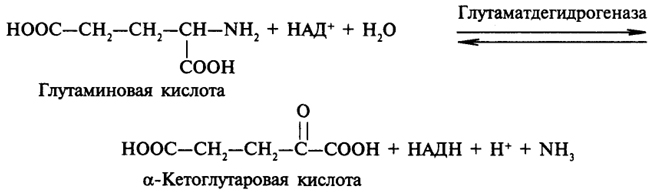
ция, катализируемая глутаматдегидрогеназой, обратима, поэтому функция этого фермента заключается не только в том, чтобы катализировать дезаминирование аминокислот, но также и в том, чтобы ускорять процесс аминирования a-кетоглутаровой кислоты свободным аммиаком.
Декарбоксилирование аминокислот - важный метаболический процесс, в результате которого из аминокислот образуются биологически активные амины. Декарбоксилазы аминокислот - сложные ферменты, коферментом которых является пиридоксальфосфат. Приведем несколько примеров:
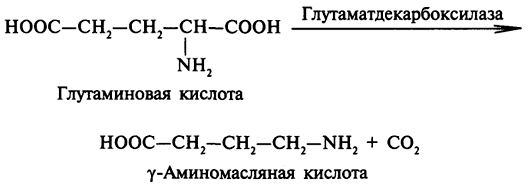
И глутаминовая, и γ-аминомасляная (ГАМК) кислоты относятся к нейромедиаторам - химическим соединениям, влияющим на передачу электрических потенциалов в синапсах нейрон-нейронных нейромышечных контактов. ГАМК ингибирует, глутаминовая кислота активирует передачу нервных импульсов. Декарбоксилирование гистидина приводит к образованию гистамина, который вызывает усиление деятельности желез внутренней секреции. Подводя итог, можно констатировать, что конечными продуктами катаболизма аминокислот являются α-кетокислоты, амины, оксид углерода (IV), аммиак. Органические соединения вовлекаются в определенные метаболические процессы, оксид углерода (IV) беспрепятственно выводится из организма, а аммиак связывается с образованием глутамина, аспарагина, аспартата, мочевины. Рассмотрим пути связывания аммиака.
