
Клеточная стенка — жёсткая оболочка клетки, расположенная снаружи от цитоплазматической мембраны и выполняющая структурные, защитные и транспортные функции. Обнаруживается у большинства бактерий, архей, грибов и растений. Животные и многие простейшие не имеют клеточной стенки.
Клеточные стенки прокариот
Клеточные стенки бактерий состоят из пептидогликана (муреина) и бывают двух типов: грамположительного и грамотрицательного. Клеточная стенка грамположительного типа состоит исключительно из толстого слоя пептидогликана, плотно прилегающего к клеточной мембране и пронизанного тейхоевыми и липотейхоевыми кислотами. При грамотрицательном типе слой пептидогликана существенно тоньше, между ним и плазматической мембраной находится периплазматическое пространство, а снаружи клетка окружена еще одной мембраной, представленной т. н. липополисахаридом и являющаяся пирогенным эндотоксином грамотрицательных бактерий.
Клеточные стенки грибов
Клеточные стенки грибов состоят из хитина и глюканов.
Клеточные стенки водорослей
Большинство водорослей имеют клеточную стенку из целлюлозы и различных гликопротеинов. Включения дополнительных полисахаридов имеют большое таксономическое значение.
Диатомовые водоросли синтезируют свою клеточную стенку из кремнезёма.
Клеточные стенки высших растений
Клеточные стенки высших растений построены в основном из целлюлозы, гемицеллюлозы и пектина. В них существуют углубления — поры, через которые проходят плазмодесмы, осуществляющие контакт соседних клеток и обмен веществами между ними. Растительные клеточные стенки выполняют целый ряд функций: они обеспечивают жесткость клетки для структурной и механической поддержки, придают форму клетке, направление ее роста и в конечном счете морфологию всему растению. Клеточная стенка также противодействует тургору, т.е. осмотическому давлению, когда дополнительное количество воды поступает в растения. Клеточные стенки защищают от патогенов, проникающих из окружающей среды, и запасают углеводы для растения. Растительные клеточные стенки строятся прежде всего из углеводного полимера целлюлозы.
Цитопла́зма (от греч. κύτος «клетка» и πλάσμα зд. «содержимое») — внутренняя среда живой или умершей клетки, кроме ядра и вакуоли, ограниченная плазматической мембраной. Включает в себя гиалоплазму — основное прозрачное вещество цитоплазмы, находящиеся в ней обязательные клеточные компоненты — органеллы, а также различные непостоянные структуры — включения.
В состав цитоплазмы входят все виды органических и неорганических веществ. В ней присутствуют также нерастворимые отходы обменных процессов и запасные питательные вещества. Основное вещество цитоплазмы — вода.
Цитоплазма постоянно движется, перетекает внутри живой клетки, перемещая вместе с собой различные вещества, включения и органоиды. Это движение называется циклозом. В ней протекают все процессы обмена веществ.
Цитоплазма способна к росту и воспроизведению и при частичном удалении может восстановиться. Однако нормально функционирует цитоплазма только в присутствии ядра. Без него долго существовать цитоплазма не может, так же как и ядро без цитоплазмы.
Важнейшая роль цитоплазмы заключается в объединении всех клеточных структур (компонентов) и обеспечении их химического взаимодействия.
Биосинтез белка
Биосинтез белка
В обмене веществ организма ведущая роль принадлежит белкам и нуклеиновым кислотам. Белковые вещества составляют основу всех жизненно важных структур клетки, они входят в состав цитоплазмы. Белки обладают необычайно высокой реакционной способностью. Они наделены каталитическими функциями, т. е. являются ферментами, поэтому белки опреде ляют направление, скорость и теснейшую согласованность, сопряженность всех реакций обмена веществ.
Ведущая роль белков в явлениях жизни связана с богатством и разнообразием их химических функций, с исключительной способностью к различным превращениям и взаимодействиям с другими простыми и сложными веществами, входящими в состав цитоплазмы.
Нуклеиновые кислоты входят в состав важнейшего органа клетки — ядра, а также цитоплазмы, рибосом, митохондрий и т. д. Нуклеиновые кислоты играют важную, первостепенную роль в наследственности, изменчивости организма, в синтезе белка.
Процесс синтеза белка является очень сложным многоступенчатым процессом. Совершается он в специальных органеллах — рибосомах. В клетке содержится большое количество рибосом. Например, у кишечной палочки их около 20 000.
Каким образом происходит синтез белка в рибосомах?
Молекулы белков по существу представляют собой полипептидные цепочки, составленные из отдельных аминокислот. Но аминокислоты недостаточно активны, чтобы соединиться между собой самостоятельно. Поэтому, прежде чем соединиться друг с другом и образовать молекулу белка, аминокислоты должны активироваться. Эта активация происходит под действием особых ферментов. Причем каждая аминокислота имеет свой, специфически настроенный на нее фермент.
Источником энергии для этого (как и для многих процессов в клетке) служит аденозинтрифосфат (АТФ).
В результате активирования аминокислота становится более лабильной и под действием того же фермента связывается с т-РНК.
Важным является то, что каждой аминокислоте соответствует строго специфическая т-РНК. Она находит «свою» аминокислоту и переносит ее в рибосому. Поэтому такая РНК и получила название транспортной.
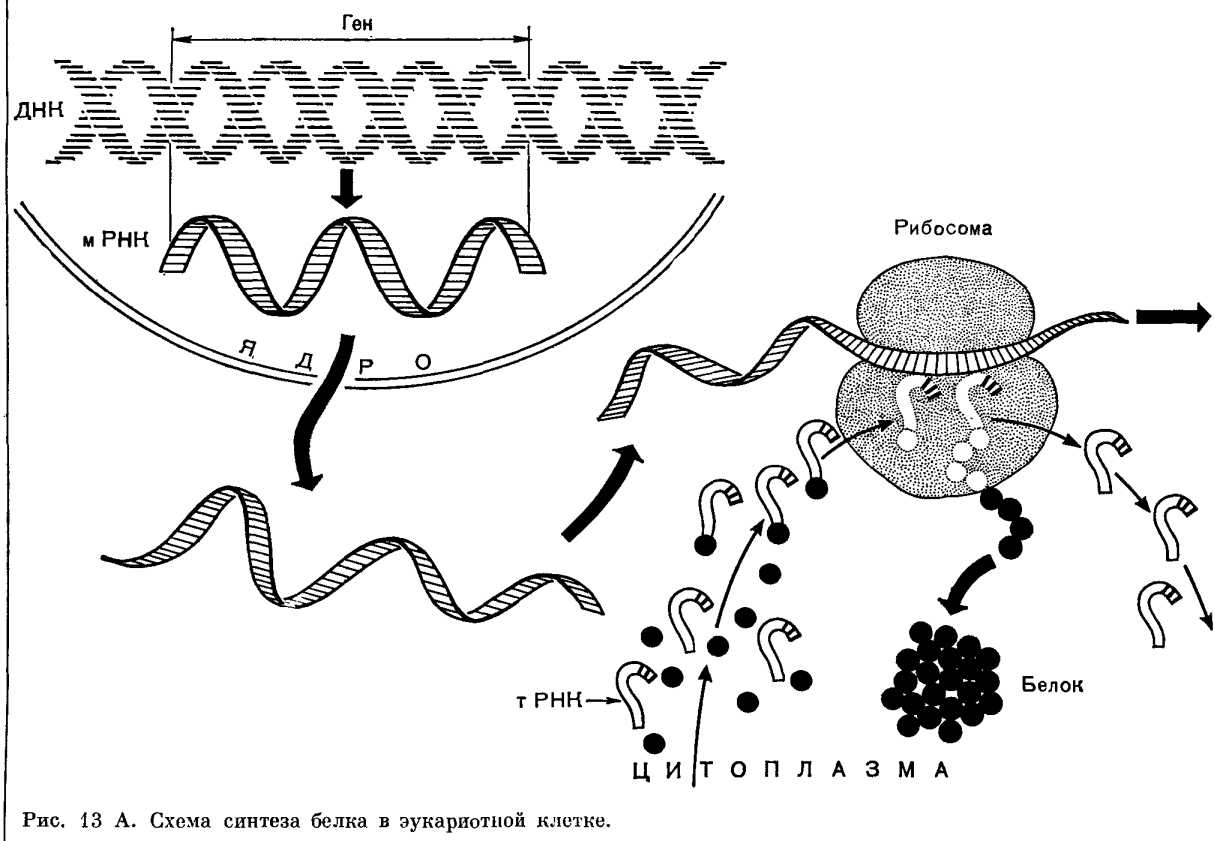
Следовательно, в рибосому поступают различные активированные аминокислоты, соединенные со своими т-РНК. Рибосома представляет собой как бы конвейер для сборки цепочки белка из поступающих в него различных аминокислот (рис. 13 А и Б).
 ,
,
Возникает вопрос: от чего зависит порядок связывания между собой отдельных аминокислот? Ведь именно этот порядок и определяет, какой белок будет синтезирован в рибосоме, так как от порядка расположения аминокислот в белке зависит его специфика. В клетке содержится более 2000 различных по строению и свойствам специфических белков.
Оказывается, что одновременно с т-РНК, на которой «сидит» своя аминокислота, в рибосому поступает «сигнал» от ДНК, которая содержится в ядре. В соответствии с этим сигналом в рибосоме синтезируется тот или иной белок, тот или иной фермент (так как ферменты являются белками).
Направляющее влияние ДНК на синтез белка осуществляется не непосредственно, а с помощью особого посредника, той формы РНК, которая получила название матричной или информационной РНК (м-РНК или и-РНК).
Информационная РНК синтезируется в ядре иод влиянием ДНК, поэтому ее состав отражает состав ДНК. Молекула РНК представляет собой как бы слепок с формы ДНК.
Синтезированная и-РНК поступает в рибосому и как бы передает этой структуре план — в каком порядке должны соединяться друг с другом поступившие в рибосому активированные аминокислоты, чтобы синтезировался определенный белок. Иначе, генетическая информация, закодированная в ДНК, передается на и-РНК и далее на белок.
Молекула информационной РНК поступает в рибосому и как бы прошивает ее. Тот ее отрезок, который находится в данный момент в рибосоме, определенный кодоном (триплет), взаимодействует совершенно специфично с подходящим к нему по строению триплетом (антикодоном) в транспортной РНК, которая принесла в рибосому аминокислоту. Транспортная РНК со своей аминокислотой подходит к определенному кодону и-РНК и соединяется с ним; к следующему, соседнему участку и-РНК присоединяется другая т-РНК с другой аминокислотой и так далее, до тех пор пока не будет считана вся цепочка и-РНК и пока не нанижутся все аминокислоты в соответствующем порядке, образуя молекулу белка. А т-РНК, которая доставила аминокислоту к определенному участку полипептидной цепи, освобождается от своей аминокислоты и выходит иэ рибосомы. Затем снова в цитоплазме к ней может присоединиться нужная аминокислота, и она снова перенесет ее в рибосому. В процессе синтеза белка участвует одновременно не одна, а несколько рибосом — полирибосомы.
Основные этапы передачи генетической информации: синтез на ДНК как на матрице и-РНК (транскрипция) и синтез в рибосомах полипептидной цепи по программе, содержащейся в и-РНК (трансляция), универсальны для всех живых существ. Однако временные и пространственные взаимоотношения этих процессов различаются у про- и эукариотов.
У организмов, обладающих па стоящим ядром (животные, растения), транскрипция и трансля ция строго разделены в пространстве и времепи: синтез различных РНК происходит в ядре, после чего молекулы РНК должны покинуть пределы ядра, пройдя через ядерную мембрану (рис. 13 А). Затем в цитоплазме РНК транспортируются к месту синтеза белка— рибосомам. Лишь после этого паступает следующий этап — трансляция.
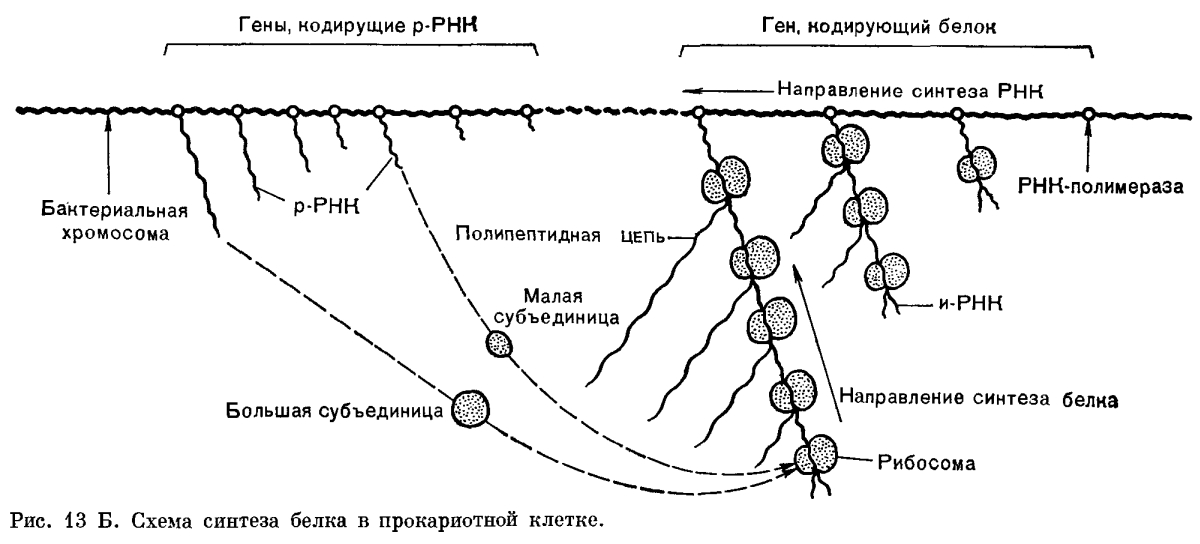
У бактерий, ядерное вещество которых не отделено от цитоплазмы мембраной, транскрипция и трансляция идут одновременно (рис. 13 Б).
Современные схемы, иллюстрирующие работу генов, построены на основании логического анализа экспериментальных данных, полученных с помощью биохимических и генетических методов. Применение тонких электронно-микроскопических методов позволяет в буквальном смысле слова увидеть работу наследственного аппарата клетки. В последнее время получены электронно-микроскопические снимки, на которых видно, как на матрице бактериальной ДНК, в тех участках, где к ДНК прикреплены молекулы РНК-полимеразы (фермента, катализирующего транскрипцию ДНК в РНК), происходит синтез молекул и-РНК. Нити и-РНК, расположенные перпендикулярно к линейной молекуле ДНК, продвигаются вдоль матрицы и увеличиваются в длине. По мере удлинения нитей РНК к ним присоединяются рибосомы, которые, продвигаясь, в свою очередь, вдоль нити РНК по направлению к ДНК, ведут синтез белка.
Из всего сказанного следует, что местом синтеза белков и всех ферментов в клетке являются рибосомы. Образно выражаясь, это как бы «фабрики» белка, как бы сборочный цех, куда поступают все материалы, необходимые для сборки полипептидной цепочки белка иэ аминокислот. Природа же синтезируемого белка зависит от строения и-РНК, от порядка расположения в ней нуклеоидов, а строение и-РНК отражает строение ДНК, так что в конечном итоге специфическое строение белка, т. е. порядок расположения в нем различных аминокислот, зависит от порядка расположения нуклеоидов в ДНК, от строения ДНК.
Изложенная теория биосинтеза белка получила название матричной теории. Матричной эта теория называется потому, что нуклеиновые кислоты играют как бы роль матриц, в которых записана вся информация относительно последовательности аминокислотных остатков в молекуле белка.
Создание матричной теории биосинтеза белка и расшифровка аминокислотного кода является крупнейшим научным достижением XX века, важнейшим шагом на пути к выяснению молекулярного механизма наследственности.
Клеточная мембрана
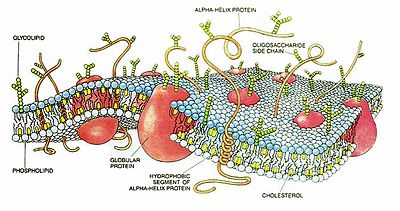
Изображение клеточной мембраны. Маленькие голубые и белые шарики соответствуют гидрофильным «головкам» фосфолипидов, а присоединённые к ним линии — гидрофобным «хвостам». На рисунке показаны только интегральные мембранные белки (красные глобулы и желтые спирали). Желтые овальные точки внутри мембраны — молекулы холестерола Жёлто-зеленые цепочки бусинок на наружной стороне мембраны — цепочки олигосахаридов, формирующие гликокаликс
Кле́точная мембра́на (или цитолемма, или плазмалемма, или плазматическая мембрана) отделяет содержимое любой клетки от внешней среды, обеспечивая её целостность; регулируют обмен между клеткой и средой; внутриклеточные мембраны разделяют клетку на специализированные замкнутые отсеки — компартменты или органеллы, в которых поддерживаются определённые условия среды.
Основные сведения
Клеточная стенка, если таковая у клетки имеется (обычно есть у растительных клеток), покрывает клеточную мембрану.
Клеточная мембрана представляет собой двойной слой (бислой) молекул класса липидов, большинство из которых представляет собой так называемые сложные липиды — фосфолипиды. Молекулы липидов имеют гидрофильную («головка») и гидрофобную («хвост») часть. При образовании мембран гидрофобные участки молекул оказываются обращены внутрь, а гидрофильные — наружу. Мембраны — структуры инвариабельные, весьма сходные у разных организмов. Некоторое исключение составляют, пожалуй, археи, у которых мембраны образованы глицерином и терпеноидными спиртами. Толщина мембраны составляет 7-8 нм.
Биологическая мембрана включает и различные белки: интегральные (пронизывающие мембрану насквозь), полуинтегральные (погруженные одним концом во внешний или внутренний липидный слой), поверхностные (расположенные на внешней или прилегающие к внутренней сторонам мембраны). Некоторые белки являются точками контакта клеточной мембраны с цитоскелетом внутри клетки, и клеточной стенкой (если она есть) снаружи. Некоторые из интегральных белков выполняют функцию ионных каналов, различных транспортеров и рецепторов.
Функции
барьерная — обеспечивает регулируемый, избирательный, пассивный и активный обмен веществ с окружающей средой. Например, мембрана пероксисом защищает цитоплазму от опасных для клетки пероксидов. Избирательная проницаемость означает, что проницаемость мембраны для различных атомов или молекул зависит от их размеров, электрического заряда и химических свойств. Избирательная проницаемость обеспечивает отделение клетки и клеточных компартментов от окружающей среды и снабжение их необходимыми веществами.
транспортная — через мембрану происходит транспорт веществ в клетку и из клетки. Транспорт через мембраны обеспечивает: доставку питательных веществ, удаление конечных продуктов обмена, секрецию различных веществ, создание ионных градиентов, поддержание в клетке оптимального pH и концентрации ионов, которые нужны для работы клеточных ферментов. Частицы, по какой-либо причине неспособные пересечь фосфолипидный бислой (например, из-за гидрофильных свойств, так как мембрана внутри гидрофобна и не пропускает гидрофильные вещества, или из-за крупных размеров), но необходимые для клетки, могут проникнуть сквозь мембрану через специальные белки-переносчики (транспортеры) и белки-каналы или путем эндоцитоза. При пассивном транспорте вещества пересекают липидный бислой без затрат энергии по градиенту концентрации путем диффузии. Вариантом этого механизма является облегчённая диффузия, при которой веществу помогает пройти через мембрану какая-либо специфическая молекула. У этой молекулы может быть канал, пропускающий вещества только одного типа. Активный транспорт требует затрат энергии, так как происходит против градиента концентрации. На мембране существуют специальные белки-насосы, в том числе АТФаза, которая активно вкачивает в клетку ионы калия (K+) и выкачивают из неё ионы натрия (Na+).
матричная — обеспечивает определенное взаиморасположение и ориентацию мембранных белков, их оптимальное взаимодействие.
механическая — обеспечивает автономность клетки, ее внутриклеточных структур, также соединение с другими клетками (в тканях). Большую роль в обеспечение механической функции имеют клеточные стенки, а у животных — межклеточное вещество.
энергетическая — при фотосинтезе в хлоропластах и клеточном дыхании в митохондриях в их мембранах действуют системы переноса энергии, в которых также участвуют белки;
рецепторная — некоторые белки, находящиеся в мембране, являются рецепторами (молекулами, при помощи которых клетка воспринимает те или иные сигналы). Например, гормоны, циркулирующие в крови, действуют только на такие клетки-мишени, у которых есть соответствующие этим гормонам рецепторы. Нейромедиаторы (химические вещества, обеспечивающие проведение нервных импульсов) тоже связываются с особыми рецепторными белками клеток-мишеней.
ферментативная — мембранные белки нередко являются ферментами. Например, плазматические мембраны эпителиальных клеток кишечника содержат пищеварительные ферменты.
осуществление генерации и проведения биопотенциалов. С помощью мембраны в клетке поддерживается постоянная концентрация ионов: концентрация иона К+ внутри клетки значительно выше, чем снаружи, а концентрация Na+ значительно ниже, что очень важно, так как это обеспечивает поддержание разности потенциалов на мембране и генерацию нервного импульса.
маркировка клетки — на мембране есть антигены, действующие как маркеры — «ярлыки», позволяющие опознать клетку. Это гликопротеины (то есть белки с присоединенными к ним разветвленными олигосахаридными боковыми цепями), играющие роль «антенн». Из-за бесчисленного множества конфигурации боковых цепей возможно сделать для каждого типа клеток свой особый маркер. С помощью маркеров клетки могут распознавать другие клетки и действовать согласованно с ними, например, при формировании органов и тканей. Это же позволяет иммунной системе распознавать чужеродные антигены.
Структура и состав биомембран
Мембраны состоят из липидов трёх классов: фосфолипиды, гликолипиды и холестерол. Фосфолипиды и гликолипиды (липиды с присоединёнными к ним углеводами) состоят из двух длинных гидрофобных углеводородных «хвостов», которые связаны с заряженной гидрофильной «головой». Холестерол придаёт мембране жёсткость, занимая свободное пространство между гидрофобными хвостами липидов и не позволяя им изгибаться. Поэтому мембраны с малым содержанием холестерола более гибкие, а с большим — более жёсткие и хрупкие. Также холестерол служит «стопором», препятствующим перемещению полярных молекул из клетки и в клетку. Важную часть мембраны составляют белки, пронизывающие её и отвечающие за разнообразные свойства мембран. Их состав и ориентация в разных мембранах различаются.
Клеточные мембраны часто асимметричны, то есть слои отличаются по составу липидов, переход отдельной молекулы из одного слоя в другой (так называемый флип-флоп) затруднён.
Мембранные органеллы
Это замкнутые одиночные или связанные друг с другом участки цитоплазмы, отделённые от гиалоплазмы мембранами. К одномембранным органеллам относятся эндоплазматическая сеть, аппарат Гольджи, лизосомы, вакуоли, пероксисомы; к двумембранным — ядро, митохондрии, пластиды. Строение мембран различных органелл отличается по составу липидов и мембранных белков.
Избирательная проницаемость
Клеточные мембраны обладают избирательной проницаемостью: через них медленно диффундируют глюкоза, аминокислоты, жирные кислоты, глицерол и ионы, причем сами мембраны в известной мере активно регулируют этот процесс — одни вещества пропускают, а другие нет. Существует четыре основных механизма для поступления веществ в клетку или вывода их из клетки наружу: диффузия, осмос, активный транспорт и экзо- или эндоцитоз. Два первых процесса носят пассивный характер, то есть не требуют затрат энергии; два последних — активные процессы, связанные с потреблением энергии.
Избирательная проницаемость мембраны при пассивном транспорте обусловлена специальными каналами — интегральными белками. Они пронизывают мембрану насквозь, образовывая своего рода проход. Для элементов K, Na и Cl есть свои каналы. Относительно градиента концентрации молекулы этих элементов движутся в клетку и из неё. При раздражении каналы натриевых ионов раскрываются, и происходит резкое поступление в клетку ионов натрия. При этом происходит дисбаланс мембранного потенциала. После чего мембранный потенциал восстанавливается. Каналы калия всегда открыты, через них в клетку медленно попадают ионы калия.
Пластиды
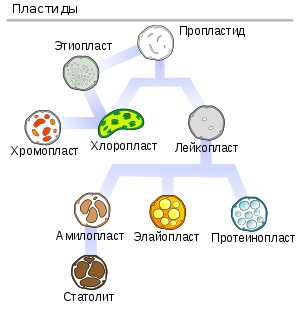
Пластиды — органоиды эукариотических растений, прокариотов и некоторых фотосинтезирующих простейших (например, эвглены зеленой). Покрыты двойной мембраной и имеют в своём составе множество копий кольцевой ДНК. Совокупность пластид клетки образует пластидом. По окраске и выполняемой функции выделяют три основных типа пластид:
Лейкопласты — неокрашенные пластиды, как правило выполняют запасающую функцию. В лейкопластах клубней картофеля накапливается крахмал. Лейкопласты высших растений могут превращаться в хлоропласты или хромопласты.
Хромопласты — пластиды, окрашенные в жёлтый, красный, зеленый или оранжевый цвет. Окраска хромопластов связана с накоплением в них каротиноидов. Хромопласты определяют окраску осенних листьев, лепестков цветов, корнеплодов, созревших плодов.
Хлоропласты — пластиды, несущие фотосинтезирующие пигменты — хлорофиллы. Имеют зелёную окраску у высших растений, харовых и зелёных водорослей. Набор пигментов, участвующих в фотосинтезе (и, соответственно, определяющих окраску хлоропласта) различен у представителей разных таксономических отделов. Хлоропласты имеют сложную внутреннюю структуру.

Растительные клетки листостебельного мха Plagiomnium affine с видимыми хлоропластами (сильно увеличено)
Эндоплазматический ретикулум
Эндоплазматический ретикулум (ЭПР) (лат. reticulum — сеточка) или эндоплазматическая сеть (ЭПС) — внутриклеточный органоид эукариотической клетки, представляющий собой разветвлённую систему из окружённых мембраной уплощённых полостей, пузырьков и канальцев.
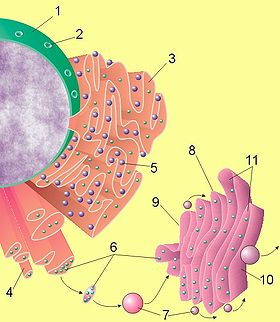
Схематическое представление клеточного ядра, эндоплазматического ретикулума и комплекса Гольджи. (1) Ядро клетки. (2) Поры ядерной мембраны. (3) Гранулярный эндоплазматический ретикулум. (4) Агранулярный эндоплазматический ретикулум. (5) Рибосомы на поверхности гранулярного эндоплазматического ретикулума. (6) Макромолекулы (7) Транспортные везикулы. (8) Комплекс Гольджи. (9) Цис-Гольджи (10) Транс-Гольджи (11) Цистерны Гольджи
История открытия
Впервые эндоплазматический ретикулум был обнаружен американским учёным К. Портером в 1945 году посредством электронной микроскопии.
Строение
Эндоплазматический ретикулум состоит из разветвлённой сети трубочек и карманов, окружённых мембраной. Площадь мембран эндоплазматического ретикулума составляет более половины общей площади всех мембран клетки.
Мембрана ЭПР морфологически идентична оболочке клеточного ядра и составляет с ней одно целое. Таким образом, полости эндоплазматического ретикулума открываются в межмембранную полость ядерной оболочки. Мембраны ЭПС обеспечивают активный транспорт ряда элементов против градиента концентрации. Нити, образующие эндоплазматический ретикулум, имеют в поперечнике 0,05—0,1 мкм (иногда до 0,3 мкм), толщина двухслойных мембран, образующих стенку канальцев, составляет около 50 ангстрем (5 нм, 0,005 мкм). Эти структуры содержат ненасыщенные фосфолипиды, а также некоторое количество холестерина и сфинголипидов. В их состав также входят белки.
Трубочки, диаметр которых колеблется в пределах 0,1—0,3 мкм, заполнены гомогенным содержимым. Их функция — осуществление коммуникации между содержимым пузырьков ЭПС, внешней средой и ядром клетки.
Эндоплазматический ретикулум не является стабильной структурой и подвержен частым изменениям.
Выделяют два вида ЭПР:
гранулярный эндоплазматический ретикулум;
агранулярный (гладкий) эндоплазматический ретикулум.
На поверхности гранулярного эндоплазматического ретикулума находится большое количество рибосом, которые отсутствуют на поверхности агранулярного ЭПР.
Гранулярный и агранулярный эндоплазматический ретикулум выполняют различные функции в клетке.
Функции эндоплазматического ретикулума
Схема, показывающая цитоплазму, вместе с её компонентами (или органеллами), в типичной животной клетке. Органеллы: (1) Ядрышко (2) Ядро (3) Рибосома (маленькие точки) (4) Везикула (5) Шероховатый эндоплазматический ретикулум (ER) (6) Аппарат Гольджи (7) Цитоскелет (8) Гладкий эндоплазматический ретикулум (9) Митохондрия (10) Вакуоль (11) Цитоплазма (12) Лизосома (13) Центриоль и Центросома
При участии эндоплазматического ретикулума происходит трансляция и транспорт белков, синтез и транспорт липидов и стероидов. Для ЭПС характерно также накопление продуктов синтеза. Эндоплазматический ретикулум принимает участие в том числе и в создании новой ядерной оболочки (например после митоза). Эндоплазматический ретикулум содержит внутриклеточный запас кальция, который является, в частности, медиатором сокращения мышечной клетки. В клетках мышечных волокон расположена особая форма эндоплазматического ретикулума — саркоплазматическая сеть.
Функции агранулярного эндоплазматического ретикулума
Агранулярный эндоплазматический ретикулум участвует во многих процессах метаболизма. Также агранулярный эндоплазматический ретикулум играет важную роль в углеводном обмене, нейтрализации ядов и запасании кальция. Ферменты агранулярного эндоплазматического ретикулума участвуют в синтезе различных липидов и фосфолипидов, жирных кислот и стероидов. В частности, в связи с этим в клетках надпочечников и печени преобладает агранулярный эндоплазматический ретикулум.
Синтез гормонов
К гормонам, которые образуются в агранулярном ЭПС, принадлежат, например, половые гормоны позвоночных животных и стероидные гормоны надпочечников. Клетки яичек и яичников, ответственные за синтез гормонов, содержат большое количество агранулярного эндоплазматического ретикулума.
Накопление и преобразование углеводов
Углеводы в организме накапливаются в печени в виде гликогена. Посредством гликолиза гликоген в печени трансформируется в глюкозу, что является важнейшим процессом в поддержании уровня глюкозы в крови. Один из ферментов агранулярного ЭПС отщепляет от первого продукта гликолиза, глюкоза-6-фосфата, фосфогруппу, позволяя таким образом глюкозе покинуть клетку и повысить уровень сахаров в крови.
Нейтрализация ядов
Гладкий эндоплазматический ретикулум клеток печени принимает активное участие в нейтрализации всевозможных ядов. Ферменты гладкого ЭПР присоединяют к молекулам токсичных веществ гидрофильные радикалы, в результате чего повышается растворимость токсичных веществ в крови и моче, и они быстрее выводятся из организма. В случае непрерывного поступления ядов, медикаментов или алкоголя образуется большее количество агранулярного ЭПР, что повышает дозу действующего вещества, необходимую для достижения прежнего эффекта.
Роль ЭПС как депо кальция
Концентрация ионов кальция в ЭПС может достигать 10−3 моль, в то время как в цитозоле составляет порядка 10−7 моль (в состоянии покоя). Под действием инозитолтрифосфата и некоторых других стимулов кальций высвобождается из ЭПС путем облегченной диффузии. Возврат кальция в ЭПС обеспечивается активным транспортом. При этом мембрана ЭПС обеспечивает активный перенос ионов кальция против градиентов концентрации больших порядков. И приём, и освобождение ионов кальция в ЭПС находится в тонкой взаимосвязи с физиологическими условиями.
Концентрация ионов кальция в цитозоле влияет на множество внутриклеточных и межклеточных процессов, таких как активация или инактивация ферментов, экспрессия генов, синаптическая пластичность нейронов, сокращения мышечных клеток, освобождение антител из клеток иммунной системы.
Саркоплазматический ретикулум
Особую форму агранулярного эндоплазматического ретикулума, саркоплазматический ретикулум, представляет собой ЭПС в мышечных клетках, в которых ионы кальция активно закачиваются из цитоплазмы в полости ЭПР против градиента концентрации в невозбуждённом состоянии клетки и освобождаются в цитоплазму для инициации сокращения.
Функции гранулярного эндоплазматического ретикулума
Гранулярный эндоплазматический ретикулум имеет две функции: синтез белков и производство мембран.
Синтез белков
Белки, производимые клеткой, синтезируются на поверхности рибосом, которые могут быть присоединены к поверхности ЭПС. Полученные полипептидные цепочки помещаются в полости гранулярного эндоплазматического ретикулума (куда попадают и полипептидные цепочки, синтезированные в цитозоле), где впоследствии правильным образом обрезаются и сворачиваются. Таким образом, линейные последовательности аминокислот получают после транслокации в эндоплазматический ретикулум необходимую трёхмерную структуру, после чего повторно перемещаются в цитозоль.
Синтез мембран
Производством фосфолипидов ЭПР расширяет собственную поверхность мембраны, которая посредством транспортных везикул посылает фрагменты мембраны в другие части
Аппарат Гольджи
Материал из Википедии — свободной энциклопедии
Перейти к: навигация, поиск
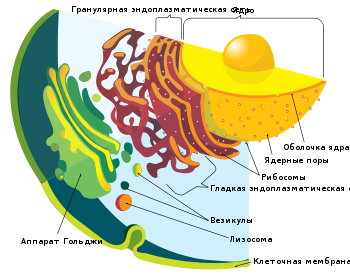
![]()
Аппарат Гольджи и другие мембранные органеллы эукариотической клетки
Аппарат Гольджи (комплекс Гольджи) — мембранная структура эукариотической клетки, органелла, в основном предназначенная для выведения веществ, синтезированных в эндоплазматическом ретикулуме. Аппарат Гольджи был назван так в честь итальянского учёного Камилло Гольджи, впервые обнаружившего его в 1897 году.[1]
Строение
Комплекс Гольджи представляет собой стопку дискообразных мембранных мешочков (цистерн), несколько расширенных ближе к краям, и связанную с ними систему пузырьков Гольджи. В растительных клетках обнаруживается ряд отдельных стопок (диктиосомы), в животных клетках часто содержится одна большая или несколько соединённых трубками стопок.
Транспорт веществ из эндоплазматической сети
Аппарат Гольджи асимметричен — цистерны, располагающиеся ближе к ядру клетки (цис-Гольджи) содержат наименее зрелые белки, к этим цистернам непрерывно присоединяются мембранные пузырьки — везикулы, отпочковывающиеся от гранулярного эндоплазматического ретикулума (ЭПР), на мембранах которого и происходит синтез белков рибосомами. Перемещение белков из эндоплазматической сети (ЭПС) в аппарат Гольджи происходит неизбирательно, однако не полностью или неправильно свернутые белки остаются при этом в ЭПС. Возвращение белков из аппарата Гольджи в ЭПС требует наличия специфической сигнальной последовательности (лизин-аспарагин-глутамин-лейцин) и происходит благодаря связыванию этих белков с мембранными рецепторами в цис-Гольджи.
Модификация белков в аппарате Гольджи
В цистернах аппарата Гольджи созревают белки предназначенные для секреции, трансмембранные белки плазматической мембраны, белки лизосом и т. д. Созревающие белки последовательно перемещаются по цистернам в органеллы, в которых происходят их модификации — гликозилирование и фосфорилирование. При О-гликозилировании к белкам присоединяются сложные сахара через атом кислорода. При фосфорилировании происходит присоединение к белкам остатка ортофосфорной кислоты.
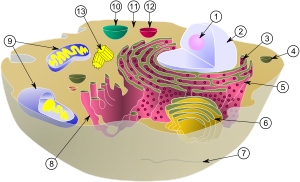
Схема, показывающая цитоплазму, вместе с ее компонентами (или органеллами), в типичной животной клетке. Органеллы: 1 — ядрышко; 2 — ядро; 3 — рибосома (маленькие точки); 4 — везикула; 5 — шероховатый эндоплазматический ретикулум (ER); 6 — аппарат Гольджи; 7 — цитоскелет; 8 — гладкий эндоплазматический ретикулум; 9 — митохондрия; 10 — вакуоль; 11 — цитоплазма; 12 — лизосома; 13 — центриоль и центросома.
Разные цистерны аппарата Гольджи содержат разные резидентные каталитические ферменты и, следовательно, с созревающими белками в них последовательно происходят разные процессы. Понятно, что такой ступенчатый процесс должен как-то контролироваться. Действительно, созревающие белки «маркируются» специальными полисахаридными остатками (преимущественно маннозными), по-видимому, играющими роль своеобразного «знака качества».
Не до конца понятно, каким образом созревающие белки перемещаются по цистернам аппарата Гольджи, в то время как резидентные белки остаются в большей или меньшей степени ассоциированы с одной цистерной. Существуют две взаимонеисключающие гипотезы, объясняющие этот механизм:
согласно первой, транспорт белков осуществляется при помощи таких же механизмов везикулярного транспорта, как и путь транспорта из ЭПР, причём резидентные белки не включаются в отпочковывающуюся везикулу;
согласно второй, происходит непрерывное передвижение (созревание) самих цистерн, их сборка из пузырьков с одного конца и разборка с другого конца органеллы, а резидентные белки перемещаются ретроградно (в обратном направлении) при помощи везикулярного транспорта.
Транспорт белков из аппарата Гольджи
В конце концов от транс-Гольджи отпочковываются пузырьки, содержащие полностью зрелые белки. Главная функция аппарата Гольджи — сортировка проходящих через него белков. В аппарате Гольджи происходит формирование «трехнаправленного белкового потока»:
созревание и транспорт белков плазматической мембраны;
созревание и транспорт секретов;
созревание и транспорт ферментов лизосом.
С помощью везикулярного транспорта прошедшие через аппарат Гольджи белки доставляются «по адресу» в зависимости от полученных ими в аппарате Гольджи «меток». Механизмы этого процесса также не до конца понятны. Известно, что транспорт белков из аппарата Гольджи требует участия специфических мембранных рецепторов, которые опознают «груз» и обеспечивают избирательную стыковку пузырька с той или иной органеллой.
Образование лизосом
Все гидролитические ферменты лизосом проходят через аппарат Гольджи, где они получают «метку» в виде специфического сахара — маннозо-6-фосфата (М6Ф)- в составе своего олигосахарида. Присоединение этой метки происходит при участии двух ферментов. Фермент N-ацетилглюкозаминфосфотрансфераза специфически опознает лизосомальные гидролазы по деталям их третичной структуры и присоединяет N-ацетилглюкозаминфосфат к шестому атому нескольких маннозных остатков олигосахарида гидролазы. Второй фермент — фосфогликозидаза — отщепляет N-ацетилглюкозамин, создавая М6Ф-метку. Затем эта метка опознается белком-рецептором М6Ф, с его помощью гидролазы упаковываются в везикулы и доставляются в лизосомы. Там, в кислой среде, фосфат отщепляется от зрелой гидролазы. При нарушении работы N-ацетилглюкозаминфосфотрансферазы из-за мутаций или при генетических дефектах рецептора М6Ф все ферменты лизосом «по умолчанию» доставляются к наружной мембране и секретируются во внеклеточную среду. Выяснилось, что в норме некоторое количество рецепторов М6Ф также попадают на наружную мембрану. Они возвращают случайно попавшие во внешнюю среду ферменты лизосом внутрь клетки в процессе эндоцитоза.
Транспорт белков на наружную мембрану
Как правило, ещё в ходе синтеза белки наружной мембраны встраиваются своими гидрофобными участками в мембрану эндоплазматической сети. Затем в составе мембраны везикул они доставляются в аппарат Гольджи, а оттуда — к поверхности клетки. При слиянии везикулы с плазмалеммой такие белки остаются в ее составе, а не выделяются во внешнюю среду, как те белки, что находились в полости везикулы.
Секреция
Практически все секретируемые клеткой вещества (как белковой, так и небелковой природы) проходят через аппарат Гольджи и там упаковываются в секреторные пузырьки. Так, у растений при участии диктиосом секретируется материал клеточной стенки.
Вакуоль — одномембранный органоид, содержащийся в некоторых эукариотических клетках и выполняющий различные функции (секреция, экскреция и хранение запасных веществ, аутофагия, автолиз и др.). Вакуоли и их содержимое рассматриваются как обособленный от цитоплазмы компартмент. Различают пищеварительные и сократительные (пульсирующие) вакуоли, регулирующие осмотическое давление и служащие для выведения из организма продуктов распада. Вакуоли особенно хорошо заметны в клетках растений: во многих зрелых клетках растений они составляют более половины объёма клетки. Одна из важных функций растительных вакуолей — накопление ионов и поддержание тургора (тургорного давления). Вакуоль — это место запаса воды. Вакуоли развиваются из цистерн эндоплазматической сети.
Мембрана, в которую заключена вакуоль, называется тонопласт.
В вакуолях содержатся органические кислоты, углеводы, дубильные вещества, неорганические вещества (нитраты, фосфаты, хлориды и др.), белки и др.
Дезоксирибонуклеи́новая кислота́ (ДНК) — макромолекула, обеспечивающая хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. Основная роль ДНК в клетках — долговременное хранение информации о структуре РНК и белков.
В клетках эукариотов (например, животных или растений) ДНК находится в ядре клетки в составе хромосом, а также в некоторых клеточных органоидах (митохондриях и пластидах). В клетках прокариотических организмов (бактерий и архей) кольцевая или линейная молекула ДНК, так называемый нуклеоид, прикреплена изнутри к клеточной мембране. У них и у низших эукариот (например, дрожжей) встречаются также небольшие автономные, преимущественно кольцевые молекулы ДНК, называемые плазмидами. Кроме того, одно- или двухцепочечные молекулы ДНК могут образовывать геном ДНК-содержащих вирусов.
С химической точки зрения ДНК — это длинная полимерная молекула, состоящая из повторяющихся блоков — нуклеотидов. Каждый нуклеотид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы. Связи между нуклеотидами в цепи образуются за счёт дезоксирибозы и фосфатной группы. В подавляющем большинстве случаев (кроме некоторых вирусов, содержащих одноцепочечную ДНК) макромолекула ДНК состоит из двух цепей, ориентированных азотистыми основаниями друг к другу. Эта двухцепочечная молекула спирализована. В целом структура молекулы ДНК получила название «двойной спирали».
В ДНК встречается четыре вида азотистых оснований (аденин, гуанин, тимин и цитозин). Азотистые основания одной из цепей соединены с азотистыми основаниями другой цепи водородными связями согласно принципу комплементарности: аденин соединяется только с тимином, гуанин — только с цитозином. Последовательность нуклеотидов позволяет «кодировать» информацию о различных типах РНК, наиболее важными из которых являются информационные, или матричные (мРНК), рибосомальные (рРНК) и транспортные (тРНК). Все эти типы РНК синтезируются на матрице ДНК за счёт копирования последовательности ДНК в последовательность РНК, синтезируемой в процессе транскрипции, и принимают участие в биосинтезе белков (процессе трансляции). Помимо кодирующих последовательностей, ДНК клеток содержит последовательности, выполняющие регуляторные и структурные функции. Кроме того, в геноме эукариот часто встречаются участки, принадлежащие «генетическим паразитам», например, транспозонам.
ДНК является носителем генетической информации, записанной в виде последовательности нуклеотидов с помощью генетического кода. С молекулами ДНК связаны два основополагающих свойства живых организмов — наследственность и изменчивость. В ходе процесса, называемого репликацией ДНК, образуются две копии исходной цепочки, наследуемые дочерними клетками при делении, таким образом образовавшиеся клетки оказываются генетически идентичны исходной.
Генетическая информация реализуется при экспрессии генов в процессах транскрипции (синтеза молекул РНК на матрице ДНК) и трансляции (синтеза белков на матрице РНК).
Последовательность нуклеотидов «кодирует» информацию о различных типах РНК: информационных, или матричных (мРНК), рибосомальных (рРНК) и транспортных (тРНК). Все эти типы РНК синтезируются на основе ДНК в процессе транскрипции. Роль их в биосинтезе белков (процессе трансляции) различна. Информационная РНК содержит информацию о последовательности аминокислот в белке, рибосомальные РНК служат основой для рибосом (сложных нуклеопротеиновых комплексов, основная функция которых — сборка белка из отдельных аминокислот на основе иРНК), транспортные РНК доставляют аминокислоты к месту сборки белков — в активный центр рибосомы, «ползущей» по иРНК.
Лизосома — (от греч. λύσις — растворяю и sōma — тело) клеточный органоид размером 0,2 — 0,4 мкм, один из видов везикул. Эти одномембранные органоиды — часть вакуома (эндомембранной системы клетки). Разные виды лизосом могут рассматриваться как отдельные клеточные компартменты.
Распространенность среди царств живой природы
Лизосомы были впервые описаны в 1955 году Кристианом де Дювом в животной клетке, а позже были обнаружены и в растительной. У растений к лизосомам по способу образования, а отчасти и по функциям близки вакуоли. Лизосомы есть также у большинства протистов (как с фаготрофным, так и с осмотрофным типом питания) и у грибов. Таким образом, наличие лизосом характерно для клеток всех эукариот. У прокариот лизосомы отсутствуют, так как у них отсутствует фагоцитоз и нет внутриклеточного пищеварения.
Признаки лизосом
Один из признаков лизосом — наличие в них ряда ферментов (кислых гидролаз), способных расщеплять белки, углеводы, липиды и нуклеиновые кислоты. К числу ферментов лизосом относятся катепсины (тканевые протеазы), кислая рибонуклеаза, фосфолипаза и др. Кроме того, в лизосомах присутствуют ферменты, которые способны отщеплять от органических молекул сульфатные (сульфатазы) или фосфатные (кислая фосфатаза) группы.
Для лизосом характерна кислая реакция внутренней среды. Обычно pH в лизосомах составляет около 4,5-5 (концентрация протонов на два порядка выше, чем в цитоплазме). Это обеспечивается активным транспортом протонов, который осуществляет встроенный в мембраны лизосом белок-насос протонная АТФаза.
Высокая активность кислой фосфатазы ранее использовалась как один из маркеров лизосом. В настоящее время более надежным маркером считается присутствие специфических мембранных гликопротеидов — LAMP1 и LAMP2. Они присутствуют на мембране лизосом и поздних эндосом, но отсутствуют на мембранах других компартментов вакуома.
Образование лизосом и их типы
Лизосомы формируются из пузырьков (везикул), отделяющихся от аппарата Гольджи, и пузырьков (эндосом), в которые попадают вещества при эндоцитозе. В образовании аутолизосом (аутофагосом) принимают участие мембраны эндоплазматического ретикулума. Все белки лизосом синтезируются на «сидячих» рибосомах на внешней стороне мембран эндоплазматического ретикулума и затем проходят через его полость и через аппарат Гольджи.
Лизосомы — гетерогенные органеллы, имеющие разную форму, размеры, ультраструктурные и цитохимические особенности. «Типичные» лизосомы животных клеток обычно имеют размеры 0,1-1 мкм, сферическую или овальную форму. Число лизосом варьирует от одной (крупная вакуоль во многих клетках растений и грибов) до нескольких сотен или тысяч (в клетках животных).
Общепринятой классификации и номенклатуры для разных стадий созревания и типов лизосом нет. Различают первичные и вторичные лизосомы. Первые образуются в области аппарата Гольджи, в них находятся ферменты в неактивном состоянии, вторые же содержат активные ферменты. Обычно ферменты лизосом активируются при понижении рН. Среди лизосом можно также выделить гетеролизосомы (переваривающие материал, поступающий в клетку извне — путем фаго- или пиноцитоза) и аутолизосомы (разрушающие собственные белки или органоиды клетки). Наиболее широко используется следующая классификация лизосом и связанных с ними компартментов:
Ранняя эндосома — в нее поступают эндоцитозные (пиноцитозные) пузырьки. Из ранней эндосомы рецепторы, отдавшие (из-за пониженного рН) свой груз, возвращаются на наружную мембрану.
Поздняя эндосома — в нее из ранней эндосомы поступают пузырьки с материалом, поглощенном при пиноцитозе, и пузырьки из аппарата Гольджи с гидролазами. Рецепторы маннозо-6-фосфата возвращаются из поздней эндосомы в аппарат Гольджи.
Лизосома — в нее из поздней эндосомы поступают пузырьки со смесью гидролаз и перевариваемого материала.
Фагосома — в нее попадают более крупные частицы (бактерии и т. п.), поглощенные путем фагоцитоза. Фагосомы обычно сливаются с лизосомой.
Аутофагосома — окруженный двумя мембранами участок цитоплазмы, обычно включающий какие-либо органоиды и образующийся при макроаутофагии. Сливается с лизосомой.
Мультивезикулярные тельца — обычно окружены одинарной мембраной, содержат внутри более мелкие окруженные одинарной мембраной пузырьки. Образуются в результате процесса, напоминающего микроаутофагию (см. ниже), но содержат материал, полученный извне. В мелких пузырьках обычно остаются и затем подвергаются деградации рецепторы наружной мембраны (например, рецепторы эпидермального фактора роста). По стадии формирования соответствуют ранней эндосоме. Описано образование мультивезикулярных телец, окруженных двумя мембранами, путем отпочковывания от ядерной оболочки.
Остаточные тельца (телолизосомы) — пузырьки, содержащие непереваренный материал (в частности, липофусцин). В нормальных клетках сливаются с наружной мембраной и путем экзоцитоза покидают клетку. При старении или патологии накапливаются.
Функции лизосом
Функциями лизосом являются:
переваривание захваченных клеткой при эндоцитозе веществ или частиц (бактерий, других клеток)
аутофагия — уничтожение ненужных клетке структур, например, во время замены старых органоидов новыми, или переваривание белков и других веществ, произведенных внутри самой клетки
автолиз — самопереваривание клетки, приводящее к ее гибели (иногда этот процесс не является патологическим, а сопровождает развитие организма или дифференцировку некоторых специализированных клеток). Пример: При превращении головастика в лягушку, лизосомы, находящиеся в клетках хвоста, переваривают его: хвост исчезает, а образовавшиеся во время этого процесса вещества всасываются и используются другими клетками тела.
растворение внешних структур (см, например, остеокласты)
Внутриклеточное пищеварение и участие в обмене веществ
У многих протистов и у животных, имеющих внутриклеточное пищеварение, лизосомы участвуют в переваривании пищи, захваченной путем эндоцитоза. При этом лизосомы сливаются с пищеварительными вакуолями. У протистов непереваренные остатки пищи обычно удаляются из клетки при слиянии пищеварительной вакуоли с наружной мембраной.
Многие клетки животных, у которых преобладает полостное пищеварение (например, хордовые) получают питательные вещества из межклеточной жидкости или плазмы крови с помощью пиноцитоза. Эти вещества также вовлекаются в обмен веществ клетки после их переваривания в лизосомах. Хорошо изученный пример такого участия лизосом в обмене веществ — получение клетками холестерина. Холестерин, приносимый кровью в виде ЛПНП, поступает внутрь пиноцитозных везикул после соединения ЛПНП с рецепторами ЛПНП на мембране. Рецепторы возвращаются к мембране из ранней эндосомы, а ЛПНП поступают в лизосомы. После этого ЛПНП перевариваются, а высвободившийся холестерин через мембрану лизосом поступает в цитоплазму.
Косвенно лизосомы участвуют в обмене, обеспечивая десенсибилизацию клеток к воздействию гормонов. При длительном действии гормона на клетку часть рецепторов, связавших гормон, поступают в эндосомы и затем деградируют внутри лизосом. Снижение числа рецепторов понижает чувствительность клетки к гормону.
Для крупных вакуолей растений характерна запасающая функция — в них могут накапливаться ионы, пигменты (например, антоцианы), вторичные метаболиты, белки (в алейроновых зернах эндосперма злаков). Внутри вакуолей (например, в прорастающих семенах) у растений происхдят и процессы переваривания запасенных белков.
Аутофагия
Обычно различают два типа аутофагии — микроаутофагия и макроаутофагия. При микроаутофагии, как при образовании мультивезикулярных телец, образуются впячивания мембраны эндосомы или лизосомы, которые затем отделяются в виде внутренних пузырьков, только в них попадают вещества, синтезированные в самой клетке. Таким путем клетка может переваривать белки при нехватке энергии или строительного материала (например, при голодании). Но процессы микроаутофагии происходят и при нормальных условиях и в целом неизбирательны. Иногда в ходе микроаутофагии перевариваются и органоиды; так, у дрожжей описана микроаутофагия пероксисом и частичная микроаутофагия ядер, при которой клетка сохраняет жизнеспособность.
При макроаутофагии участок цитоплазмы (часто содержащий какие-либо органоиды) окружается мембранным компартментом, похожим на цистерну эндоплазматической сети. В результате этот участок оказывается отгорожен от остальной цитоплазмы двумя мембранами. Затем такая аутофагосома сливается с лизосомой, и ее содержимое переваривается. Видимо, макроаутофагия также неизбирательна, хотя часто подчеркивается, что с помощью нее клетка может избавляться от «отслуживших свой срок» органоидов (митохондрий, рибосом и др.).
Третий тип аутофагии — шаперон-зависимая. При этом способе происходит направленный транспорт частично денатурировавших белков из цитоплазмы сквозь мембрану лизосомы в ее полость.
Автолиз
Ферменты лизосом нередко высвобождаются при разрушении мембраны лизосомы. Обычно при этом они инактивируются в нейтральной среде цитоплазмы. Однако при одновременном разрушении всех лизосом клетки может произойти ее саморазрушение — автолиз. Различают патологический и обычный автолиз. Распространенный вариант патологического автолиза — посмертный автолиз тканей.
В норме процессы автолиза сопровождают многие явления, связанные с развитием организма и дифференцировкой клеток. Так, аутолиз клеток описывается как механизм разрушения тканей у личинок насекомых при полном превращении, а также при рассасывании хвоста у головастика. Правда, эти описания относятся к периоду, когда различия между апоптозом и некрозом еще не были установлены, и в каждом случае требуется выяснять, не лежит ли на самом деле в основе деградации органа или ткани апоптоз, не связанный с автолизом.
У растений автолизом сопровождается дифференциация клеток, которые функционируют после смерти (например, трахеид или члеников сосудов). Частичный автолиз происходит и при созревании клеток флоэмы- члеников ситовидных трубок.
Клиническое значение. Болезни, связанные с нарушением работы лизосом
Иногда из-за неправильной работы лизосом развиваются болезни накопления, при которых ферменты из-за мутаций не работают или работают плохо. Примером болезней накопления может служить амавротическая идиотия при накоплении гликогена.
Разрыв лизосомы и выход в гиалоплазму расщепляющих ферментов сопровождается резким повышением их активности. Такого рода повышение активности ферментов наблюдается, например, в очагах некроза при инфаркте миокарда и при действии излучения.
Митохондрия
Материал из Википедии — свободной энциклопедии
(перенаправлено с «Митохондрии»)
Перейти к: навигация, поиск
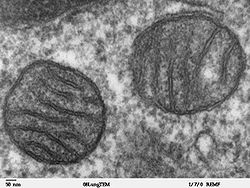
Электронномикроскопическая фотография, показывающая митохондрии млекопитающего в поперечном сечении
Митохондрия (от греч. μίτος — нить и χόνδρος — зёрнышко, крупинка) — двумембранная гранулярная или нитевидная органелла толщиной около 0,5 мкм. Характерна для большинства эукариотических клеток как автотрофов (фотосинтезирующие растения), так и гетеротрофов (грибы, животные). Энергетическая станция клетки; основная функция — окисление органических соединений и использование освобождающейся при их распаде энергии в синтезе молекул АТФ, который происходит за счёт движения электрона по электронно-транспортной цепи белков внутренней мембраны. Количество митохондрий в клетках различных организмов существенно отличается: так, одноклеточные зелёные водоросли (эвглена, хлорелла, политомелла) и трипаносомы имеют лишь одну гигантскую митохондрию, тогда как ооцит и амёба Chaos chaos содержат 300000 и 500000 митохондрий соответственно; у кишечных анаэробных энтамёб и некоторых других паразитических простейших митохондрии отсутствуют.
Происхождение митохондрий
В соответствии с теорией симбиогенеза, митохондрии появились в результате того, что примитивные клетки (прокариоты), которые не могли сами использовать кислород для генерирования энергии и что накладывало серьёзные ограничения на возможности развития, захватывали бактерии (прогеноты), которые могли это делать. В процессе развития таких отношений прогеноты передали множество своих генов сформировавшемуся, благодаря повысившейся энергоэффективности, ядру теперь уже эукариот.[1] Вот почему современные митохондрии больше не являются самостоятельными организмами. Хотя их геном кодирует компоненты собственной системы синтеза белка, многие ферменты и белки, необходимые для их функции, кодируются хромосомами, синтезируются в клетке и только потом транспортируются в органеллы.
Митохондрии в клетке
Впервые митохондрии обнаружены в виде гранул в мышечных клетках в 1850 году. Число митохондрий в клетке непостоянно. Их особенно много в клетках, в которых потребность в кислороде велика. По своему строению они представляют собой цилиндрические органеллы, встречающиеся в эукариотической клетке в количестве от нескольких сот до 1-2 тысяч и занимающие 10-20 % её внутреннего объёма. Сильно варьируют так же размеры (от 1 до 70 мкм) и форма митохондрий. При этом ширина этих органелл относительно постоянна (0,5-1 мкм). Способны изменять форму. В зависимости от того, в каких участках клетки в каждый конкретный момент происходит повышенное потребление энергии, митохондрии способны перемещаться по цитоплазме в зоны наибольшего энергопотребления, используя для движения структуры цитоскелета эукариотической клетки.
Альтернативой множеству разрозненных небольших митохондрий, функционирующих независимо друг от друга и снабжающих АТФ небольшие участки цитоплазмы, является существование длинных и разветвлённых митохондрий, каждая из которых может энергетически обеспечивать отдалённые друг от друга участки клетки (например, у одноклеточных зелёных водорослей Chlorella). Вариантом такой протяжённой системы может также являться упорядоченное пространственное объединение множества митохондрий (хондриом или митохондрион), обеспечивающее их кооперативную работу и встречающееся как у одноклеточных, так и у многоклеточных организмов. Особенно сложно этот тип хондриома устроен в скелетных мышцах млекопитающих, где группы гигантских разветвлённых митохондрий связаны друг с другом с помощью межмитохондриальных контактов (ММК). Последние образованы плотно прилегающими друг к другу наружными митохондриальными мембранами, в результате чего межмембранное пространство в этой зоне имеет повышенную электронную плотность. Особенно обильно ММК представлены в клетках сердечных мышц, где они связывают множественные отдельные митохондрии в согласованную работающую кооперативную систему.
Структура митохондрий

Схема строения митохондрии
Наружная мембрана
Наружная мембрана митохондрии имеет толщину около 7 нм, не образует впячиваний и складок, и замкнута сама на себя. На наружную мембрану приходится около 7 % от площади поверхности всех мембран клеточных органелл. Основная функция — отграничение митохондрии от цитоплазмы. Наружная мембрана митохондрии состоит из билипидного слоя и пронизывающих его белков; соотношение липидов и белков по массе — примерно 1:1. Особую роль играет порин — каналообразующий белок: он формирует в наружной мембране отверстия диаметром 2-3 нм, через которые могут проникать небольшие молекулы и ионы весом до 5 кДа. Крупные молекулы могут пересекать наружную мембрану только посредством активного транспорта через транспортные белки митохондриальных мембран. Для наружной мембраны характерно присутствие ферментов: монооксигеназы, ацил-СоА-синтетазы и фосфолипазы А2. Наружная мембрана митохондрии может взаимодействовать с мембраной эндоплазматического ретикулума; это играет важную роль в транспортировке липидов и ионов кальция.
Межмембранное пространство
Межмембранное пространство представляет собой пространство между наружной и внутренней мембранами митохондрии. Его толщина — 10-20 нм. Так как наружная мембрана митохондрии проницаема для небольших молекул и ионов, их концентрация в периплазматическом пространстве мало отличается от таковой в цитоплазме. Напротив, крупным белкам для транспорта из цитоплазмы в периплазматическое пространство необходимо иметь специфические сигнальные пептиды; поэтому белковые компоненты периплазматического пространства и цитоплазмы различны. Одним из белков, содержащихся в периплазматическом пространстве, является цитохром c — один из компонентов дыхательной цепи митохондрий.
Внутренняя мембрана
Внутренняя мембрана образует многочисленные гребневидные складки — кристы, существенно увеличивающие площадь ее поверхности и, например, в клетках печени составляет около трети всех клеточных мембран. Характерной чертой состава внутренней мембраны митохондрий является присутствие в ней кардиолипина — особого фосфолипида, содержащего сразу четыре жирные кислоты и делающего мембрану абсолютно непроницаемой для протонов. Ещё одна особенность внутренней мембраны митохондрий — очень высокое содержание белков (до 70 % по весу), представленных транспортными белками, ферментами дыхательной цепи, а также крупными АТФ-синтетазными комплексами. Внутренняя мембрана митохондрии в отличие от внешней не имеет специальных отверстий для транспорта мелких молекул и ионов; на ней, на стороне, обращенной к матриксу, располагаются особые молекулы АТФ-синтазы, состоящие из головки, ножки и основания. При прохождении через них протонов происходит синтез АТФ. В основании частиц, заполняя собой всю толщу мембраны, располагаются компоненты дыхательной цепи. Наружная и внутренняя мембраны в некоторых местах соприкасаются, там находится специальный белок-рецептор, способствующий транспорту митохондриальных белков, закодированных в ядре, в матрикс митохондрии.
Матрикс
Матрикс — ограниченное внутренней мембраной пространство. В матриксе (розовом веществе) митохондрии находятся ферментные системы окисления пирувата жирных кислот, а также ферменты цикла трикарбоновых кислот (цикла Кребса). Кроме того, здесь же находится митохондриальная ДНК, РНК и собственный белоксинтезирующий аппарат митохондрии.
Митохондриальная ДНК
Находящаяся в матриксе митохондриальная ДНК представляет собой замкнутую кольцевую двуспиральную молекулу, в клетках человека имеющую размер 16569 нуклеотидных пар, что приблизительно в 105 раз меньше ДНК, локализованной в ядре. В целом митохондриальная ДНК кодирует 2 рРНК, 22 тРНК и 13 субъединиц ферментов дыхательной цепи, что составляет не более половины обнаруживаемых в ней белков. В частности, под контролем митохондрального генома кодируются семь субъединиц АТФ-синтетазы, три субъединицы цитохромоксидазы и одна субъединица убихинол-цитохром-с-редуктазы. При этом все белки, кроме одного, две рибосомные и шесть тРНК транскрибируются с более тяжёлой (наружной) цепи ДНК, а 14 других тРНК и один белок транскрибируются с более лёгкой (внутренней) цепи.
На этом фоне геном митохондрий растений значительно больше и может достигать 370000 нуклеотидных пар, что примерно в 20 раз больше описанного выше генома митохондрий человека. Количество генов здесь также примерно в 7 раз больше, что сопровождается появлением в митохондриях растений дополнительных путей электронного транспорта, не сопряжённых с синтезом АТФ.
Митохондриальная ДНК реплицируется в интерфазе, что частично синхронизировано с репликацией ДНК в ядре. Во время же клеточного цикла митохондрии делятся надвое путём перетяжки, образование которой начинается с кольцевой бороздки на внутренней митохондриальной мембране. Детальное изучение нуклеотидной последовательности митохондриального генома позволило установить то, что в митохондриях животных и грибов нередки отклонения от универсального генетического кода. Так, в митохондриях человека кодон ТАТ вместо изолейцина в стандартном коде кодирует аминокислоту метионин, кодоны ТСТ и ТСС, обычно кодирующие аргинин, являются стоп-кодонами, а кодон АСТ, в стандартном коде являющийся стоп-кодоном, кодирует аминокислоту метионин. Что касается митохондрий растений, то, по-видимому, они используют универсальный генетический код. Другой чертой митохондрий является особенность узнавания кодонов тРНК, заключающаяся в том, что одна подобная молекула способна узнавать не один, но сразу три или четыре кодона. Указанная особенность снижает значимость третьего нуклеотида в кодоне и приводит к тому, что митохондрии требуется меньшее разнообразие типов тРНК. При этом достаточным количеством оказываются всего 22 различных тРНК.
Имея собственный генетический аппарат, митохондрия обладает и собственной белоксинтезирующей системой, особенностью которой в клетках животных и грибов являются очень маленькие рибосомы, характеризуемые коэффициентом седиментации 55S, что даже ниже аналогичного показателя у 70s-рибосом прокариотического типа. При этом две большие рибосомные РНК также имеют меньшие размеры, чем у прокариот, а малая рРНК вообще отсутствует. В митохондриях растений, напротив, рибосомы более сходны с прокариотическими по размерам и строению.
Митохондриальные белки
Количество транслируемых с митохондриальной мРНК белков, формирующих субъединицы крупных ферментных комплексов, ограниченно. Значительная часть белков кодируется в ядре и синтезируется на цитоплазматических 80S рибосомах. В частности, так образуются некоторые белки — переносчики электронов, митохондриальные транслоказы, компоненты транспорта белков в митохондрии, а также факторы, необходимые для транскрипции, трансляции и репликации митохондриальной ДНК. При этом подобные белки на своём N-конце имеют особые сигнальные пептиды, размер которых варьирует от 12 до 80 аминокислотных остатков. Данные участки формируют амфифильные завитки, обеспечивают специфический контакт белков со связывающими доменами митохондриальных распознающих рецепторов, локализованных на наружной мембране. До наружной мембраны митохондрии данные белки транспортируются в частично развёрнутом состоянии в ассоциации с белками-шаперонами (в частности — с hsp70). После переноса через наружную и внутреннюю мембраны в местах их контактов поступающие в митохондрию белки вновь связываются с шаперонами, но уже собственного митохондриального происхождения, которые подхватывают пересекающий мембраны белок, способствуют его втягиванию в митохондрию, а также контролируют процесс правильного сворачивания полипептидной цепи. Большинство шаперонов обладает АТФазной активностью, в результате чего как транспорт белков в митохондрию, так и образование их функционально активных форм являются энергозависимыми процессами.
Функции митохондрий и энергообразование
Основной функцией митохондрий является синтез АТФ — универсальной формы химической энергии в любой живой клетке. Как и у прокариот, данная молекула может образовываться двумя путями: в результате субстратного фосфорилирования в жидкой фазе (например, при гликолизе) или в процессе мембранного фосфорилирования, связанного с использованием энергии трансмембранного электрохимического градиента (англ.)русск. протонов (ионов водорода). Митохондрии реализуют оба эти пути, первый из которых характерен для начальных процессов окисления субстрата и происходит в матриксе, а второй завершает процессы энергообразования и связан с кристами митохондрий. При этом своеобразие митохондрий как энергообразующих органелл эукариотической клетки определяет именно второй путь генерации АТФ, получивший название «хемиосмотического сопряжения». По сути это последовательное превращение химической энергии восстанавливающих эквивалентов НАДН в электрохимический протонный градиент ΔμН+ по обе стороны внутренней мембраны митохондрии, что приводит в действие мембранно-связанную АТФ-синтетазу и завершается образованием макроэргической связи в молекуле АТФ.
В целом весь процесс энергообразования в митохондриях может быть разбит на четыре основные стадии, первые две из которых протекают в матриксе, а две последние — на кристах митохондрий:
Превращение поступивших из цитоплазмы в митохондрию пирувата и жирных кислот в ацетил-СоА;
Окисление ацетил-СоА в цикле Кребса, ведущее к образованию НАДН;
Перенос электронов с НАДН на кислород по дыхательной цепи;
Образование АТФ в результате деятельности мембранного АТФ-синтетазного комплекса.
Ещё в цитоплазме в серии из 10 отдельных ферментативных реакций шестиуглеродная молекула глюкозы частично окисляется до двух трёхуглеродных молекул пирувата с образованием двух молекул АТФ. Затем пируват переносится из цитозоля через наружную и внутреннюю мембраны в матрикс, где первоначально превращается в ацетил-СоА. Этот процесс катализируется крупным пируватдегидрогеназным комплексом, имеющим размер, сопоставимый с размером рибосомы, и состоящим из трёх ферментов, пяти коферментов и двух регуляторных белков. Точно также жирные кислоты, полученные при расщеплении нерастворимых триглицеридов в цитоплазме, переносятся в митохондриальный матрикс в виде ацетил-СоА-производных.
На следующем этапе, также протекающем в матриксе митохондрии, ацетил-СоА полностью окисляется в цикле Кребса. В его работе задействованы четыре отдельных фермента, за каждый цикл обеспечивающие укорочение углеводородной цепи на два атома углерода, которые в дальнейшем превращаются в СО2. Этот процесс обеспечивает образование одной молекулы АТФ, а также НАДН — высокоэнергетического промежуточного соединения, которое легко отдаёт электроны в цепь переноса электронов на кристах митохондрий.
Дальнейшие процессы энергообразования в митохондрии происходят на её кристах и связаны с переносом электронов от НАДН к кислороду. В соответствии с тем, что потребление кислорода в качестве окислителя обычно называют «внутриклеточным дыханием», электронно-транспортную цепь ферментов, осуществляющих последовательный перенос электронов от НАДН к кислороду, часто называют «дыхательной цепью». При этом трансформация энергии окисления осуществляется ферментами, расположенными на кристах митохондрий и осуществляющими векторный (направленный по отношению к сторонам мембраны) перенос протонов водорода из матрикса митохондрии в межмембранное пространство. В этом состоит принципиальное отличие работы оксидоредуктаз дыхательной цепи от функционирования ферментов, катализирующих реакции в гомогенном (изотропном) растворе, где вопрос о направлении реакции в пространстве не имеет смысла.
Весь процесс переноса электрона по дыхательной цепи может быть разбит на три стадии, каждая из которых катализируется отдельным трансмембранным липопротеидным комплексом (I, III и IV), встроенным в мембрану кристы митохондрии. В состав каждого из названных комплексов входят следующие компоненты:
Большой олигомерный фермент, катализирующий перенос электронов;
Небелковые органические (простетические) группы, принимающие и высвобождающие электроны;
Белки, обеспечивающие движение электронов.
Каждый из этих комплексов осуществляет перенос электронов от донора к акцептору по градиенту редокс-потенциала через ряд последовательно функционирующих переносчиков. В качестве последних в дыхательной цепи митохондрий функционируют мигрирующие в плоскости мембраны жирорастворимые молекулы убихинона, а также небольшие (молекулярная масса 13кДа) водорастворимые белки, содержащие ковалентно связанный гем и называемые «цитохромами с». При этом три из пяти компонентов, составляющих дыхательную цепь, работают так, что перенос электронов сопровождается переносом протонов через мембрану крист митохондрий в направлении из матрикса в межмембранное пространство.
Дыхательная цепь начинается с комплекса I (НАДН-убихинон-оксидоредуктаза), состоящего из 16-26 полипептидных цепей и имеющего молекулярную массу около 850 кДа. Функциональная активность этого комплекса определяется тем, что он содержит в своём составе более 20 атомов железа, упакованных в ячейки из атомов серы, а также флавин (Фл — производное витамина рибофлавина). Комплекс I катализирует окисление НАДН, отщепляя от него два электрона, которые после «путешествия» по окислительно-восстановительным компонентам комплекса I попадают на молекулу-переносчик, в качестве которой выступает убихинон (Q). Последний способен ступенчато восстанавливаться, принимая на себя по два электрона и протона и, таким образом, превращаясь в восстановленную форму — убихинол (QH2).
Энергетический потенциал (запас энергии) в молекуле убихинола существенно ниже, чем в молекуле НАДН, а разница в подобной энергии временно запасается в виде особого вида — электрохимического протонного градиента. Последний возникает в результате того, что перенос электронов по простетическим группам комплекса I, ведущий к снижению энергетического потенциала электронов, сопровождается трансмембранным переносом двух протонов из матрикса в межмембранное пространство митохондрии.
Восстановленный убихинол мигрирует в плоскости мембраны, где достигает второго фермента дыхательной цепи — комплекса III (bc1). Последний представляет собой димер из субъединиц b и c1 с молекулярной массой более 300 кДа, сформированный из восьми полипептидных цепей и содержащий атомы железа как в серных ячейках, так и в виде комплексов с гемами b(I), b(II) и c1 — сложными гетероциклическими молекулами с четырьмя атомами азота, расположенными по углам металлосвязывающего квадрата. Комплекс III катализирует реакцию восстановления убихинола до убихинона с передачей электронов на атом железа второй молекулы переносчика (находящегося в межмембранном пространстве цитохрома c). Отщепляющиеся при этом от убихинола два протона водорода освобождаются в межмембранное пространство, продолжая формирование электрохимического градиента. Наконец, ещё два протона водорода переносятся в межмембранное пространство митохондрии за счёт энергии электронов, проходящих по простетических группам комплекса III.
Последняя стадия катализируется комплексом IV (цитохром c-оксидаза) с молекулярной массой около 200 кДа, состоящим из 10-13 полипептидных цепей и, помимо двух различных гемов, включающим также несколько атомов меди, прочно связанных с белками. При этом электроны, отбираемые у восстановленного цитохрома c, пройдя по атомам железа и меди в составе комплекса IV, попадают на связанный в активном центре этого фермента кислород, что приводит к образованию воды.
Таким образом, суммарная реакция, катализируемая ферментами дыхательной цепи, состоит в окислении НАДН кислородом с образованием воды. По сути этот процесс заключается в ступенчатом переносе электронов между атомами металлов, присутствующих в простетических группах белковых комплексов дыхательной цепи, где каждый последующий комплекс обладает более высоким сродством к электрону, чем предыдущий. При этом сами электроны передаются по цепи до тех пор, пока не соединятся с молекулярным кислородом, обладающим наибольшим сродством к электронам. Освобождаемая же при этом энергия запасается в виде электрохимического (протонного) градиента по обе стороны внутренней мембраны митохондрий. При этом считается, что в процессе транспорта по дыхательной цепи пары электронов перекачивается от трёх до шести протонов.
Завершающим этапом функционирования митохондрии является генерация АТФ, осуществляемая встроенным во внутреннюю мембрану специальным макромолекулярным комплексом с молекулярной массой 500 кДа. Этот комплекс, называемый АТФ-синтетазой, как раз и катализирует синтез АТФ путём конверсии энергии трансмембранного электрохимического градиента протонов водорода в энергию макроэргической связи молекулы АТФ.
АТФ-синтаза
В структурно-функциональном плане АТФ-синтаза состоит из двух крупных фрагментов, обозначаемых символами F1 и F0. Первый из них (фактор сопряжения F1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы, которые вместе образуют гексамер (αβ)3, имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°. В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса F0. Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F1.
Мембранная часть АТФ-синтазы, называемая фактором сопряжения F0, представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода. Всего в состав комплекса F0 входит одна белковая субъединица типа а, две копии субъединицы b, а также от 9 до 12 копий мелкой субъединицы c. Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F1, а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F1 в сторону F0 субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Таким образом, в молекуле АТФ-синтазы можно выделить две группы белковых субъединиц, которые могут быть уподоблены двум деталям мотора: ротору и статору. «Статор» неподвижен относительно мембраны и включает в себя шарообразный гексамер (αβ)3, находящуюся на его поверхности и субъединицу δ, а также субъединицы a и b мембранного комплекса F0. Подвижный относительно этой конструкции «ротор» состоит из субъединиц γ и ε, которые, заметно выступая из комплекса (αβ)3, соединяются с погружённым в мембрану кольцом из субъединиц c.
Способность синтезировать АТФ — свойство единого комплекса F0F1, сопряжённого с переносом протонов водорода через F0 к F1, в последнем из которых как раз и расположены каталитические центры, осуществляющие преобразование АДФ и фосфата в молекулу АТФ. Движущей же силой для работы АТФ-синтазы является протонный потенциал, создаваемый на внутренней мембране митохондрий в результате работы цепи электронного транспорта.
Сила, приводящая в движение «ротор» АТФ-синтазы, возникает при достижении разности потенциалов между наружной и внутренней сторонами мембраны > 220 мВ и обеспечивается потоком протонов, протекающих через специальный канал в F0, расположенный на границе между субъединицами a и c. При этом путь переноса протонов включает в себя следующие структурные элементы:
Два расположенных несоосно «полуканала», первый из которых обеспечивает поступление протонов из межмембранного пространства к существенно важным функциональным группам F0, а другой обеспечивает их выход в матрикс митохондрии;
Кольцо из субъединиц c, каждая из которых в своей центральной части содержит протонируемую карбоксильную группу, способную присоединять H+ из межмембранного пространства и отдавать их через соответствующие протонные каналы. В результате периодических смещений субъединиц с, обусловленных потоком протонов через протонный канал происходит поворот субъединицы γ, погружённой в кольцо из субъединиц с.
Таким образом, каталитическая активность АТФ-синтазы непосредственно связана с вращением её «ротора», при котором поворот субъединицы γ вызывает одновременное изменение конформации всех трёх каталитических субъединиц β, что в конечном счёте и обеспечивает работу фермента. При этом в случае образования АТФ «ротор» крутится по часовой стрелке со скоростью четыре оборота в секунду, а само подобное вращение происходит дискретными скачками по 120°, каждый из которых сопровождается образованием одной молекулы АТФ.
Непосредственная функция синтеза АТФ локализована на β-субъединицах сопрягающего комплекса F1. При этом самым первым актом в цепи событий, приводящих к образованию АТФ, является связывание АДФ и фосфата с активным центром свободной β-субъединицы, находящейся в состоянии 1. За счёт энергии внешнего источника (тока протонов) в комплексе F1 происходят конформационные изменения, в результате которых АДФ и фосфат становятся прочно связанными с каталитическим центром (состояние 2), где становится возможным образование ковалентной связи между ними, ведущей к образованию АТФ. На данной стадии АТФ-синтазы ферменту практически не требуется энергии, которая будет необходима на следующем этапе для освобождения прочно связанной молекулы АТФ из ферментативного центра. Поэтому следующий этап работы фермента заключается в том, чтобы в результате энергозависимого структурного изменения комплекса F1 каталитическая β-субъединица, содержащая прочно связанную молекулу АТФ, перешла в состояние 3, в котором связь АТФ с каталитическим центром ослаблена. В результате этого молекула АТФ покидает фермент, а β-субъединица возвращается в исходное состояние 1, благодаря чему обеспечивается цикличность работы фермента.
Работа АТФ-синтазы связана с механическими движениями её отдельных частей, что позволило отнести этот процесс к особому типу явлений, названных «вращательным катализом». Подобно тому, как электрический ток в обмотке электродвигателя приводит в движение ротор относительно статора, направленный перенос протонов через АТФ-синтетазу вызывает вращение отдельных субъединиц фактора сопряжения F1 относительно других субъединиц ферментного комплекса, в результате чего это уникальное энергообразующее устройство совершает химическую работу — синтезирует молекулы АТФ. В дальнейшем АТФ поступает в цитоплазму клетки, где расходуется на самые разнообразные энергозависимые процессы. Подобный перенос осуществляется специальным встроенным в мембрану митохондрий ферментом АТФ/АДФ-транслоказой, который обменивает вновь синтезированную АТФ на цитоплазматическую АДФ, что гарантирует сохранность фонда адениловых нуклеотидов внутри митохондрий.
Митохондрии и наследственность
ДНК митохондрий наследуются почти исключительно по материнской линии. Каждая митохондрия имеет несколько участков нуклеотидов в ДНК, идентичных во всех митохондриях (то есть в клетке много копий митохондриальных ДНК), что очень важно для митохондрий, неспособных восстанавливать ДНК от повреждений (наблюдается высокая частота мутаций). Мутации в митохондриальной ДНК являются причиной целого ряда наследственных заболеваний человека.
