
- •«Химия» пәні бойынша Глоссарий Әдістемелік нұсқау
- •1 Ағымдағы бақылауға арналған сұрақтары.
- •Химиялық периодтылықтың физикалық мағынасы
- •2 Ағымдағы бақылауға арналған сұрақтары
- •Атомдар құрылымы. Атом құрылымының моделдері. Планк гипотезасы.
- •Атомның квантты-механикалық моделі. Кванттық сандар.
- •Электрондардың кванттық саны
- •3. Негізгі және қоздырылмаған жағадайы: Мысалы - Be 1s22s2 – негізгі жағдайы; 1s22s12p1 – қоздырылған жағдайы.
- •Менделеевтің периодтық жүйесі мен заңы.
- •Химиялық периодтылықтың физикалық мағынасы
- •Химиялық байланыстар туралы түсінікті дамыту. Валентті байланыстың әдістері. Гибризидация теориясы. Еселенген байланыс.
- •Химиялық термодинамика. Термодинамиканың 1 заңы.
- •Термодинамиканың 2 заңы. Энтропия. Гиббс энергиясы.
- •Химиялық кинетика. Химиялық реакциялардың жүруінің негізгі заңдылықтары.
- •Химиялық реакция жылдамдығына концентрацияның әсері.
- •Химиялық реакцияның жылдамдығына температураның әсері. Вант-Гофф ережесі
- •Массаның әрекеттесу заңы. Химиялық тепе-теңдік.
- •Катализатор тепе-теңдік жағдайына әсер етпейді.
- •Химиялық тепе – теңдік.
- •Химиялық тепе-теңдік .
- •Ертінділердің қасиеттері. Электролиттің ертінділері. Электролиттік диссоциацияның теориясы. Сутегілік көрсеткіш.
- •Ерітінді концентрациясы және оны өрнектеу әдістері
- •Электролит еместердің ертіндісі. Освальд қосу заңы.
- •Тотығу-тотықсыздану үдерістері. Маңызды тотықтырғыштар мен тотықсыздандырғыштар
- •Электрохимия. Галваникалық элементтер. Электролиз.
- •Металдардың, қорытпалардың, балқымалардың, бетондардың тоттануы (коррозиясы) және тоттанудан қорғану әдістері
- •Металл құрылымы және оның коррозиялық процеске әсері
- •Бейэлектролиттердегі металл коррозиясы
- •Металдар химиясы мен олардың қосылыстары
- •Оксотұздардың термиялық тұрақтылығы (тт)
- •Металдар еместердің химиясы және олардың қосылыстары
Металдар еместердің химиясы және олардың қосылыстары
1.Көмірсутектер
2.Азот қосылыстары
3. Қышқылдар
4. Тұздар
5. Галогендер
6. Оксидтер
Метал еместер қосылыстардың негізгі компоненттері – көміртегі, сутегі, оттегі және азот және басқа да химиялық элементтер атомдары. Сондай-ақ қышқылдар, оксидтер, галогендер, көмірсутектер, оттекті органикалық қосылыстар, азотты органикалық қосылыстар.
1. Көмірсутектер – молекуласында тек қана көміртегі және сутегі атомдары ғана болатын қосылыстар. Олар өз кезегінде:
1) Қаныққан көмірсутектер:
а) ациклды (тармақталмаған және тармақталған тізбекті);
ә) циклды.
2) Қанықпаған көмірсутектер:
а) қос байланысты (ациклды, циклды);
ә) үш байланысты (ациклды, циклды);
б) ароматты.
2. Оттекті органикалық қосылыстар – молекуласында көміртегі, сутегімен қатар оттегі болатын органикалық қосылыстар.
1) Біртекті функциялы қосылыстар:
а) молекуласында гидроксил -ОН тобы бар (спирттер, фенолдар);
ә) молекуласында – С = О карбонил тобы (альдегидтер, кетондар);
ﺍ
б) молекуласында – С– ОН карбоксил тобы бар (карбон қышқылдары).
ﺍﺍ
О
2) Ангидридті қосылыстар – бастапқы қосылыстың екі молекуласынан су молекуласын алып тастау арқылы алынатын оттекті органикалық қосылыстардың туындылары. Оларға:
а) Жай эфирлер – спирттің екі молекуласынан алынатын ангидрид, жалпы
формуласы: R – O – R.
ә) Күрделі эфирлер – спирт молекуласы мен қышқыл молекуласынан алынатын
ангидрид, жалпы формуласы: R – COOR1.
б) Қышқылдың екі молекуласынан түзілген ангидрид: R – COO – CO – R1.
Бұл қосылыстардың барлығы өз кезегінде функционалдық топтар байланысқан радикалға байланысты жіктеледі.
3) Аралас функционалдық топты қосылыстар – молекуласында екі немесе одан да көп функционалдық топтары бар оттекті органикалық қосылыстар. Олардың негізгі кластарына:
а) оксиқышқылдар немесе спиртоқышқылдар – молекуласында бір мезгілде
гидроксил және карбоксил топтары бар органикалық қосылыстар:
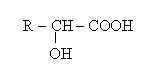
ә) альдегидоқышқылдар немесе альдоқышқылдар – молекуласында альдегид және
карбоксил топтары бар органикалық қосылыстар
б) кетоноқышқылдар немесе кетоқышқылдар – молекуласында кето және карбоксил топтары бар органикалық қосылыстар:
O
ﺍﺍ
R – С – R – COOH
в) альдозалар және кетозалар – молекулаларында бір мезгілде альдегид немесе кето топ және бірнеше гидроксил топтары бар көмірсулар. Мысалы:
3. Азотты органикалық қосылыстар – молекуласында көміртегі, сутегі, оттегімен қатар азот атомы бар органикалық қосылыстар.
1) Аминоқосылыстар – құрамында амино – NН2 тобы бар азотты органикалық қосылыстар. Олардың негізгілері:
а) аминдер – аммиак молекуласындағы бір, екі немесе барлық үш сутек атомдары
органикалық радикалдарына алмасқан қосылыстар: СН3 – NН2, (СН3)2 – NН,
(СН3)3 – N ;
ә) аминоқышқылдар – карбон қышқылында көмірсутек радикалындағы бір сутек
атомы амино топқа алмасқан қосылыстар;
б) аминоспирттер – спирттің көмірсутек радикалындағы бір сутек атомы амино топқа
алмасқан қосылыстар H2N – R – OH;
в) амид қышқылдар – карбоксилдегі гидроксил тобы амино топқа алмасқан
қосылыстар R – CONН2.
2) Нитроқосылыстар – молекуласында органикалық радикалдармен байланысқан нитро – NО2 топтары бар қосылыстар.
3) Нитрозоқосылыстар – молекуласында органикалық радикалдармен байланысқан нитрозо – NО топтары бар қосылыстар.
4) Нитрилдер – молекуласында органикалық радикалдармен байланысқан циан – С ≡ N топтары бар қосылыстар.
Элементорганикалық қосылыстарға: фосфорорганикалық, құрамында күкірті бар, галогентуынды органикалық, кремнийорганикалық, металлорганикалық және т.б. қосылыстар жатады.
Бұл оқу құралында бірінші принцип жіктелуіндегі ациклды (алифатты) қосылыстарды қарастырады.
Қышқылдар
Қышқылдар - металл емес оксидтердің гидраты, сутегі атомы және қышқыл қалдығынан тұратын химиялық қосылыстар.
Қышқылдар құрамында оттектің болу-болмауына қарай оттексіз және оттекті қышқылдар болып бөлінеді, оттексіз қышқылдар құрамында оттегі болмайды. Оларға НҒ, НCL, НBr, НJ, H2S, H2Sе т.б. жатады. Оттексіз қышқылдардың аттары олардың сутекті қосылыстарының аттарына қышқыл деген сөз қосылып айтылады, мысалы: НCL-хлор сутек, ал оның судағы ертіндісі-хлор-сутек, Күкіртсутек- H2S, ал оның судағы ертіндісі күкіртсутек қышқылы деп аталады.
Құрамында оттек атомдары бар қышқылдарды оттекті қышқылдар дейді. Мысалы: НNО3, H2SO4, Н3РО4, Н3СО3, т.б.
Егер қышқылдар құрамындағы орталық атомның тотығуы дәрежесі периодтық жүйедегі, өзі тұрғын топтық номіріне тең болса, онда қышқыл атын атау үшін әлементтің атына "қышқылы" деген сөзді қосып атайды.
Мысалы: НNО3-азот қышқылы, H2SO4,-күкірт қышқылы, HMnO4 –марганец қышқылы.
Егер қышқылдың құрамындағы орталық атомның тотығу дәрежесі перриодтық жүйедегі өзі тұрған топ номерінен кем болса, онда қышқыл атын атау үшін элемент атына "ті", "ты" жұрнақтарына жалғап "қышқыл" деген сөзді қосып айтады. Мысалы: H2SO4,-күкірт қышқылы, НNО2-азотты қышқылы, H2MnO4- марганецті қышқыл.
Галогендер бірнеше оттекті қышқыл түзетіндіктен ол қышқылдар аттары орталық атомның атына тиісті жалғаулар жалғау арқылы айтылады. Мысалы: НCLО4-хлор қышқылы, НCLО3-хлордау қышқылы,
НCLО2-хлорлы қышқыл, НCLО-хлорлылау қышқылы.
Тотығу дәрежесі бірдей бір элемент қышқылдарын бір-бірінен ажырату үшін кейде орта –мета-пиро-деген сөздерді элементтің атына қосып айтады. Мысалы: Н3РО4-ортофосфор қышқылы. НРО3-мета фосфор қышқылы, Н4Р2О7-пирофосфор қышқылы.
Оттекті қышқылдарда кездесетін аниондардың аттары:
CLО-гипохлорит Р2О7-дисфосфор BО3-ортоборат
CLО2-хлорит АsО3-арсенит SiО3-силикат
CLО3-хлорат АsО4-арсенат СrО4-хромат
CLО4-перхлорат НSО3-гидросульфит MnO4-манганат
BrО-гипобромит NО3-нитрат MnO4-перманганат
BrО3-бромат SО3-сульфат SО4-сульфат
СО3-карбанат IО3-иодат Сr2О7-дихромат
РО3-метафосфор NО2-нитрит B4О7-тетраборат
РО4-ортофосфор BО2-метаборат НСО3-гидрокарбонат
НРО4-гидрофосфат Н2Р2О7-дигидродифосфат
НSО4-гидросульфат Н2РО-дигидрофосфать
Құрамындағы металға алмаса алатын сутек санына қарай қышқылдар:
Бірнегізді: НCL, НBr, НҒ, НJ, НNО3, НCLО4, СН3СООН.
Екінегізді: H2SO4, H2 SО3, H2S, НСО3, Н2 SiО3, Н2 СrО4,.
Үшнегізді: Н3РО4, Н3ВО3, Н3АsО3, Н3АsО4. болып бөлінеді.
Алынуы: а) оттексіз қышқылдарды сутегі металл еместермен тікелей әрекеттесу арқылы, түзілген затты суда ерітеді:
Н2+CL2=2НCI
Н2+S= H2S
б) қышқылдық оксидтердің сумен әрекеттесуі арқылы:
СО2+ H2O=Н2СO3
SО3+ H2O=Н2SO4
в) төздармен қышқылдардың алмасу реакциясы арқылы:
Na2 SiO3+2НCI=Н2SiO3+2 Na СL
Химиялық қасиеттер
1.Кернеу қатарында сутегіне дейін орналасқан металдар қышқылдан сутегін ығыстырады:
Zn+2НCL=ZnCI2+ H2
2.Қышқылдар гидроксидтермен әрекеттеседі (нейтралдау реакциясы)
Н2SO4+2NaOH= Na2SO4+ 2H2O
3.Қышқылдар негіздік оксидтермен әрекеттеседі:
СаО +Н2SO4= СaSO4+ H2O
4.Қышқылдар тұздармен алмасу реакциясына түседі:
Н2SO4+Ва (NО3)2= ВaSO4+ H2O
5.Оттекті қышқылдар қыздырғанда оксидке және суға ыдырайды:
Н2SiO3=SiO2+ H2O
Тұздар
Тұздар-қышқылдардағы сутегінің металға толық және жартылай алмасу өнімі.
Тұздар аттары
Оттекті тұздардың халықаралық аттары металл аттарынан және латын тіліндегі металл емес аттарына-ат, ит, деген жалғаулар жалғанып айтылады. Мысалы:
КCIО-калий гипохлориті LiBrO-литий гипобромиті
КCIО2-калий хлориті MgCLO4-магний хлораты
КCIО4-калий перхлориты KМnO4-калий перманганаты
Са(NО2)2-кальций нитриті LiBrO3-литий бромиті
Са(NО3)2-кальций нитраты ALAsO3-алюминий арсениті
Са SO3-кальций сульфиты ALAsO4-алюминий арсенаты
Са SO4-кальций сульфаты KBO2-калий метабораты
KBO3-калий бораты Na2CO3-натрий карбанаты
KРO3-калий метафосфаты ALРО4-алюминий фосфаты
K2МnO4-калий манганаты
Ал оттексіз қышқыл тұздарының аты металл аты мен металл емес атына″иді″ деген жұрнақ қосу арқылы аталады. Мысалы:
NaBr-натрий бромиді NaJ-натрий иодиді
NaCL-натрий хлориді NaҒ-натрий фториді
Na2S-натрий сульфаты
Егер металдың тотығу дәрежесі айнымалы болса, онда оның валенттілігі метал атынан кейін рим сандарынан көрсетіледі, мысалы:
FeSO4-темір (ΙΙ) сульфаты
Fe2(SO4)3-ntvih (ΙΙΙ) секmafns
Қышқыл тұздар қышқылдардың сутегі иондар металдарға толық алмаспауынан шыққан заттар. Сондықтан олардың құрамында металл болады. Қышқыл тұздарды көп негізді қышқылдар (Н2СО, Н2SO4, Н3РО4, Н2SiO3, Н2S т.б.) түзеді.
Қышқыл тұздардың халықаралық аттары сәйкес орта тұздардағы металл еместің латын тіліндегі аты алдына ″гидро″ деген сөзді қосып айтудан шығады. Егер тұздың құрамында бір сутегінің ионы болса ″гидро″ екі сутегі ионы болса ″дигидро″ деген сөздер қосылып айтылады. Мысалы:
NaH2PO4-натрий дигидрофосфаты
Na2HPO4-натрий гидрофосфаты
Негіздік тұздар көп қышқылды негіздің (Cu(OH)2, Fe(OH)2, Fe(OH)3, AL(OH)3 т.б.) гидроксид тобы қышқыл қалдықтарымен толық алмаспауынан түзіледі. Сондықтан олардың құрамында металл катиондары мен қышқыл қалдықтары аниондарынан басқа гидроксид иондар болады.
Негіздік тұздардың халықаралық аттары сәйкес оттекті тұздардағы металл еместің латын тіліндегі атының алдында ″гидроксо″ деген сөз қосыоып айтылады. Егер негіздік тұздар құрамында бір гидроксид-ион болса ″гидроксо″ , ал екі гидроксид ион болса ″дигидроксо″ деген сөздер қосылып айтылады. Мысалы: ALOHCL2 –алюминий гидроксохлориді AL(OH)2CL-магний дигидроксохлориді, MgOHCL- магний гидрокхлориды.
KAL(SO)4 –калий –алюминий сульфаты
KNaCO3-калий –натрий карбанаты
KNaC4H4O6-калий-натрий тартраты
Алынуы: 1. Металл және металл еместердің әрекеттесуі:
2Na+ CL2=2 NaСL
Ғе+S=FeS
2. Металдар қышқылдармен әрекеттесуі:
Zn+2HCL=ZnCL2+H2
3. Негіздік оксидтері қышқылдық оксидпен әрекеттесуі:
СаО+СO2=СаСО3
СаО+ SiO2=СаSiO3
4. Негіздік оксидтердің қышқылдармен әрекеттесуі:
СаО+2HNO3=Ca(NO3)2+H2O
5. Гидроксидтердің қышқылдық оксидтермен әрееттесуі
Са(ОН)2+СO2=СаСО3+H2O
6. Гидроксидтердің қышқылдармен әрекеттесуі
2NaOH+Н2SO= Na2SO4+H2O
7. Металдардың тұздармен әрекеттесуі
Zn+ CuSO4=Cu+ZnSO4
8. Қышқылдардың тұздармен әрекеттесуі
HCL+AgNO3=AgCL+HNO3
9. Амфотерлі гидроксидтер сілтімен әрееттесуі
Zn(ОН)2+ Са(ОН)2=СаZnO2+2H2O
10. Амфотерлі гидроксидтер қышқылдармен әрекеттесуі
Zn(ОН)2+2HCL=ZnCL2+H2О
Химиялық қасиеттер
1.Металдардың кернеу қатарындағы әрбір металл, өзінен кейінгң тұрған металдары тұздарынан ығыстырып шығарады:
Zn+ CuCL2=ZnCL2+ Cu
2.Тұздар сілтілермен әрекеттеседі:
AL(NO3)3+3KOH=AL(OH)3+3KNO3
3. Тұздар қышқылдармен әрекеттеседі:
AgNO3+HCL=AgCL+HNO3
4. Көпшілік тұздар бірімен-бірі әрекеттеседі:
CaCL2+Na2CO3=CaCO3+2NaCL
Бейорганикалық қосылыстар кластары арасындағы генетикалық байланыс
Жай заттар, оксидтер, гидроксидтер, қышқылдар және тұздар арасында генетикалық байланыс болады. Мысалы жай зат-калий металы ауадан оттекті қосып алып оксидке айналады, сумен қосылып гидроксид береді, соңғысы қышқылымен қосылып тұз түзеді.Бұл өзгерісті мынадай схемамен көрсетуге болады.
KО→K2O→KOH→K2CO3
Мұндай өзгерістерді металл еместерге де келтіруге болады. Мысалы: көміртегіне C→CO2→H2CO3→K2CO3. Сонымен, бірдей тұз әртүрлі әдістермен алынған.
Керісінше жүруі мүмкін, тұздан жай заттарға көшу. Мысалы: мыс сульфатына сілтімен әсер ету арқылы мыс (II) гидроксидіне көшуге болады, одан соң оны қыздыру арқылы мыс (II) оксидіне, одан сутегімен тотықсыздандару арқылы жай зат-мыс алуға болады.
CuSO4→Cu(OH)2→CuO→Cu.
Бейорганикалық қосылыстардың кластары арасындағы байланысты генетикалық байланыс деп атайды. Оны мына схемамен көрсетуге болады.
М етал→негіздік
оксид→гидроксид
етал→негіздік
оксид→гидроксид
 Тұз
Тұз
Металл емес → қышқылдық оксид→ қышқыл
Оксидтер дегеніміз-екі элемент атомдарынан тұратын, оның біреуі оттегі болатын күрделі заттар.
Оксидтер үш топқа бөлінеді. Негіздік (типтік металдардың) оксидтері.Na2O-натрий оксиді, К2О-калий оксиді, ВаО-барий оксиді. Қышқылдық (металлеместердің) оксидтері-
N2O5- азот (V) оксиді; P2O5- фосфор (V) оксиді;
CO2- көміртегі (IV) оксиді; SO2- күкірт (IV) оксиді;
SO2- күкірт(IV) оксиді; SiO2- кремний (IV) оксиді;
Амфотерлі оксидтер-негіздік және қышқылдық оксидтердің қасиеттерін көрсетеді ZnO-мырыш оксиді, SnO-қалай оксиді, AL2O3-алюминий оксиді, Cr2O3-хром (ІІІ) оксиді.
Негіздік оксидтер
Алынуы. а) металдардың оттегімен тікелей әркеттесуі арқылы:
2Мg+O2=2MgO
Ca(OH)2=CaO+H2O
б) Гидроксидтерді ыдырату арқылы:
2NaOH= Na2O+H2O
Ca(OH)2=CaO+H2O
в) Тұздарды ыдырату арқылы:
CaCO3=CaO+Ca2
Химиялық қасиеттері
1.Активті металдардың оксидтері сумен тікелей әрекеттесіп гтдроксидтер түзеді:
Na2O+H2O=2NaOH
CaO+H2O= Ca(OH)2
2. Көшпелік негіздік оксидтер (CuO MnO FeO т.б.) сумен тікелей әрекеттеспейді. Сәйкес келетін гидроксидтерді (Cu(OH)2, Mn(OH)2, Fe(OH)3 т.б.) суда ерімейді, сондықтан оларды жанама жолдармен алады. Мысалы:
CuCI2+2NaOH=Cu(OH)2+2NaCI
FeCI3+3KOH=Fe(OH)3+3KCL
3. Барлық негіздік оксидтер қышқылдармен әрекеттесіп тұз және су түзеді:
CuO+H2SO4=CuSO4+H2O
CaO+2HCI+CaCI2+H2O
MgO+2HNO3=Mg(NO3)2+H2O
2BaO+2H3PO4=Ba3(PO4)2+3H2O
Кейбір негіздік оксидтер қышқылдық оксидтермен әрекеттесіп тұздар түзеді:
CaO+CO=CaCO3
3CaO+P2O5=Ca3(PO4)2
K2O+CO2=K2CO3
Қышқылдық оксидтер
Алыну: а) металл емес элементтердің оттегімен тікелей әрекеттесуінен түзіледі:
С+СО2 =СО2
4Р+5О2=2Р2О5
б) қышқылдарды ыдырату арқылы:
H2SO4= H2O+SO3
H2 CO3= H2O+ СО2
В) тұздарды ыдырату арқылы:
CaCO3= CaO+СО2
K2 SO4= K2О= SO3
Химиялық қасиеттері
1.Кейбір қышқылдық оксидтер сумен әрекеттесіп қышқылдар түзеді:
СО2+ H2O= H2 CO3
SO3+H2O= H2SO4
3 H2O= P2O5=2Н3РО4
2.Қышқылдық оксидтер гидроксидтермен әрекеттесіп, тұз және су түзеді:
СО2+Ва(ОН)2=ВаСО3+ H2O
SiO2+2 NaOH=Na2 SiO3+ H2O
3.Барлық қышқылдық оксидтер негіздік оксидтермен әрекеттесіп тұз түзеді:
N2О5+К2О=2КNО3
СаО+ SO3=Ca SO4
Бақылау сұрақтары
1.Көмірсутектер
2.Азот қосылыстары
3. Қышқылдар
4. Тұздар
5. Галогендер
6. Оксидтер
7. Фосфор қосылыстары
Негізгі және қосымша әдебиет
Негізгі әдебиет
1. Ахметов Н.С. «Жалпы және бейорганикалық химия». Баспа «Жоғары мектеп». М. 2005 г.
2. Глинка Н.Л. «Жалпы химия» - И. Интеграл-пресс. 2003.
3. Некрасов Б.В. «Жалпы химияның негіздері» т.1,2,3. Химия –М 1976 г.
4. Н.Н. Нурахметов, М.Б. Муратбеков, Ә.К. Тәшенов «Бейметалдар химиясы», Алматы, «Қазақуниверситеті», 2009 ж.
5. Н.Н. Нурахметов, Ә.К. Тәшенов «Бейметалдар химиясы», Алматы 2011 ж.
Бiрiмжанов Б., Нұрақметов Н. Жалпы химия. Алматы. Ана тiлi. 1992.
Ақанбаев Қ. Химия негiздерi. Алматы.: Мектеп. 1987.
Бегалиева Ж., Самыратов С., Қолұшпаева А. Химия курсы. Алматы.: ҚазКҚА. 2002, 292 б.
