
- •Измерение энергетических характеристик электролизёра воды с твёрдополимерным электролитом
- •Цель работы
- •Процесс электролиза
- •Характеристики электролизёра.
- •Описание лабораторной установки
- •1.5. Методика проведения эксперимента
- •Форма записи первичных результатов эксперимента
- •Обработка результатов измерений
- •1.7. Содержание отчёта
- •Правила техники безопасности при выполнении работы
- •Рекомендуемая литература
Лабораторная работа 1.
Измерение энергетических характеристик электролизёра воды с твёрдополимерным электролитом
Цель работы
- ознакомление с устройством и принципом действия электролизёра воды с твёрдополимерным электролитом;
- определение выхода по энергии;
- определение выхода по току;
- определение производительности и КПД электролизёра.
Процесс электролиза
В общем случае электролиз воды можно описать уравнением
Н2О → Н2 + 0,5 О2 (1.1)
Выделение водорода происходит на катоде, а кислорода – на аноде электролизера.
Широкое распространение в настоящее время получили электролизеры на основе твердополимерного электролита (ТПЭ). ТПЭ представляет собой мембрану из перфторполимера (марки Нафион, либо МФ-4СК отечественная), обладающую ионной проводимостью. Проводимость мембраны обусловлена наличием вшитых в полимер сульфогрупп (-SO3H) с подвижным атомом водорода, что и придает мембране ионогенные свойства. По ряду свойств такая мембрана близка к фторопласту, но в то же время при набухании в воде она становится эквивалентной (10 ÷ 12) %-му раствору серной кислоты.
По обе стороны мембраны наносится слой электрокатализатора. Используются электрокатализаторы на основе металлов Pt группы.
На аноде: Ir (или его оксид), RuxIrySn1-x-yO2 и RuxTiySn1-x-yO2 с расходом катализатора 2,0 мг/см2;
На катоде: Pt или Pd, в том числе на углеродном носителе.
При достижении потенциала разложения вода диссоциирует на водород и кислород (рис. 1.1).
На аноде электролизера с ТПЭ происходит выделение кислорода, который поступает в анодное пространство:
H2O ® 1/2O2 + 2ē + 2H+ (Ео = 1,229 В при 25оС)
Ионы водорода переносятся через ионообменную мембрану (ТПЭ) и на катоде происходит выделение водорода по реакции:
2H+ + 2ē ® H2 (Ео = 0 В при 25оС)
Суммарная реакция: H2O ® H2 + 1/2O2 (Ео = 1,229 В при 25оС)

Рис. 1.1. Схематическое изображение принципа работы электролизера на ТПЭ:
К – катод, А - анод
Напряжение разложения воды Е0 равно разности потенциалов анода ЕА и катода ЕК, то есть Е0 = ЕА – ЕК. Эта разность равна ЭДС водородно-кислородного гальванического элемента.
Изменение стандартного изобарно-изотермического потенциала ΔG0 в токообразующей реакции записывается как:
ΔG0 = - n.F.E0, (1.2)
где n - число эквивалентов вещества, участвующих в реакции; F – постоянная Фарадея.
Токообразующей реакцией в водородно-кислородном гальваническом элементе является реакция, обратная реакции (1.1), для которой ΔG0 = -237,00 кДж/моль. Учитывая, что F = 96484,56 Кл/моль, из уравнения (1.2) получим:
Е0 = - ΔG0/ n.F = 237000/2.96484,56 = 1,228 В (1.3)
При протекании процесса электролиза в изотермических условиях (при Т = 298 К), когда отсутствует теплообмен с окружающей средой и ΔG0 = ΔН0, по аналогии с уравнением (1.3) получим:
Е = - ΔН0/ n.F = 286260/2. 96484,56 = 1,483 В, (1.4)
где Е = 1,483 В – напряжение (или потенциал) разложения воды в изотермических условиях или, так называемый термонейтральный потенциал.
С другой стороны, рассмотрение электролизной ячейки как системы с газовыми электродами приводит к представлению обратимого потенциала в виде:
E = E0 +(RT/2F)ln(Po1/2 PH/Kэл) (1.5)
где: PH и Po парциальные давления водорода и кислорода, Kэл – активность электролита
При напряжении на электролизной ячейке, равной Е, скорость процесса получения водорода равна нулю. Для проведения процесса электролиза при отличной от нуля скорости выделения водорода требуется соответствующее смещение потенциалов электродов от равновесия, что достигается увеличением напряжения на ячейке. Напряжение необходимо увеличить на перенапряжение катодной - выделение водорода (ηк) и анодной - выделение кислорода (ηа) реакций. Кроме того, в системе возникают омические (IR) потери, связанные с сопротивлением электролита и электронных проводников при прохождении тока. В связи с этим напряжение на ячейке электролизера (U) отличается от равновесного значения (Е):
U = Е + ηк +ηа + IR. (1.6)
Значения ηк и ηа в первом приближении связаны с плотностью тока уравнением Тафеля:
η = a + b·ln i, (1.7)
где
![]() и
и
![]() ,
- коэффициент переноса, приблизительно
равный 0,5.
,
- коэффициент переноса, приблизительно
равный 0,5.
Т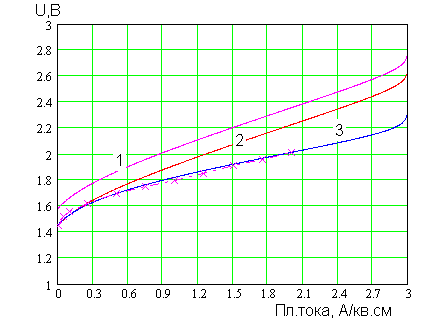 аким
образом, U
= Е + IR
+ (a
+ b·ln
i),
то
есть отличие U
от Е растет с плотностью тока (рис. 1.2).
аким
образом, U
= Е + IR
+ (a
+ b·ln
i),
то
есть отличие U
от Е растет с плотностью тока (рис. 1.2).
Рис.1.2. Вольт-амперные характеристики электролизёра: 1 – давление водорода - ;
