
- •Тема 28. Технические процессы разделения воздуха (резерв)
- •Тема 29. Разделение воздуха методом низкотемпературной
- •29.1. Однократная ректификация
- •29.2. Двукратная ректификация
- •Тема 30. Схемы и конструкции кислородных установок
- •30.1. Установки высокого давления
- •30.2. Установки среднего давления
- •30.3. Установки низкого давления
Тема 28. Технические процессы разделения воздуха (резерв)
Воздух – это , в основном, смесь азота, кислорода и аргона. Поместив эти газы в чистом виде в количествах, соответствующих содержанию их в воздухе, в общий сосуд, получим смесь, аналогичную по составу атмосферному воздуху, причем смешение газов произойдет само собой, без затраты внешней энергии.
Разделение же смеси на составные части самопроизвольно не произойдет, а требует расхода энергии.
Следовательно, процесс смешения газов является необратимым – он может протекать самопроизвольно только в одном направлении.
Если жидкость состоит только из одного вещества, то и пары над нею будут содержать только это вещество, например, пары воды над водой, пары спирта над спиртом.
А если жидкость состоит из двух или более веществ с различной температурой кипения, способных растворяться одно в другом?
В этом случае в паре содержатся те же вещества, что и в жидкости, однако его состав отличается от состава жидкости. Например, в смеси воды и спирта последний более летуч и кипит при более низкой температуре, чем вода. Поэтому при нагревании смеси спирт быстрее испаряется, и в паре над жидкостью спирта будет содержаться больше, чем в жидкости.
При заданных давлении и температуре и установившемся тепловом равновесии между жидкостью и паром состав пара над жидкостью является совершенно определенным и зависит только от состава жидкости. В этом случае говорят, что пар и жидкость находятся в равновесном состоянии. Нарушение этого равновесия вызывает соответствующие изменения состава жидкой и паровой фаз.
Аналогично происходит при разделении жидкого воздуха на азот и кислород. В процессе нагревания без отвода паров жидкого воздуха из него в первую очередь испаряется азот, имеющий более низкую температуру кипения (-1960С, 77,36 К при Р2=0,101 МПа).
Наряду с азотом, но в меньшей степени, из жидкого воздуха будет испаряться кислород (температура кипения –1830С, 90,19 К при Р2=0,101 МПа). Поэтому в жидкости всегда содержится больше кислорода, чем в паре, а в паре больше азота, чем в жидкости. Такой переход азота в пар происходит до тех пор, пока не будет достигнуто равновесное состояние между жидкостью и паром, соответствующее их температуре и давлению.
Рассмотрим процессы испарения и конденсации бинарной смеси двух веществ А и В на диаграмме в координатах «концентрация – температура» (рис.28.1.).
По оси абсцисс вправо отложены доли А вещества А в смеси, влево соответственно доли В вещества В. По оси ординат отложены значения температуры.
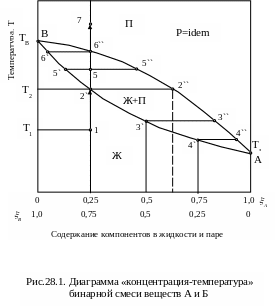
Точка А на правой ординате соответствует температуре кипения ТА чистого вещества А (А=1,0).
Точка В на левой ординате соответствует температуре кипения ТВ чистого вещества В (В=1,0).
Легкокипящим веществом является А, так как ТАТВ.
Нижняя кривая относится к жидкости, верхняя – к пару.
Предположим, что имеется некоторое количество жидкой смеси концентрации А=0,25 или, что то же самое, В=0,75 с температурой Т1. Это состояние жидкости на диаграмме обозначено точкой 1. Если к жидкости подводить тепло, то ее температура начнет возрастать и точка, отображающая состояние раствора, будет перемещаться по прямой 1-2`.
В точке 2` начнется кипение жидкости при температуре Т2. Пар с той же температурой Т2, что и жидкость, отличается от нее по составу, т.к. содержит большее количество легкокипящего вещества А (точка 2``).
Аналогично будет проходить процесс кипения для жидкости любого другого состава, например, в точках 3` и 4`.
Соединив точки В-2`-3`-4`-А, получим так называемую линию кипения. Соединив точки В-2``-3``-4``-А, получим линию конденсации.
Площадь, заключенную между линиями кипения и конденсации, называют областью влажного пара.
При выпаривании жидкости, начавшемся в точке 2`, количество пара будет постепенно увеличиваться, а жидкости соответственно уменьшаться. Т.к. в пар переходит большее количество легкокипящего вещества А, то жидкость будет постепенно обогащаться тяжелокипящим веществом В и температура ее кипения постепенно возрастет.
В точке 5, например, раствор будет представлять собой систему, находящуюся при температуре Т5Т2 и состоящую из кипящей жидкости состава 5` и равновесного ей пара состава 5``.
Количество жидкости и пара будет относиться соответственно как отрезки 5-5`` и 5-5` (правило отрезков).
При дальнейшем парообразовании количество жидкости будет уменьшаться, а пара увеличиваться. При этом температура повышается и содержание тяжелокипящего компонента В как в паре, так и в жидкости возрастает.
Наконец, в точке 6`` испарится последняя порция жидкости, состав которой к этому времени будет характеризоваться величиной 6`. Она перейдет в пар того же состава, что и исходная жидкость.
Последующий нагрев пара уже не вызывает изменение его состава, т.к. он представляет собой обычную газовую смесь той же концентрации, что и исходная жидкость (точка 7).
Процесс конденсации бинарной смеси происходит по тем же закономерностям, но в обратном порядке.
Можно осуществить испарение или конденсацию так, чтобы полученные продукты непрерывно отводились из сосуда, в котором они образуются. Такой процесс называется фракционированным испарением или конденсацией.
В процессе фракционированного испарения или конденсации воздуха можно получить два продукта, один из которых будет обогащен тяжелокипящим, а другой легкокипящим веществом.
Прежде чем перейти к рассмотрению процесса ректификации, отметим, что по мере увеличения давления, температуры кипения азота, кислорода и их смесей повышаются, а расстояние между кривыми кипения и конденсации уменьшается. Это означает, что разница в составах пара и жидкости тем меньше, чем выше давление. В области критических температур компонентов эта разница исчезает.
