
- •1. Характеристика предмета коллоидной химии
- •1.1 Признаки объектов коллоидной химии
- •1.2 Количественные характеристики дисперсных систем
- •1.3 Энергетическая и геометрические характеристики поверхности
- •1.4 Классификация дисперсных систем
- •1.5 Методы получения коллоидных систем
- •1.6. Правило фаз Гиббса для дисперсных систем
- •2. Поверхностное натяжение
- •2.1 Термодинамические параметры поверхностного слоя
- •2.2 Экспериментальные методы определения поверхностного натяжения.
- •2.3 Внутренняя полная поверхностная энергия.
- •2.4 Температурная зависимость σ и полной внутренней поверхностной энергии.
- •2.5 Механизм процессов самопроизвольного уменьшения σ. Принцип Гиббса-Кюри.
- •2.6 Внутреннее давление. Уравнение Лапласа
- •2.7 Влияние дисперсности на реакционную способность
- •2.8 Влияние дисперсности на растворимость вещества
- •2.9 Влияние дисперсности на равновесие химической реакции.
- •2.10 Влияние дисперсности на температуру фазовых переходов.
- •2.11 Уравнение капиллярной конденсации
- •3. Термодинамика образования новой фазы.
- •3.1 Кинетика образования новой фазы в системе “ж – т”.
- •3.2 Управление степенью дисперсности.
- •4. Двойной электрический слой. Механизм его образования.
- •4.1 Строение дэс
- •4.2 Примеры д.Э.С. И строение мицеллы
- •4.3 Термодинамика образования д.Э.С. Уравнение Габриэль-Липмана
- •5. Адсорбция. Зависимость от параметров системы
- •5.1 Типы адсорбции
- •5.2 Ионный обмен
- •5.3 Фундаментальные адсорбционные уравнения Гиббса
- •5.4 Адсорбция на границе ж-г
- •5.5 Уравнение Шишковского
- •5.6 Изотерма адсорбции Ленгмюра
- •5.7 Многокомпонентная адсорбция из газовой фазы.
- •5.8 Учет неэквивалентности адсорбционных центров
- •5.9. Капиллярные явления. Формула Жюрена
- •5.10 Адсорбция на пористых телах.
- •5.11 Адсорбция на микропористых телах.
- •5.12 Селективная адсорбция из растворов
- •6. Электрокинетические явления
- •6.1 Электроосмос
- •6.2 Электрофорез
- •7. Адгезия. Механизм процессов адгезии
- •7.1 Смачивание. Краевой угол
- •7.2 Связь работы адгезии с краевым углом
- •7.3 Эффект Марагони.
- •7.4 Правило Антонова
- •8. Флотация
- •9. Рассеяние света ультромикрогетерогенными частицами
- •10. Устойчивость дисперсных систем.
- •10.1 Седиментационная устойчивость дисперсных систем
- •10.2 Седиментационный анализ.
- •I метод.
- •10.3 Механические методы седиментации
- •10.4 Агрегативная устойчивость дисперсных систем
- •10.5 Кинетика коагуляции.
- •10.6 Коагуляция золей электролитами
- •10.7 Условие термодинамической устойчивости дисперсных систем
- •11. Эмульсии. Их стабилизация и разрушение.
- •12. Пены, стабилизация и разрушение.
- •13. Аэрозоли. Устойчивость и разрушение.
- •14. Суспензии. Обеспечение их устойчивости.
- •15. Гели
- •16. Экспериментальные методы изучения поверхностей.
10.5 Кинетика коагуляции.
Скорость коагуляции является основным фактором, по которому судят об агрегативной устойчивости, может изменяться в широких пределах.
Количественная теория была развита в трудах М. Смолуховского, Г. Мюллера, Н. Фукса. Наиболее разработанной и одной из первых была теория Смолуховского:
- для монодисперсных золей со сферическими частицами
- столкновение частиц – результат броуновского движения
- критическое расстояние при взаимодействии d=2r
- столкновение только 2 частиц (одинарная с одинарной, одинарная с двойной, двойная с тройной).
Такое представление позволило свести коагуляцию к теории бимолекулярной хим. реакции. В результате скорость коагуляции может быть найдена:
![]() ;
;
![]()
P – стерический фактор
![]() - суммарное число
r
- суммарное число
r
Д – коэффициент диффузии
После интегрирования
в пределах от
![]() при τ=0 до ντ
при τ:
при τ=0 до ντ
при τ:
![]()
к – определить трудно, поэтому Смолуховским было введено понятие времени половинной коагуляции – времени, в течении которого число частиц уменьшается в 2 раза ( ).
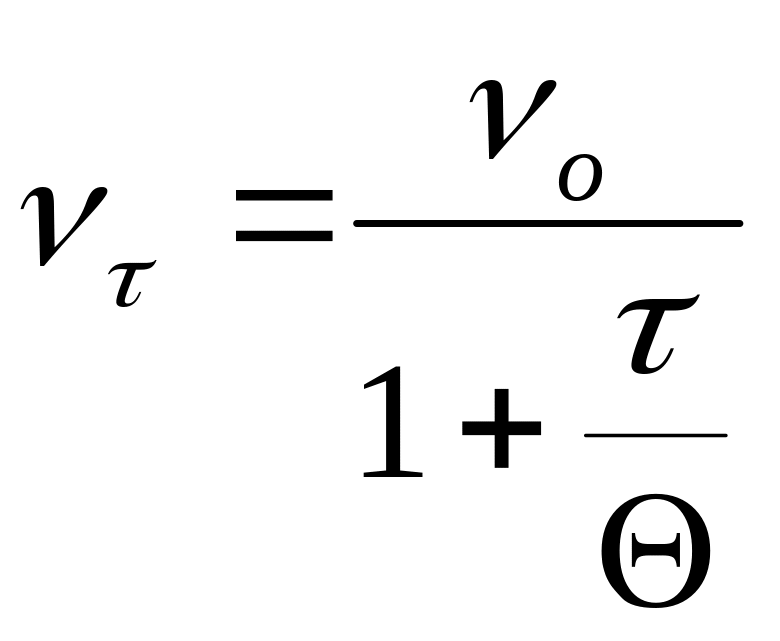
Приравняв эти уравнения, получим:
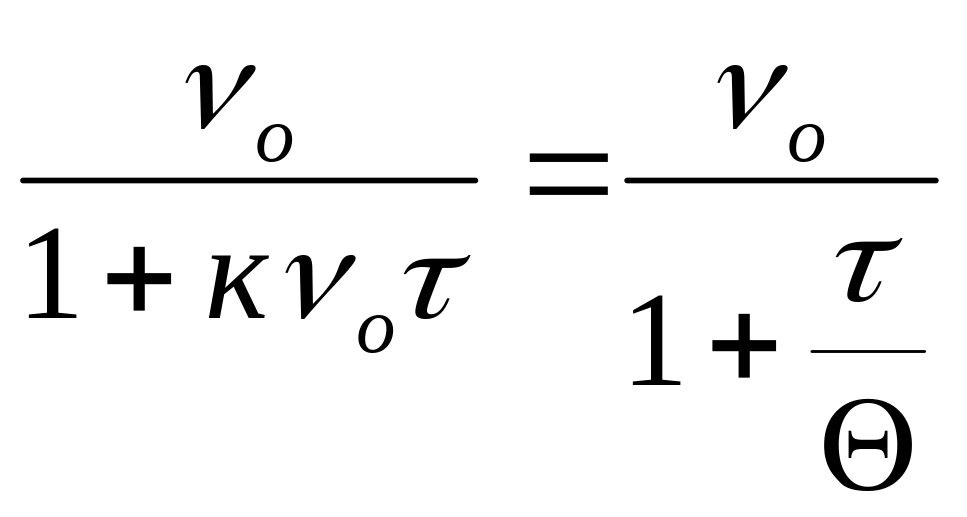 ,
,
![]() ;
;
Решение кинетических уравнений коагуляции можно проводить графически:
![]() ;
;
![]() .
.
Согласно теории
кинетики коагуляции, различают быструю
и медленную коагуляцию. При быстрой
коагуляции все столкновения частиц
заканчиваются их слипанием. Такому
положению отвечает условие:
![]() и Р=1. Тогда
и Р=1. Тогда
![]() ;
; ![]() ;
;
![]() ,
то
,
то
![]() ,
а
,
а ![]() ,
т.е.
,
т.е.
при быстрой
коагуляции К зависит только от η и Т.
Экспериментально доказано Зигмонди.
При медленной коагуляции
![]() ,
Р≠1 (необходимо учитывать эффективность
соударений). Фуксом был введен коэффициент
замедления.
,
Р≠1 (необходимо учитывать эффективность
соударений). Фуксом был введен коэффициент
замедления.
10.6 Коагуляция золей электролитами
Т.к. одним из
основных факторов устойчивости золей
(гидрофобных) является электростатический,
то введение в систему электролита может
привести к сжатию ДЭС и усилению
притяжения частиц. Наименьшая концентрация
электролита «см»
при которой начинается коагуляция
(медленная), называется порогом
коагуляции. Быстрая коагуляция начинается
при
![]() ,
когда скорость остается const.
См
– сильно зависит от метода его
определения, от концентрации золя и
т.д. Коагулирующее действие электролита
сильно зависит от Z
противоионов. По ДЛФО соотношение См
для зарядов
,
когда скорость остается const.
См
– сильно зависит от метода его
определения, от концентрации золя и
т.д. Коагулирующее действие электролита
сильно зависит от Z
противоионов. По ДЛФО соотношение См
для зарядов
![]() .
.
Экспериментально было установлено:
1.
![]() (порог коагуляции)
(порог коагуляции)
2. коагулирующей способностью обладают лишь те электролиты, знак заряда ионов которых противоположен заряду коллоидных частиц и тем сильнее, чем больше Z
3. для неорганических ионов одинаковой валентности коагулирующая активность увеличивается с уменьшением степени их гидратации.
Ряды Тофмейстера:
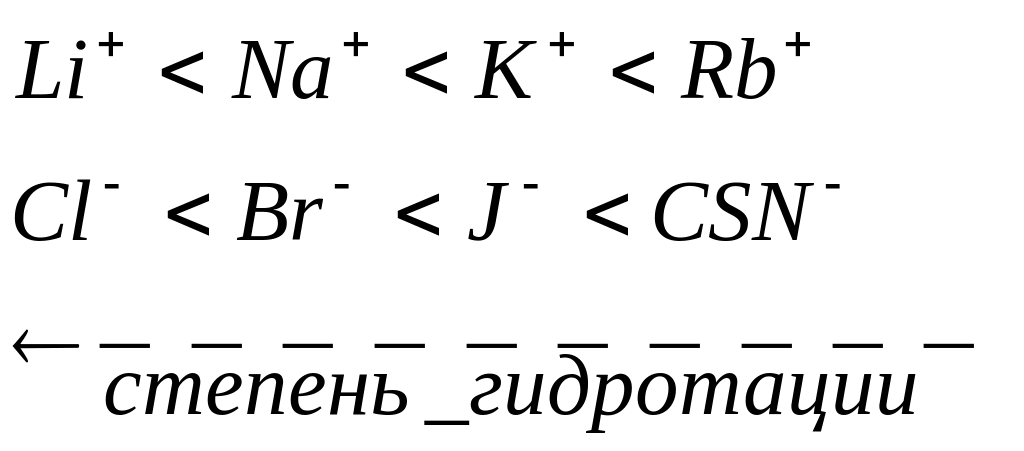
4. коагулирующее действие смеси электролитов часто бывает неаддитивным (либо хуже, либо значительно лучше)
5. более сильное влияние электролитов, вступающих в химическую реакцию с противоионами.
10.7 Условие термодинамической устойчивости дисперсных систем
т.к. равновесное состояние системы отвечает min G. Изменение энергии Гиббса при образовании таких систем должно быть <0, ∆G<0.
ультрамикрогетерогенность. Только в таких системах избыточная поверхностная энергия может компенсироваться составляющей в связи с возможностью теплового движения (броуновского) частиц. Максом Фольмером (нем.) это было доказано экспериментально
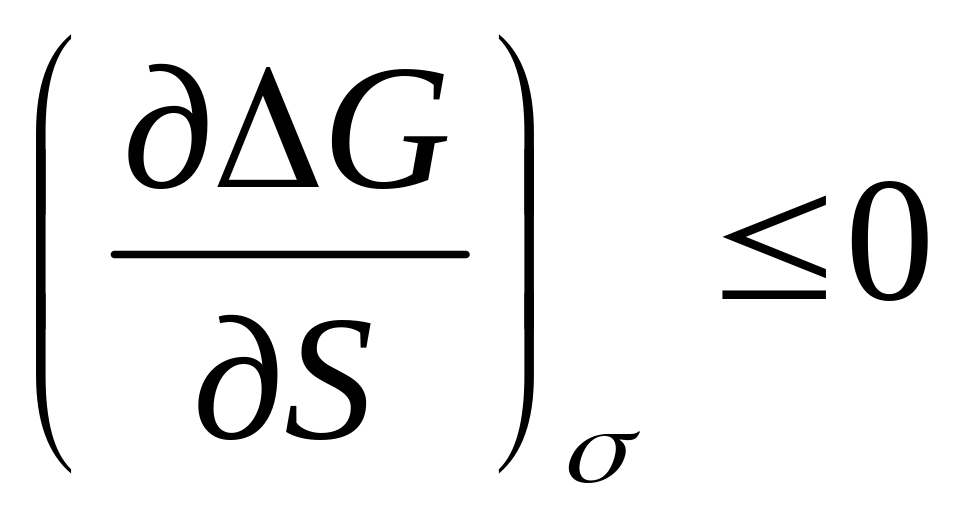 ;
;
 ,
т.е. энергия Гиббса не должна
увеличиваться с увеличением межфазной
поверхности или с уменьшением размера
частиц.
,
т.е. энергия Гиббса не должна
увеличиваться с увеличением межфазной
поверхности или с уменьшением размера
частиц.необходимость жидкой дисперсной среды, т.к. малое значение σ возможно только при значительном межфазном взаимодействии, что характерно для жидкой среды.
стремление системы к самодиспергированию, т.к. самопроизвольный рост межфазной поверхности может иметь место при компенсировании σ, при увеличении энтропии системы (что возможно в жидких средах из-за малых σ).
соответствие мах возможных значений σ уравнению Ребиндера-Щукина.
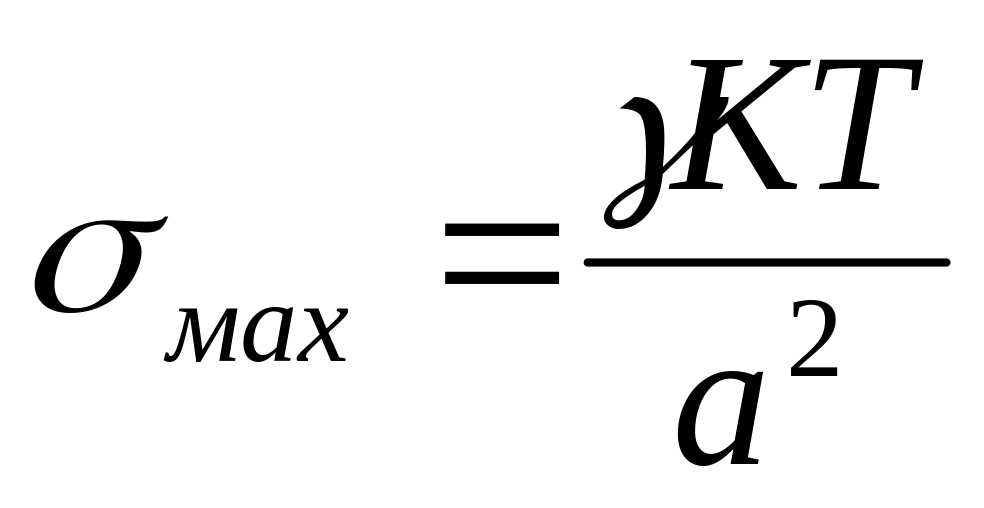 ,
К – коэффициент, а – средний размер
частиц.
,
К – коэффициент, а – средний размер
частиц.равенство скоростей двух противоположных процессов – коагуляции и пептизации
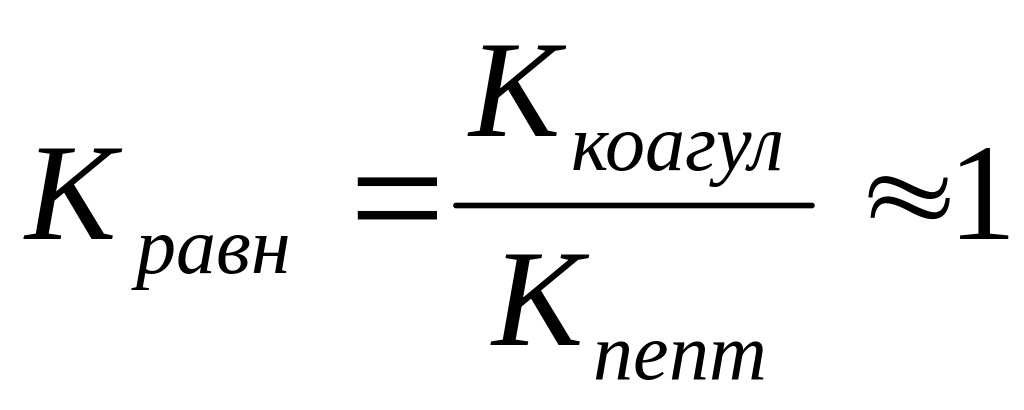 .
.
