
30.Считается,
что катализ протекает по двум основным
механизмам. В случае механизма
Ленгмюра-Хиншельвуда в р-ции участвуют
только адсорбиров. частицы, а скорость
р-ции пропорциональна заполнениям![]() пов-сти (долям пов-сти, занятым адсорбиров.
частицами). Для р-ции типа А + В -> продукты
скорость превращения выражается
соотношением:
пов-сти (долям пов-сти, занятым адсорбиров.
частицами). Для р-ции типа А + В -> продукты
скорость превращения выражается
соотношением:
![]()
где![]() и
и![]() -заполнения
пов-сти молекулами А и В соотв., определяемые
в случае однородной пов-сти и обратимой
адсорбции изотермой Ленгмгора (см.
Адсорбция
). При т. наз. ударном механизме
(механизме Ридила-Или) частица А из
газовой фазы сталкивается с адсорбированной
на пов-сти частицей В, образуя продукты
р-ции. В этом случае
-заполнения
пов-сти молекулами А и В соотв., определяемые
в случае однородной пов-сти и обратимой
адсорбции изотермой Ленгмгора (см.
Адсорбция
). При т. наз. ударном механизме
(механизме Ридила-Или) частица А из
газовой фазы сталкивается с адсорбированной
на пов-сти частицей В, образуя продукты
р-ции. В этом случае![]()
где РА-парциальное давление реагента А.
Однако установлено, что прочно адсорбиров. молекулы могут непосредственно взаимод. между собой, лишь если они занимают соседние активные центры (соседние атомы пов-сти катализатора), что в большинстве случаев маловероятно. Как правило, для Г. к. необходимо, чтобы одна из частиц (напр., А) перешла в состояние слабой адсорбции и продиффундировала ко второй частице (В). Элементарной стадией катализа при этом может оказаться именно поверхностная диффузия. Исследования методом молекулярных пучков показали, что ударный механизм Г. к. в чистом виде практически не наблюдается. При впуске молекул А на катализатор с адсорбированными на нем молекулами В (напр., при впуске Н2 на Pt, покрытую D2) продукт (HD) в отраженном пучке появляется не сразу, а спустя нек-рое время, необходимое для диффузии молекул А к активным центрам катализатора. Ур-ние (7) в этом случае соблюдается.
Каталитич.
р-ция - циклич. процесс, складывающийся
из ряда элементарных р-ций, скорости
к-рых описываются действующих
масс законом
. Этот
закон имеет простую форму для идеальных
газовых смесей, идеальных р-ров и
идеальных поверхностных слоев. Последним
термином обозначают модель (И. Ленгмюр,
1918), в к-рой пов-сть твердого тела
принимается состоящей из определенного
числа одинаковых мест (адсорбц. центров),
каждое из к-рых способно удержать в
адсорбир. состоянии одну частицу -
молекулу или атом; при этом частицы,
адсорбир. на соседних местах, не влияют
друг на друга. Если в элементарной р-ции
номер s
участвуют
в-ва А1
и А2
из объемной фазы (газовой или жидкой),
в-ва I1
и I2
из
поверхностного слоя, занимающие на
пов-сти доли
![]() и
и
![]() соотв.,
то скорость р-ции
соотв.,
то скорость р-ции
![]()
где
ks
-
константа скорости, [A1]
и [А2]
- концентрации А1
и А2;
a1,
а2,
i1,
i2
-
числа молекул в-в, участвующих в р-ции;
0-доля
своб. пов-сти (или, при р-ции в р-ре, доля
пов-сти, занятой р-рителем); z
- число
своб. мест пов-сти, к-рые требуются в
дополнение к (i1+i2)
местам, занятым молекулами I1
и I2,
для образования активир. комплекса,
т.е. переходного состояния (при гетерог.
р-ции активир. комплекс подобен адсорбир.
молекуле, однако может занимать на
пов-сти более одного места). Фактически
в р-ции не участвует более 3 частиц, так
что те или иные сомножители в (1) всегда
отсутствуют. Если отсутствуют
![]() ,
,
![]() и
0,
кинетич. ур-ние (1) определяет скорость
гомог. р-ции, если эти сомножители
присутствуют, - скорость гетерог. р-ции.
Ур-ние для rs,
содержащее только величины ,
иногда наз. законом действующих
поверхностей.
и
0,
кинетич. ур-ние (1) определяет скорость
гомог. р-ции, если эти сомножители
присутствуют, - скорость гетерог. р-ции.
Ур-ние для rs,
содержащее только величины ,
иногда наз. законом действующих
поверхностей.
8. Метод Гиббса. Статистический ансамбль и его элементы.
Создавая универсальную схему статистической механики, Гиббс использовал удивительно простой приём.
Любая реальная макроскопическая система это коллектив из огромного множества элементов - подсистем. Подсистемы могут иметь и макроскопические размеры, и могут быть микроскопическими, вплоть до атомов и молекул. Всё зависит от рассматриваемой задачи и уровня исследования.
В разные моменты времени в разных точках реальной системы, в разных пространственных регионах макроскопического коллектива мгновенные характеристики его малых элементов могут быть различны. "Неоднородности" в коллективе постоянно мигрируют.
Атомы и молекулы могут находиться в разных квантовых состояниях. Коллектив огромный, и в нём представлены различные комбинации состояний физически одинаковых частиц. На атомно-молекулярном уровне всегда происходит обмен состояниями, имеет место их непрерывное перемешивание. Благодаря этому свойства различных фрагментов макроскопической системы выравниваются, и физически наблюдаемое макроскопическое состояние термодинамической системы внешне выглядит неизменным...
Броуновское движение - главный молекулярный механизм, обеспечивающий перемешивание локальных свойств микроскопических подсистем - элементов макроскопического коллектива. Броуновское движение и ряд сопутствующих ему релаксационных процессов выравнивают в пространстве и усредняют во времени суммарные динамические характеристики макроскопического равновесного коллектива, превращая их в измеримые термодинамические параметры с равновесными значениями.
Так возникает огромное множество мгновенных различающихся суммарных состояний всего коллектива, и все они совместимы с одним и тем же внешне неизменным термодинамическим равновесием системы.
Всё множество, сколь необозримым оно бы не казалось, всевозможных комбинаций микромеханических состояний всех однотипных элементов системы, совместимых с её термодинамическими характеристиками в её определённом наблюдаемом термодинамическом (макроскопическом) состоянии, Гиббс определил как АНСАМБЛЬ.
Ансамбль напоминает ленту бесконечного фильма, кадры котрого, время от времени повторяясь, с бесконечными вариациями изображают одну и ту же сцену с некоторыми изменениями. Элементы ансамбля подобны отдельным кадрам этого бесконечного фильма.
Весь ансамбль изображает макросостояние (фильм), а его элементы суть микросостояния (кадры этого фильма).
Среднее хронологическое и среднее по ансамблю.
Вместо того, чтобы отыскивать проблему усреднения во времени динамических признаков элементов коллектива, вместо исследования непосильной проблемы перемещения огромного числа частиц во времени и в пространстве, Гиббс ввёл замечательный ПОСТУЛАТ О СРЕДНИХ, а именно: "Среднее во времени значение динамической величины равно её среднему по ансамблю". Можно и чуть иначе: "Среднее хронологическое любой динамической величины равно её среднему по ансамблю".
Грандиозная, никакими методами не решаемая, проблема механического изучения и усреднения ВО ВРЕМЕНИ динамических свойств огромного числа элементов, постоянно перемещающихся, перемешивающихся внутри коллектива, сменяется на изумление доступной модельной задачей построения АНСАМБЛЕЙ.
Элементами, идеально подходящими для конструирования ансамблей оказываются не зависящие от времени стационарные состояния (орбитали и термы) квантовых объектов, точнее - их волновые функции. У отдельных частиц, не взаимодействующих между собою, это орбитали всех их стационарных движений и соответствующие орбитальные уровни.
Метод Гиббса универсален.
9. Молекулярная сумма по состояниям идеального газа
Многие свойства суммы по состояниям можно рассмотреть на примере важного частного случая термодинамической системы - идеального газа. Сумма по состояниям идеального газа, состоящего из N одинаковых частиц, может быть выражена через сумму по состояниям одной частицы Q:
![]() ,
(11.7)
,
(11.7)
где множитель 1/N! учитывает квантовый принцип неразличимости частиц.
Во многих случаях уровни энергии молекулы идеального газа можно разбить на слагаемые, соответствующие различным видам движения - поступательному, вращательному, колебательному, электронному и ядерному: E = Eпост + Eвр + Eкол + Eэл + Eяд, поэтому молекулярная сумма по состояниям факторизуется:
Q
= Qпост![]() Qвр
Qкол
Qэл
Qяд (11.8)
Qвр
Qкол
Qэл
Qяд (11.8)
Связь суммы по состояниям с термодинамическими функциями
Внутреннюю энергию термодинамической системы можно представить как среднюю энергию по всем уровням с учетом их заселенности :
 ,
,
где U0 - энергия при абсолютном нуле T = 0. Правую часть этого определения можно преобразовать с помощью определения суммы по состояниям (11.1):
![]() .
(11.3)
.
(11.3)
Таким образом, зная сумму по состояниям, можно определить внутреннюю энергию как функцию температуры и объема.
Другое основное соотношение связывает сумму по состояниям и энергию Гельмгольца:
![]() .
(11.4)
.
(11.4)
Дифференцируя функцию F по температуре и объему, можно найти энтропию и давление:
![]() ,
(11.5)
,
(11.5)
![]() .
(11.6)
.
(11.6)
Последнее соотношение есть не что иное, как термическое уравнение состояния, т.е. зависимость давления от объема и температуры.
Пользуясь соотношениями (11.3) - (11.6), можно найти любые другие термодинамические функции. Интересно, что все термодинамические функции определяются не самой суммой по состояниям, а ее логарифмом.
10. Сумма по состояниям (синонимы - статистическая сумма, статистический интеграл) - это нормирующий множитель функции распределения канонического ансамбля. Если известны уровни энергии системы Ei и их статистические веса gi (т.е., число уровней с энергией Ei), то сумма по состояниям имеет вид:
![]() ,
(11.1)
,
(11.1)
где T - температура, V - объем системы, N - число частиц. Название "сумма по состояниям" отражает тот факт, что функция Z(T,V,N) представляет собой сумму больцмановских множителей для каждого из уровней энергии.
Иногда сумму по состояниям для системы, состоящей из одинаковых частиц, определяют через интеграл по фазовому пространству (отсюда название - "статистический интеграл"). Если известна функция Гамильтона системы H(p,q), то сумму по состояниям определяют следующим образом:
![]() ,
(11.2)
,
(11.2)
где интеграл берется по координатам и импульсам всех N частиц. Здесь h = 6.63 10-34 Дж. с - постоянная Планка. Множитель перед интегралом учитывает неразличимость частиц и квантовый принцип неопределенности.
Главное достоинство суммы по состояниям заключается в том, что она содержит в себе всю термодинамическую информацию о системе. Если каким-либо образом (аналитически или численно) удалось рассчитать сумму по состояниям системы, то можно определить все термодинамические функции и найти уравнение состояния этой системы. Таким образом, основная задача статистической термодинамики сводится к расчету сумм по состояниям термодинамических систем.
а) Поступательную сумму по состояниям можно рассчитать по формуле (11.2) с функцией Гамильтона H(p,q) = p2 / 2m (m - масса молекулы). Интегрирование по трем координатам и трем проекциям импульса производится раздельно и дает:
Qпост
=
![]() ,
(11.9)
,
(11.9)
где V - объем, в котором движется молекула.
б) Вращательная сумма по состояниям зависит от симметрии молекулы. В простейшем случае, для линейной молекулы, уровни энергии зависят только от вращательного квантового числа J: EJ = hcBJ(J+1), где B - вращательная постоянная (размерность - см-1), которая определяется моментом инерции молекулы, c = 3 1010 см/с - скорость света. Каждый вращательный уровень имеет статистический вес gJ = 2J + 1. При не очень низких температурах (T >> B / k) суммирование в (11.1) можно заменить интегрированием по J, что дает:
Qвр
=
![]() (11.10)
(11.10)
Для симметричных молекул это значение надо поделить на число симметрии (для двухатомных гомоядерных молекул оно равно 2).
в)
Колебания ядер описывают с помощью
модели гармонического осциллятора, в
котором уровни энергии линейно зависят
от колебательного квантового числа: En
= hc![]() n, где
-
частота колебаний (в см-1); энергия
состояния с n = 0 принята за точку
отсчета. Колебательные уровни энергии
невырождены, статистический вес равен
1. Сумма по состояниям гармонического
осциллятора с частотой
равна:
n, где
-
частота колебаний (в см-1); энергия
состояния с n = 0 принята за точку
отсчета. Колебательные уровни энергии
невырождены, статистический вес равен
1. Сумма по состояниям гармонического
осциллятора с частотой
равна:
Q
=
 (11.11)
(11.11)
Эта сумма заметно отличается от 1 только тогда, когда дробь в показателе экспоненты меньше 1, т.е. для температур T > Tкол = hc / k. Последнюю величину называют эффективной колебательной температурой для данного колебания. Если температура ниже колебательной температуры, то сумма по состояниям почти равна 1.
В молекуле, состоящей из n атомов, происходит 3n-6 (в линейной молекуле - 3n-5) разных колебаний, каждое - со своей частотой i, поэтому колебательная сумма по состояниям молекулы равна произведению сумм по состояниям для каждого из этих колебаний:
Qкол
=
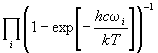 (11.12)
(11.12)
г) Электронные и ядерные уровни энергии в молекуле обычно отстоят очень далеко друг от друга, и при не слишком высоких температурах вклад в соответствующую сумму по состояниям вносит только основной уровень, энергия которого принимается равной 0. Электронная и ядерная суммы по состояниям равны статистическим весам нижнего электронного и ядерного уровня, соответственно:
Qэл = gэл, Qяд = gяд. (11.13)
Молекулярные суммы по состояниям для отдельных видов движения можно использовать для расчета абсолютных и относительных заселенностей отдельных энергетических уровней по закону распределения Больцмана:
 .
(11.14)
.
(11.14)
11. Спектром электромагнитных волн называется полоса частот электромагнитных волн, существующих в природе.
Спектр электромагнитного излучения в порядке увеличения частоты составляют:
1) Низкочастотные волны;
2) Радиоволны;
3) Инфракрасное излучение;
4) Световое излучение;
5) Рентгеновское излучение;
6) Гамма излучение.
Длина́
волны́ —
расстояние
между двумя ближайшими друг к другу
точками, колеблющимися в одинаковых
фазах,
обычно длина волны обозначается греческой
буквой
![]() .
.
Частота колебаний, число полных колебаний в единицу времени.
Волновое число, величина, связанная с длиной волны λ соотношением: k = 2π/λ (число волн на длине 2π). В спектроскопии В. ч. часто называют величину, обратную длине волны (1/λ).
12. КОЛЕБАНИЯ МОЛЕКУЛ - один из осн. видов внутримолекулярного движения, при к-ром происходит периодич. изменение относит, расположения ядер атомов, составляющих молекулу.
При малых отклонениях от положений равновесия ядра будут совершать малые колебания. В случае N-атомной нелинейной молекулы, ядра к-рой в равновесной конфигурации не лежат на одной прямой, ко-лебат. движение характеризуется n=3N-6 степенями свободы. В случае линейных молекул колебат. движение имеет n=3N-5 степеней свободы. К. м. можно разделить на валентные, при к-рых изменяются в основном длины связей, и деформационные, при к-рых .изменяются углы связей.
КОЛЕБАТЕЛЬНЫЕ СПЕКТРЫ, мол. спектры, обусловленные квантовыми переходами между колебат. уровнями энергии молекул. Экспериментально наблюдаются как ИК спектры поглощения и спектры комбинац. рассеяния (КР); диапазон волновых чисел ~10-4000 см -1 (частоты колебат. переходов 3.1011-1014 Гц). Колебат. уровни энергии определяются квантованием колебат. движения атомных ядер.
ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ (ИК спектроскопия), раздел мол. оптич. спектроскопии, изучающий спектры поглощения и отражения электромагн. излучения в ИК области, т.е. в диапазоне длин волн от 106 до 103 м. В координатах интенсивность поглощенного излучения - длина волны (или волновое число) ИК спектр представляет собой сложную кривую с большим числом максимумов и минимумов. Полосы поглощения появляются в результате переходов между колебат. уровнями осн. электронного состояния изучаемой системы (см. Колебательные спектры). Спектральные характеристики (положения максимумов полос, их полуширина, интенсивность) индивидуальной молекулы зависят от масс составляющих ее атомов, геом. строения, особенностей межатомных сил, распределения заряда и др. Поэтому ИК спектры отличаются большой индивидуальностью, что и определяет их ценность при идентификации и изучении строения соединений. Для регистрации спектров используют классич. спектрофотометры и фурье-спектрометры.
Комбинационного рассеяния спектроскопия (рамановская спектроскопия), раздел оптической спектроскопии, изучающий взаимодействие монохроматического излучения с веществом, сопровождающееся изменением энергии рассеянного излучения по сравнению с энергией падающего на объект (возбуждающего) излучения. Комбинационное рассеяние (КР) обусловлено неупругими столкновениями фотонов с молекулами (или ионами), в ходе которых они обмениваются энергией. По изменению энергии фотона можно судить об изменении энергии молекулы, то есть о переходе ее на новый энергетический уровень.
Молекула, находящаяся в невозбужденном состоянии с энергией Е0, под действием кванта с энергией hv0 (h-постоянная Планка, v0-частота падающего кванта) возбуждается в промежуточное (виртуальное) состояние с энергией Eвиpт, откуда может либо вернуться в исходное состояние, испустив квант hv0 (рэлеевское рассеяние), либо перейти в состояние Еi, испустив квант h(v0—vi), что приводит к появлению в спектре рассеянного излучения линий с частотами v0—vi (стоксовы линии). Если до поглощения фотона молекула находилась в возбужденном состоянии с энергией Ei, то после рассеяния света она может перейти как в исходное, так и в основное состояние E0, тогда энергия

Рис. 1. Схема энергетических уровней, иллюстрирующая основные принципы КР. Энергия возбуждающего света hv0, линии КР имеют частоты v0bvi.
рассеянного света возрастает, составляя h(v0+vi), что приводит к появлению в спектре линий с частотами v0+vi (антистоксовы линии). Энергетическое состояние вещества характеризует разность энергий возбуждающего и рассеянного света Ei+hvi, то есть, важнейшей характеристикой спектров КР являются не сами частоты, а их сдвиг относительно частоты рэлеевской линии. Стоксовы и антистоксовы линии располагаются симметрично относительно рэлеевской линии и образуют спектр КР; при этом сдвиги частот vi имеют значения 10-4000 см-1 и совпадают с частотами молекул, наблюдаемыми в ИК спектрах поглощения.
Отбора правила-правила, определяющие возможные Квантовые переходы для атомов, молекул, атомных ядер, взаимодействующих элементарных частиц и др. О. п. устанавливают, какие квантовые переходы разрешены (вероятность перехода велика) и какие запрещены — строго (вероятность перехода равна нулю) или приближённо (вероятность перехода мала); соответственно О. п. разделяют на строгие и приближённые. При характеристике состояний системы с помощью квантовых чисел О. п. определяют возможные изменения этих чисел при переходе рассматриваемого типа.
14. Простой гармонический осциллятор
Колебательная энергия, как и любая другая молекулярная энергия, квантована, и разрешенные значения этой энергии для какой-либо конкретной системы могут быть вычислены из уравнения Шредингера. Для простого гармонического осциллятора это дает
E=(+ )
hкол
(Дж); =0,
1, 2, . . ., (1.2.8.)
)
hкол
(Дж); =0,
1, 2, . . ., (1.2.8.)
где - колебательное квантовое число. В спектроскопических единицах (обратных сантиметрах) допустимые значения энергии простого гармонического осциллятора имеют вид
 (+
)кол
(см-1) (1.2.9.)
(+
)кол
(см-1) (1.2.9.)
Особо отметим, что наименьшая колебательная энергия, которую можно получить, подставив
в формулу E0= hкол (Дж); (кол в Гц), (1.2.10.)
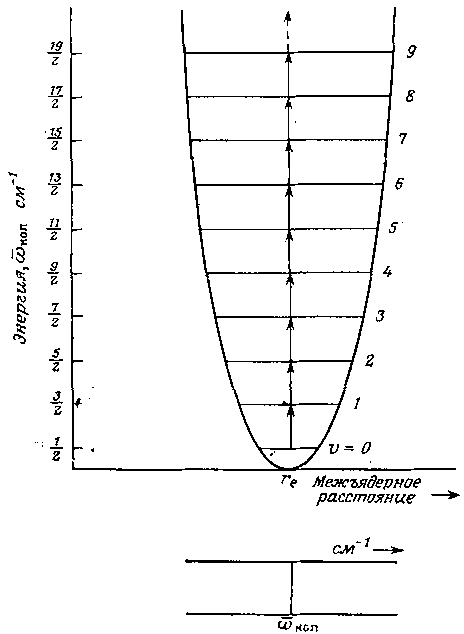
Рисунок 1.1.2. Разрешенные уровни колебательной энергии и переходы между ними для двухатомной молекулы при гармонических колебаниях.
ХАРАКТЕРИСТИЧЕСКИЕ ЧАСТОТЫ-одинаковые или мало отличающиеся друг от друга частоты колебаний определ. групп атомов в разл. молекулах; соответствуют определённым хим. связям (напр., С—Н, С—С, С=С, С=Сl и др.).
