
- •Розділ 3 теплотехнічна частина
- •3.1 Розрахунок горіння палива
- •3.2 Визначення витрати повітря та кількості продуктів згорання.
- •Витрата повітря, склад і кількість продуктів згоряння
- •Витрата повітря, склад і кількість продуктів згоряння
- •Витрата повітря, склад і кількість продуктів згоряння природного газу в повітрі (при дутті, збагаченому o2)
- •3. 3 Складання теплового балансу
- •3.4 Автоматизація теплової роботи печі
Витрата повітря, склад і кількість продуктів згоряння природного газу в повітрі (при дутті, збагаченому o2)
Паливо |
Повітря, м3 |
Продукти згоряння, м3 |
||||||||
Склад |
Сод-е, % |
К-ть, м3 |
O2 |
N2 |
Всього |
CO2 |
H2O |
O2 |
N2 |
Всього |
CH4 |
93,2 |
93,2 |
186,4 |
|
|
93,2 |
186,4 |
0 |
|
|
C2H6 |
0,5 |
0,5 |
1,75 |
|
|
1 |
1,5 |
|
|
|
C3H8 |
0,6 |
0,6 |
3 |
|
|
1,8 |
2,4 |
|
|
|
C4H10 |
0,6 |
0,6 |
3,9 |
|
|
2,4 |
3 |
|
|
|
N2 |
5,1 |
5,1 |
|
454,46 |
|
|
|
459,5 |
|
|
Σ |
100 |
100 |
195,05 |
|
649,5 |
98,4 |
193,3 |
|
751,2 |
|
Σ % |
|
|
30 |
70 |
100 |
13,1 |
25,7 |
61,2 |
100 |
|
Визначення температури горіння. В результаті взаємодії горючих речовин палива з киснем розрізняють такі температури горіння: калориметрична (жаропродуктивність палива), теоретична і дійсна (робоча).
Калориметричною температурою tк називається температура продуктів горіння, яка виходить при згоранні палива без будь-яких втрат, тобто коли все тепло від згоряння горючих речовин палива йде на нагрів продуктів .
tк
=![]() ,
оС
(3.5)
,
оС
(3.5)
где Qнр – нижча теплота згоряння палива, кДж/м3;
Vд – об`єм продуктів згоряння, утворившихся при згорянні одиниці палива;
С – середня об`ємна теплоємкість продуктів згоряння.
Визначення нижчої теплоти згоряння палива Qнр:
Qнр
=
![]() кДж/м3,
кДж/м3,
(3.6)
Ентальпія продуктів згоряння визначається за формулою:
i
=
![]() =
=![]() =
3405 кДж/м3,
(3.7)
=
3405 кДж/м3,
(3.7)
Значення ентальпій повітря і газу в залежності від температури приведення в стандартних таблицях.
Визначаєм ентальпію продуктів згорянняя при tк = 2000 оС:
iCO2 = 0,0984∙4910,51 = 483,19 (кДж/м3); (3.8)
iH2O = 0,1933∙3889,72 = 751,88 (кДж/м3); (3.9)
iN2 = 0,7388∙2970,25 =2194,4 (кДж/м3). (3.10)
 Усього
3429,47 кДж/м3
Усього
3429,47 кДж/м3
При tк = 1900 оС:
iCO2 = 0,0984∙4634,76 = 456,06 (кДж/м3); (3.11)
iH2O = 0,1933∙3657,85 = 707 (кДж/м3); (3.12)
i N2 = 0,7388∙2808,22 =2074,7 (кДж/м3). (3.13)
Усього 3237,76 кДж/м3
io
=
![]() =3333,6
(кДж/м3)
(3.14)
=3333,6
(кДж/м3)
(3.14)
Калориметричну температуру визначаємо за формулою:
tк
= tк'
+
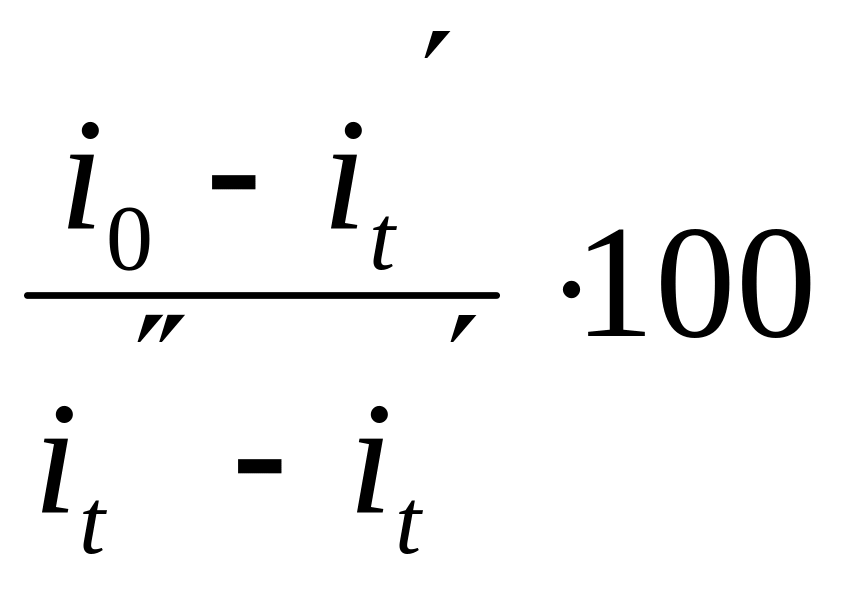 ;
(3.15)
;
(3.15)
tк
=
![]() =
1950
оС.
=
1950
оС.
