
- •Краткие теоретические сведения
- •Ход выполнения работы:
- •Процессы, происходящие при титровании
- •Оформление экспериментальных данных:
- •Оформление результатов работы
- •Контрольные вопросы:
- •Лабораторный практикум (вода)
- •Краткие теоретические сведения
- •Фотометрический анализ
- •Основной закон светопоглощения (закон Ламберта-Бугера-Бера)
- •Графическое отображение закона Ламберта-Бугера-Бера
- •Ход выполнения работы:
- •2) Количественный фотоколориметрический метод
- •Оформление результатов работы
- •Контрольные вопросы:
- •Ход выполнения работы
- •Построение калибровочного графика
- •Краткие теоретические сведения:
- •Ход выполнения работы:
- •Оформление экспериментальных данных
- •Краткие теоретические сведения:
- •Ход выполнения работы:
- •Оформление экспериментальных данных
- •Краткие теоретические сведения
- •Ход выполнения работы
- •Построение градуировочного графика.
- •Контрольные вопросы:
Краткие теоретические сведения:
Данная реакция протекает по уравнению:
Cu
+Cu2+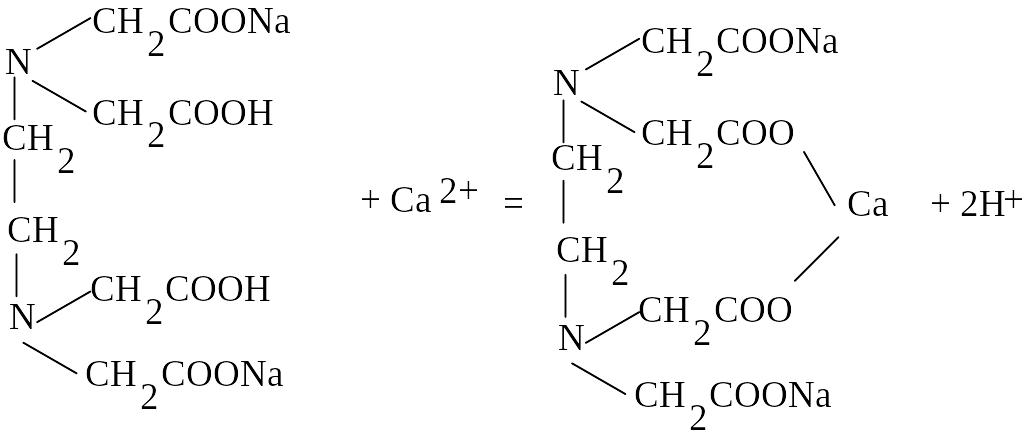
Таким образом, видно, что 1 моль комплексона (трилона Б) связывает 1 моль металла. В качестве индикаторов при комплексонометрическом титровании применяют различные органические вещества, в основном красители, образующие комплексы с ионами определяемых металлов (металлоиндикаторы). Наибольшее распространение получили эриохром черный Т, кислотный хром темно-синий и мурексид.
Метод комплексонометрического титрования основан на способности металлоиндикаторов, образовывать окрашенные комплексные соединения определяемого металла с индикатором. Образование комплекса определяемого метала с металлоиндикатором происходит до достижения точки эквивалентности, по мере достижения точки эквивалентности комплекс определяемого метала с индикатором постепенно разрушается и образуется более прочный комплекс металла с титрантом (трилоном Б). Метод определения меди в природных водах, основан на их способности в щелочной среде образовывать с мурексидом комплексное соединение, окрашенное, в оранжево-розовый цвет. При титровании раствором трилона Б происходят разрушение менее прочного комплекса металлиндикатора с никею и образование комплексоната меди. В точке эквивалентности, когда выделяется индикатор в свободном виде, изменяется окраска раствора. В отсутствие ионов меди цвет раствора мурексида при рН>10 лиловый. Определение меди возможно при содержании его не менее 0,03 мг-экв/л.
Ход выполнения работы:
Отбирают 1 мл пробы, затем переносят в колбу для титрования, далее добавляют 25 мл дистиллированной воды и 5 мл буфера, а так же на кончике шпателя индикатор мурексид и все хорошо перемешивают. Оттитровывают раствором трилона «Б» (до перехода окраски из оранжевой в ярко фиолетовую).
Оформление экспериментальных данных
1. Рассчитывают по формуле:
![]()
где
![]() - объем трилона «Б» взятый для титрования
(мл);
- объем трилона «Б» взятый для титрования
(мл);
![]() -
нормальная концентрация трилона «Б»
(моль/л);
-
нормальная концентрация трилона «Б»
(моль/л);
V - объем пробы, взятой для анализа (мл);
1000 – коэффициент пересчета.
2. Рассчитать по уравнению реакции количество мг-экв Cu2+ в 1 литре исследуемой воды.
Молярная масса
трилона Б:
![]()
Эквивалентная
масса трилона Б:
![]()
Контрольные вопросы:
Сущность метода комплексонометрии.
Индикаторы в комплексонометрическом методе анализа.
Чем обусловлено изменение окраски индикатора в процессе титрования трилоном Б?
Опишите основные этапы и правила титрования.
Какую буферную смесь и с какой целью использовали в данной лабораторной работе?
Лабораторный практикум (вода)
Лабораторная работа № 5
Тема: «Определение ионов никеля с помощью трилонометрии.»
Цель работы: научиться определять ионы никеля способом трилонометрии.
Посуда |
Реактивы |
Приборы |
- колбы конические на 50мл; 100мл; -воронки; -фильтры; -стеклянные палочки; - бюретки
|
- индикатор мурексид (1:200 сухая смесь с KCl)- 0,05г мурексида + 10г KCl - 0,1н р- р трилона «Б» - аммиачный буфер: 20% NH4 OH 20% NH4 Cl - дистилированая вода
|
- аналитические весы;
|
