
- •Билет 1
- •1. Проблема получения низших углеводородов из высших в промышленности решается двумя методами.
- •Билет 3
- •Билет 4
- •1. Алюмосиликаты, как катализаторы в процессах каталитического крекинга. Природа активных центров. Соотношение алюминий: кремний и каталитическая активность алюмосиликатов.
- •2. Алкилирование бензола этиленом в присуствии хлористого алюминия сопровождается индукционным периодом. В чем причина этого явления.
- •Билет 5
- •Билет 7
- •Термодинамика реакции алкилирования изобутана изобутиленом.
- •Билет 8
- •Билет 9
- •1. Катализаторы в реакциях алкилирования изобутилена изобутаном.
- •Билет 10
- •Принципы "зеленой химии", используемые в алкилировании изобутана изобутеленом.
- •Билет 11
- •2. Каталитический крекинг пентана.
- •Билет 12
- •Билет 13
- •1. Все реакции алкилирования ароматических углеводородов непредельными соединениями протекают сходным образом. Эти превращения протекают в присутствии сильных кислот Бренстеда.
- •Билет 14
- •Билет 15
- •1.Термодинамика процессов ароматизации предельных углеводородов
- •Билет 17
- •1. Спилловер водорода. Экспериментальные данные по доказательству этого явления.
- •2. При алкилировании бензола этиленом в качестве побочного продукта образуется толуол, а при алкилирование бензола пропиленом — этилбензол и толуол. Какие реакции приводят к получению этих соединений?
- •Билет 18
- •1. В промышленной органической химии в качестве катализаторов при каталитическом крекинге используются твердые кислоты, которые в минимальной степени способны взаимодействовать со стенками аппаратуры.
- •2. Чтобы реакция прошла, необходимо провести протонирование непредельного соединения.
- •Билет 20
- •Билет 21
- •Характер кинетических кривых в процессе ароматизации гексана.
- •При платформинге н-гептана (470 - 510°с, 4 мПа) при изменении мольного соотношения водород: н-гептан от 2,5 до 24 степень превращения н-гептана возрастает от 15 до 80%. Чем это вызвано?
- •Билет 23
- •Катализаторы, используемые для алкилирования бензола этиленом.
- •Билет 24
Билет 3
Вопрос №1 Термодинамика процессов каталитического крекинга
Знание термодинамики процесс позволяет оценить, при каких температурах целесообразно его проводить, Термохимия реакции позволяет узнать, сопровождается ли превращение выделением или поглощением тепла. термодинамические закономерности сложных процессов не зависят от пути их протекания. Они определяются только состоянием начальных реагентов и конечных продуктов. Термодинамика каталитических и некаталитических реакций не отличаются друг от друга.
Рассмотрим изменение свободной энергии Гиббса для реакции, моделирующей каталитический крекинг. В качестве такой рассмотрим распад нормального октана на нормальный бутан и бутен-1:
СН3(СН2)6СН3 → СН3СН2СН2СН3 + СН3СН2СН=СН2 .
В таблице 2 приведены свободные энергии Гиббса образования реагента, продуктов реакции рассматриваемого процесса, изменение свободной энергии Гиббса в ходе реакции, константы равновесия рассматриваемого процесса.
Таблица 2. Свободные энергии Гиббса образования для участников реакции, изменение свободной энергии Гиббса в ходе реакции (ккал/моль), константы равновесия для процесса распада нормального октана на бутан т бутен-1
Температура, 0К |
∆G0f, С8Н18 |
∆G0f, С4Н10 |
∆G0f, С4Н8 |
∆G0р-ии |
Кр |
298 |
3.92 |
-4.10 |
17.04 |
9.022 |
2.29·10-7 |
500 |
42.02 |
14.55 |
29.39 |
1.92 |
0.14 |
1000 |
142.58 |
64.50 |
63.08 |
-15.00 |
1950 |
Из приведенных в таблице 2 данных следует, что изменение свободной энергии Гиббса реакции становится отрицательной только при высоких температурах. Только при таких температурах равновесие реакций смещено в сторону образования продуктов реакции. Следовательно, процесс каталитического крекинга становится возможным только при повышенных температурах. При низких температурах он становиться невозможным.
Другим важным параметром реакции является ее энтальпия. Если процесс протекает с выделением тепла, то необходимо решить задачу его отвода. Если же реакция протекает с поглощением тепла, то, наоборот, в ходе реакции необходим подвод тепла. Энтальпии реакции определяются как разница сумм энтальпий образования продуктов реакции и сумм энтальпий образования реагентов. В таблице 3 приведены энтальпии образования участников рассматриваемого процесса и энтальпии реакции.
Таблица 3. Энтальпии образования н-октана, н-бутана, бутена-1 и энтальпии реакции (ккал/моль) при разных температурах для реакции распада н-октана
Температура, 0К |
∆Н0f (C8Н18) |
∆Н0f (С4Н10) |
∆Н0f (С4Н8) |
∆Н0р-ии |
298 |
-49.82 |
-30.15 |
-0.03 |
19.64 |
500 |
-55.50 |
-33.51 |
-2.70 |
19.29 |
1000 |
-61.29 |
-37.25 |
-5.54 |
18.50 |
Из приведенных в таблице 3 данных видно, что каталитический крекинг является эндотермической реакции. Изменение температуры практически не влияет на величину теплового эффекта реакции. Каталитический крекинг возможен только при повышенных температурах. Протекание процесса каталитического крекинга будет сопровождаться понижением температуры реакционной смеси. Поэтому для успешного осуществления процесса каталитического крекинга необходим подвод тепла извне.
Каталитический крекинг является катализируемой кислотами реакцией. Необычность процесса заключается в том, что, как правило, всегда предполагается, что для предельных углеводородов характерны лишь радикальные превращения. Ионные реакции с участием предельных углеводородов в учебниках по курсу органической химии обычно не рассматриваются. Тем временем именно на ионных превращениях основан такой крупнотоннажный процесс, как каталитический крекинг.
Вопрос№2
Константа реакции алкилирование бензола непредельными соединениями выглядит след. Образом:
 = K[Бензол]
[Катион]
= K[Бензол]
[Катион]
Из формулы видно, что константа скорости реакции зависит от концентрации Катионов
CH2=CH2
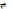 CH3-C
H2+
(1)
CH3-C
H2+
(1)
CH3 – CH=CH2CH3 – CH+ - CH3 (2)
(СН3)2С=СН2
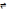 (CH3)3C
+
(3)
(CH3)3C
+
(3)
Энергия образования карбкатиона пропилена выше чем у карбкатиона этилена на 25 ккал , а у катиона изобутилена еще на 16ккал выше. Третичный карбкатион устойчивее чем вторичный и еще более устойчивый чем первичный, отсюда следует, что карбкатион изобутилена устойчивее чем карбкатионы пропилена и этилена. Следовательно в вышеуказанных реакциях равновесие смещено в правую сторону в бООООльшей степени в (3) реакции и активность изобутелена будет выше.
