
- •Билет 1
- •1. Проблема получения низших углеводородов из высших в промышленности решается двумя методами.
- •Билет 3
- •Билет 4
- •1. Алюмосиликаты, как катализаторы в процессах каталитического крекинга. Природа активных центров. Соотношение алюминий: кремний и каталитическая активность алюмосиликатов.
- •2. Алкилирование бензола этиленом в присуствии хлористого алюминия сопровождается индукционным периодом. В чем причина этого явления.
- •Билет 5
- •Билет 7
- •Термодинамика реакции алкилирования изобутана изобутиленом.
- •Билет 8
- •Билет 9
- •1. Катализаторы в реакциях алкилирования изобутилена изобутаном.
- •Билет 10
- •Принципы "зеленой химии", используемые в алкилировании изобутана изобутеленом.
- •Билет 11
- •2. Каталитический крекинг пентана.
- •Билет 12
- •Билет 13
- •1. Все реакции алкилирования ароматических углеводородов непредельными соединениями протекают сходным образом. Эти превращения протекают в присутствии сильных кислот Бренстеда.
- •Билет 14
- •Билет 15
- •1.Термодинамика процессов ароматизации предельных углеводородов
- •Билет 17
- •1. Спилловер водорода. Экспериментальные данные по доказательству этого явления.
- •2. При алкилировании бензола этиленом в качестве побочного продукта образуется толуол, а при алкилирование бензола пропиленом — этилбензол и толуол. Какие реакции приводят к получению этих соединений?
- •Билет 18
- •1. В промышленной органической химии в качестве катализаторов при каталитическом крекинге используются твердые кислоты, которые в минимальной степени способны взаимодействовать со стенками аппаратуры.
- •2. Чтобы реакция прошла, необходимо провести протонирование непредельного соединения.
- •Билет 20
- •Билет 21
- •Характер кинетических кривых в процессе ароматизации гексана.
- •При платформинге н-гептана (470 - 510°с, 4 мПа) при изменении мольного соотношения водород: н-гептан от 2,5 до 24 степень превращения н-гептана возрастает от 15 до 80%. Чем это вызвано?
- •Билет 23
- •Катализаторы, используемые для алкилирования бензола этиленом.
- •Билет 24
Билет 21
Характер кинетических кривых в процессе ароматизации гексана.


рис. 1. В процессе ароматизации концентрация гексана уменьшается по экспоненциальной зависимости.
рис. 2. На графике видно, что существует определенный индукционный период, tинд - время от начала процесса до начала образования целевого продукта - бензола. Это объясняется тем, что гексан не сразу превращается в бензол, а проходит несколько стадий образования промежуточных продуктов (гексен- 1,гексадиен-1,3).
Кинетические кривые промежуточных продуктов имеют колоколообоазный характер. Сначала их концентрация растет и после достижения определенной величины падает
При платформинге н-гептана (470 - 510°с, 4 мПа) при изменении мольного соотношения водород: н-гептан от 2,5 до 24 степень превращения н-гептана возрастает от 15 до 80%. Чем это вызвано?
Известно, что чем выше концентрация молекулярного водорода в реакционной смеси, тем ниже должна быть равновесная концентрация образующегося ароматического соединения. Но, как показывают экспериментальные данные, без дополнительного введения водорода в реакционную систему процесс ароматизации осуществить невозможно. Оказалось, что в присутствии платины молекулярный водород диссоциирует с образованием атомарного водорода: Н2 2Н .
Атомарный водород далее подвергается ионизации с образованием протона и электрона: Н Н+ + е.
Электроны частично захватываются кластерами платины, и они локализуются также в массе носителя. Протоны же закрепляются на поверхности носителя. Оказалось, что локализованные на поверхности носителя протоны играют важнейшую роль в развитии процесса ароматизации.
В системе Pt/Al2O3 молекулы водорода первоначально адсорбируются атомами платины. Платина обеспечивает диссоциацию молекулярного водорода на атомарный. За каталитическую активность этой системы ответственны протоны, находящиеся на поверхности носителя. Явление переноса сорбированных на одной фазе (металл) частиц на другую фазу (носитель платины, например, Al2O3) с образованием каталитически активных соединений, которые на этой фазе не образуются в отсутствии металла, получило название спилловера.
В общем, объясняю, как поняла
В данной реакции водород присутствует как в исходных реагентах, так и в конечных продуктах. Нам нужно, чтобы он присутствовал в исходных реагентах. Поэтому мы, не добавляя его в исходные реагенты, изменяем давление системы до парциального давления водорода (4МПа) и добиваемся того, чтобы водород из конечных продуктов использовался в ходе реакции. В итоге водород образует каталитически активное соединение и степень превращения н-гептана растет.
Билет 23
Катализаторы, используемые для алкилирования бензола этиленом.
В процессе алкилирования долгое время в качестве катализатора использовался хлористый алюминий. Он продолжает использоваться до настоящего времени на существующих производствах алкилирования ароматических соединений.
Из приведенных выше данных видно, что алкилирование ароматических соединений непредельными углеводородами возможно в присутствии кислот Бренстеда-Лаури. Хлористый алюминий не относится к этому классу соединений. Поэтому он не должен катализировать рассматриваемые процессы. Это действительно наблюдается экспериментально. Химически чистый хлористый алюминий не проявляет никакой активности в реакциях алкилирования. Каталитическая активность хлористого алюминия начинает проявляться тогда, когда к нему дополнительно в реакционную систему вводят соединения с подвижным атомом водорода, например, воду, спирты, хлористый водород. Промоторами могут быть галоидные алкилы.
Такие соединения, как вода, спирты энергично реагируют с хлористым алюминием с выделением хлористого водорода:
AlCl3 + ROH → Al(OR)Cl2 + HCl ,
AlCl3 + H2O → Al(OH)Cl2 + HCl .
Эти процессы приводят к появлению в реакционной системе кислоты Бренстеда-Лаури – хлористого водорода. Это соединение не является инертным по отношению к хлористому алюминию. На атоме хлора в хлористом водороде на внешней электронной оболочке локализованы три неподеленные пары электронов. Поэтому этот атом способен проявлять свойства основания Льюиса. Атом же алюминия в хлористом алюминии имеет вакантную атомную орбиталь, и этот атом проявляет свойства кислоты Льюиса. При взаимодействии хлористого алюминия с хлористым водородом в системе генерируется новой соединение – алюминийхлористоводородная кислота:
HCl + AlCl3 → H+[AlCl4]− .
В тетрахлоралюминат-анионе отрицательный заряд делокализован на пяти атомах. Это обстоятельство приводит к тому, что кулоновское взаимодействие протона с комплексным анионом становиться малым. Поэтому алюминийхлористоводородная кислота является по сравнению с хлористым водородом намного более сильной кислотой. Величина функции кислотности Ho, которая характеризует протонирующую способность соединения, для алюминийхлористоводородной кислоты равна минус 15, в то время, как концентрированная серная кислота характеризуется величиной Но, равной минус 12. Алюминийхлористоводородная кислота является по функции кислотности в 1000 раз более сильной кислотой, чем концентрированная серная кислота.
При наличии в системе избыточного хлористого алюминия тетрахлоралюминат-анион образует комплексы со следующими молекулами хлористогоалюминия, образуя полиядерные анионные комплексы:
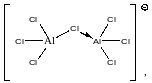

В этих комплексных ионах делокализация отрицательного заряда увеличивается. Это приводит к тому, что протонирующая способность соответствующих этим анионам кислот возрастает.
Таким образом, при алкилировании ароматических соединений непредельными соединениями при катализе реакции хлористым алюминием на первой стадии принимают меры для генерации алюминийхлористоводородная кислота.
Алюминийхлористоводородная кислота является кислотой Бренстеда-Лаури. С позиций рассмотренных выше механизмов превращений она, казалось бы, должна инициировать все указанные взаимодействия. Однако алюминийхлористоводородная кислота не растворима в углеводородах. При введении этой кислоты в реакционную систему в ходе процесса наблюдается индукционный период, после которого реакция начинает нормально протекать. Наличие индукционного периода в химических реакциях свидетельствует о том, что в реакционной системе возникают какие-то промежуточные продукты, которые являются непременными участниками химического взаимодействия. Наблюдая за состоянием реакционной смеси в реакциях алкилирования ароматических соединений непредельными соединениями при катализе хлористым алюминием, Густавсон Г.Г. обратил внимание на то, что в ходе реакции на поверхности хлористого алюминия первоначально медленно образуется темно-коричневая маслянистая жидкость, которая частично растворима в углеводородах. Индукционный период в реакции алкилирования превращается тогда, когда на поверхности катализатора появляется эта темная жидкость. Исследование процессов, протекающих на поверхности алюминийхлористоводородной кислоты, показало, что первоначально на этой поверхности медленно идет полиалкилирование бензола (например, при алкилировании бензола этиленом образуется 1,2,4-триэтилбензол). Основность образующихся полиалкилбензолов столь высока, что далее они образуют устойчивые катионные σ-комплексы с алюминийхлористоводородной кислотой.:

В ходе взаимодействия образуются σ-комплексы всех возможных структур. На приведенной выше схеме показаны только часть из образующихся σ-комплексов. Эти σ-комплексы окрашены. Они существуют в виде тесной ионной пары и обладают частичной растворимостью в углеводородах. Истинными катализаторами в реакциях алкилирования бензола этиленом являются не хлористый алюминий, не алюминийхлористоводородная кислота, а катионные σ-комплексы полиалкилбензолов с алюминийхлористоводородной кислотой. Появление отмеченных σ-комплексов в углеводородной фазе связано с переходом от гетерогенного катализа к гомогенному катализу. Протонирование молекул этилена в этом случае в углеводородной фазе ведется катионными σ-комплексами. При их взаимодействии с молекулами непредельных соединений генерируются алкильные катионы, например:
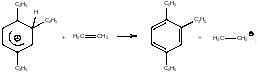
Катионные σ-комплексы, образующиеся в системе: непредельное соединение - алюминийхлористоводородная кислота – бензол, как знак признания заслуг Густавсона Г.Г. в развитии представлений о протекании реакций алкилирования ароматических соединений непредельными соединениями, в настоящее время называют катализаторами (комплексом) Густавсона.
Первоначально процессы алкилирования ароматических соединений алкенами с использованием хлористого алюминия как катализатора являлись периодическими. В дальнейшем был совершен переход на непрерывные схемы производства. Большим недостатком этих технологий является то, что в них появляется отдельная стадия – отделение органических компонент реакционной среды от хлористого алюминия. Эта процедура включает водно-щелочную обработку. При этом возвратный бензол обводняется, что влечет за собой появление узла по сушке бензола. Все это ведет к усложнению технологической схемы.
Современные процессы алкилирования являются непрерывными, и они основаны на использовании нанесенных катализаторов. При этом в технологии полностью исчезает стадия отделения катализаторов от органических компонент реакционной среды.
Среди таких катализаторов используются фосфорная кислота на различных формах цеолитах (процесс UOP). При использовании этого катализатора процесс ведут при 3000С и давлении 40-65 атм. Фирма Mobil-Badger разработала процесс получения этилбензола на цеолите ZSM-5, который проводится при 435-4500С и давлении 14-28 атм. Фосфорная кислота на двуокиси кремния, активированная трехфтористым бором уже много лет используется фирмой UOP для производства этилбензола. Процесс ведут при 2900С и давлении 60-65 атм.
2. При ароматизации н- октана образуются этилбензол и о- ксилол. Приведите схемы превращений, объясняющие их превращения.
При пропускании над алюмомолибденовым или алюмохромовым катализатором в присутствии водорода октан превращается (при 500 °C и давлении 1—2 Мн/м², или 10—20 кгс/см²) в смесь ароматических углеводородов (о-ксилол и этилбензол). Эта реакция дегидроциклизации — одна из основных в процессах каталитического риформинга.Каталитическая дегидроциклизация алканов, то есть отщепление водорода с одновременной циклизацией. Дегидроциклизация – реакция дегидрирования, которая приводит к замыканию цепи в устойчивый цикл.
Все се зависит от пространственного расположения атомов, от того как как они смогут друг к другу подойти.
Если соединяются 2 и 7 атомы то получается о-ксилол, если 3 и 8 то этилбензол.

