
- •Билет 1
- •1. Проблема получения низших углеводородов из высших в промышленности решается двумя методами.
- •Билет 3
- •Билет 4
- •1. Алюмосиликаты, как катализаторы в процессах каталитического крекинга. Природа активных центров. Соотношение алюминий: кремний и каталитическая активность алюмосиликатов.
- •2. Алкилирование бензола этиленом в присуствии хлористого алюминия сопровождается индукционным периодом. В чем причина этого явления.
- •Билет 5
- •Билет 7
- •Термодинамика реакции алкилирования изобутана изобутиленом.
- •Билет 8
- •Билет 9
- •1. Катализаторы в реакциях алкилирования изобутилена изобутаном.
- •Билет 10
- •Принципы "зеленой химии", используемые в алкилировании изобутана изобутеленом.
- •Билет 11
- •2. Каталитический крекинг пентана.
- •Билет 12
- •Билет 13
- •1. Все реакции алкилирования ароматических углеводородов непредельными соединениями протекают сходным образом. Эти превращения протекают в присутствии сильных кислот Бренстеда.
- •Билет 14
- •Билет 15
- •1.Термодинамика процессов ароматизации предельных углеводородов
- •Билет 17
- •1. Спилловер водорода. Экспериментальные данные по доказательству этого явления.
- •2. При алкилировании бензола этиленом в качестве побочного продукта образуется толуол, а при алкилирование бензола пропиленом — этилбензол и толуол. Какие реакции приводят к получению этих соединений?
- •Билет 18
- •1. В промышленной органической химии в качестве катализаторов при каталитическом крекинге используются твердые кислоты, которые в минимальной степени способны взаимодействовать со стенками аппаратуры.
- •2. Чтобы реакция прошла, необходимо провести протонирование непредельного соединения.
- •Билет 20
- •Билет 21
- •Характер кинетических кривых в процессе ароматизации гексана.
- •При платформинге н-гептана (470 - 510°с, 4 мПа) при изменении мольного соотношения водород: н-гептан от 2,5 до 24 степень превращения н-гептана возрастает от 15 до 80%. Чем это вызвано?
- •Билет 23
- •Катализаторы, используемые для алкилирования бензола этиленом.
- •Билет 24
Билет 17
1. Спилловер водорода. Экспериментальные данные по доказательству этого явления.
Явление переноса сорбированных на одной фазе (металл) частиц на другую фазу (носитель платины, например, Al2O3) с образованием каталитически активных соединений, которые на этой фазе не образуются в отсутствии металла, получило название спилловера (англ. spill over – перетекать).
Количество поглощенного водорода. Окись алюминия, активированный уголь практически не адсорбируют молекулярный водород. Крайне незначительные количества водорода способна растворять платина. Более значительные количества водорода способен поглощать палладий (3 атома водорода на 4 атома палладия). Однако ситуация резко меняется, если на эти носители нанести кластеры палладия, платины.
Из экспериментальных данных видно, что активированный уголь с нанесенной в количестве 1% платины поглощает водород в количестве до 3.2 атомов водорода на 1 атом платины. С увеличением количества активированного угля в механической смеси (происходит уменьшение концентрации платины) поглощение водорода резко возрастает.
Явление спилловера водорода является полностью обратимым. При вакуумировании системы поглощенный первоначально водород может быть полностью удален.
Способность платинированного активированного угля поглощать большое количество водорода предлагается использовать в настоящее время для создания устройств для хранения водорода.
Явление повышенного поглощения водорода не раскрывает вопрос о том, в какой форме и как закрепляется водород на поверхности носителя. Ответ на это вопрос был получен в последующих экспериментах.
Восстановление окислов. Желтые окислы вольфрама, молибдена (WO3, MoO3) восстанавливаются при высоких температурах (600-7000С) молекулярным водородом с образованием окрашенных в сине-фиолетовый цвет соединений низшей валентности, например:
2WO3 + H2 → 2 WO2OH ,
2 WO2OH + H2 → 2 WO(OH)2 .
Необходимость высоких температур в этой реакции обусловлена тем, что восстановление осуществляется не молекулярным водородом, а атомарным. Распад же молекулярного водорода на атомарный в сколь-нибудь заметной степени возможен только при высоких температурах. Молекула водорода является одной из наиболее устойчивых из известных. Если в какой-либо системе, по каким-то причинам образуется атомарный водород, то указанные превращения можно использовать для доказательства его возникновения.
Способность окислов вольфрама, молибдена образовывать окрашенные соединения с атомарным водородом при обычных температурах, было использовано для исследования процессов, происходящих при спилловере водорода.
Улавливание спилловерных атомов водорода спиновыми ловушками. Существует ряд соединений, такие как нитроны, нитрозосоединения, которые способны реагировать с короткоживущими радикалами и образовывать долгоживущие радикальные частицы. Эти радикалы далее можно зарегистрировать методом электронного парамагнитного резонанса (ЭПР). Подобного типа соединения получили название спиновых ловушек. В качестве спиновой ловушки часто используют С-фенил-N-трет-бутилнитрон, который реагирует с радикалами с образованием устойчивых нитроксильных радикалов:
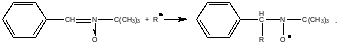 Метод спиновых
ловушек был использован для доказательства
образования атомарного водорода из
молекулярного водорода в системах,
содержащих метал на полярной поверхности.
Метод спиновых
ловушек был использован для доказательства
образования атомарного водорода из
молекулярного водорода в системах,
содержащих метал на полярной поверхности.
Явление восстановления окислов металлов, непосредственный перехват атомов водорода спиновыми ловушками, свидетельствует о том, что спилловер водорода действительно сопровождается диссоциацией молекулярного водорода на атомарный.
Последующее исследование спилловера водорода показало, что это явление не ограничивается только диссоциацией молекулярного водорода на атомарный. На более сложную картину указывает изотопный обмен в гидроксильных группах носителей при использовании метода инфракрасной спектроскопии.
