
- •Билет 1
- •1. Проблема получения низших углеводородов из высших в промышленности решается двумя методами.
- •Билет 3
- •Билет 4
- •1. Алюмосиликаты, как катализаторы в процессах каталитического крекинга. Природа активных центров. Соотношение алюминий: кремний и каталитическая активность алюмосиликатов.
- •2. Алкилирование бензола этиленом в присуствии хлористого алюминия сопровождается индукционным периодом. В чем причина этого явления.
- •Билет 5
- •Билет 7
- •Термодинамика реакции алкилирования изобутана изобутиленом.
- •Билет 8
- •Билет 9
- •1. Катализаторы в реакциях алкилирования изобутилена изобутаном.
- •Билет 10
- •Принципы "зеленой химии", используемые в алкилировании изобутана изобутеленом.
- •Билет 11
- •2. Каталитический крекинг пентана.
- •Билет 12
- •Билет 13
- •1. Все реакции алкилирования ароматических углеводородов непредельными соединениями протекают сходным образом. Эти превращения протекают в присутствии сильных кислот Бренстеда.
- •Билет 14
- •Билет 15
- •1.Термодинамика процессов ароматизации предельных углеводородов
- •Билет 17
- •1. Спилловер водорода. Экспериментальные данные по доказательству этого явления.
- •2. При алкилировании бензола этиленом в качестве побочного продукта образуется толуол, а при алкилирование бензола пропиленом — этилбензол и толуол. Какие реакции приводят к получению этих соединений?
- •Билет 18
- •1. В промышленной органической химии в качестве катализаторов при каталитическом крекинге используются твердые кислоты, которые в минимальной степени способны взаимодействовать со стенками аппаратуры.
- •2. Чтобы реакция прошла, необходимо провести протонирование непредельного соединения.
- •Билет 20
- •Билет 21
- •Характер кинетических кривых в процессе ароматизации гексана.
- •При платформинге н-гептана (470 - 510°с, 4 мПа) при изменении мольного соотношения водород: н-гептан от 2,5 до 24 степень превращения н-гептана возрастает от 15 до 80%. Чем это вызвано?
- •Билет 23
- •Катализаторы, используемые для алкилирования бензола этиленом.
- •Билет 24
Билет 15
1.Термодинамика процессов ароматизации предельных углеводородов
Таблица. Абсолютные энтропии (S0), энтальпии (ΔНof) и свободные энергии Гиббса (ΔGof) образования предельных и ароматических углеводородов и водорода в состоянии идеального газа
Соединение |
|
, ккал/моль |
|
|||
298К |
700К |
298К |
700К |
298К |
700К |
|
Бензол |
64.34 |
90.31 |
19.82 |
16.04 |
30.99 |
48.21 |
н-Гексан |
92.83 |
134.48 |
-39.96 |
-47.34 |
-0.06 |
57.98 |
Толуол |
76.80 |
109.18 |
11.95 |
7.24 |
29.16 |
55.11 |
н-Гептан |
102.27 |
150.55 |
-44.88 |
-53.18 |
1.91 |
69.80 |
о-Ксилол |
84.31 |
123.68 |
4.54 |
-1.07 |
29.18 |
65.56 |
Этилбензол |
86.15 |
125.45 |
7.12 |
1.53 |
31.21 |
66.91 |
н-Октан |
111.55 |
166.45 |
-49.82 |
-59.04 |
3.92 |
81.71 |
Водород, Н2 |
31.21 |
37.17 |
0.00 |
0.00 |
0.00 |
0.00 |
2. Серная кислота обладает большой протонодонорной активностью. Разбавление кислоты водой снижает ее протонодонорную активность очень сильно, поэтому для характеристики активности катализатора важна не столько концентрация кислоты, сколько содержание в ней воды. Серная кислота разбавляется водой не только содержащейся в сырье, но и образующейся в результате окисления углеводородов по реакции:
СnН2n + Н2SО4 → СnН2n-2 + 2Н2O + SО2
По мере использования серной кислоты в ней накапливаются, помимо воды, продукты окисления и сульфирования ненасыщенных углеводородов. 88—90 % кислоту выводят из процесса. Этот предел разбавления используемой серной кислоты определяется следующим. Во-первых, по мере накопления в кислоте воды ухудшается растворимость в ней изобутана. Во-вторых, разбавление кислоты вызывает опасность коррозии оборудования. Наконец, снижается протонодонорная активность кислоты. Все эти причины возникают, в первую очередь, в результате разбавления кислоты водой, и если доля воды в кислотной фазе мала, то концентрация используемой кислоты может быть и несколько ниже указанной. Верхний предел содержания серной кислоты составляет 98% и определяется тем, что кислота более концентрированная имеет высокую температуру кристаллизации и повышенную активность относительно окисления и сульфирования углеводородов.
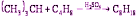
Целевой продукт алкилирования – изооктан – содержит смесь изомеров – 2,2,4; 2,2,4-, 2,3,4-, 2,3,3 -триметилпентан. Причина лежит в особенностях механизма реакции, осложненной процессами изомеризации. Общепринято, что каталитическое алкилирование изоалканов идет через промежуточные образования ионов карбония:
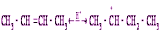
Вторичный ион карбония менее устойчив, чем третичный, вследствие чего происходит быстрый обмен гидрид-ионом с изопарафином:
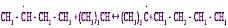
Образующийся третичный карбоний-катион реагирует с исходным олефином:
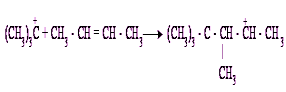
Получившийся ион карбония склонен к внутримолекулярным перегруппировкам, сопровождающимся миграцией водорода и метильных групп.
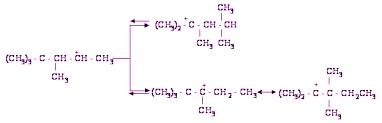
Ионы карбония взаимодействуют с изобутаном, в результате чего получается С8Н18 и третичный бутил-катион:
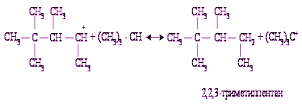
Состав изомеров зависит как от стабильности промежуточных карбоний-ионов, так и от обменной скорости с изобутаном.Растворимость изобутана в H2SO4 невелика и заметно снижается с уменьшением концентрации кислоты, (табл.1).
Таблица 1. Растворимость изобутана в H2SO4.
Концентрация H2SO4 % (масс.) |
99,5 |
98,7 |
96,5 |
Растворимость изобутана в H2SO4 при температуре 13,3 ˚С % (масс) |
0,10 |
0,07 |
0,04 |
Растворимость серной кислоты в изобутане имеет более низкие значения, вследствие чего необходимо применять интенсивное перемешивание реакционной смеси.

 ,
кал/К·моль
,
кал/К·моль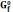 ,
ккал/моль
,
ккал/моль