
- •Васильева л.Ф. , львов с.И. Воспаление, кинезиологическая диагностика и коррекция
- •Содержание:
- •Глоссарий
- •Введение
- •Глава 1 определение воспаления. Признаки, причины и стадии .
- •Причины воспаления
- •Глава 2
- •2.2 Медиаторы и антимедиаторы воспаления
- •Биогенные амины: Гистамин.
- •2.3 Биологически активные пептиды и белки
- •1. Цитокины
- •2.4 Кинины
- •Эйкозаноиды
- •2.5 Циклические нуклеотиды
- •2.6 Комплемент (Участие в воспалительных реакциях).
- •2.7 Белки острой фазы воспаления
- •Характеристика и классификация оф
- •Глава 3
- •2.Стадия воспаления
- •Глава 4
- •3. Стадия пролиферации и репарации
- •Глава 5 воспаление и иммунная реактивность организма
- •Глава 6 особенности хронического воспаления
- •Глава 7 особенности коррекции воспаления методами прикладной кинезиологии
- •Особенности алгоритма диагностики и подбора коррекции воспаления:
- •5 Этап. Работа с воспалением.
- •1.Провокация на воспаление: кинезиологическое подтверждение воспаления
- •Глубокоуважаемые коллеги!
- •Программа семинаров
- •Вертебральная мануальная терапия функциональных блоков тазового региона с основами пк
- •1.4. Вертебральная мануальная терапия шейного отдела позвоночника с основами пк
- •Вертебральная мануальная терапия функциональных блоков тазового региона с основами пк
- •1.4. Вертебральная мануальная терапия шейного отдела позвоночника с основами пк
- •1.5. Висцеральная мануальная диагностика и терапия с основами пк органов брюшной полости.
- •1.6. Висцеральная мануальная терапия органов грудной полости и таза.
- •1.8. Кранио-сакральная мануальная терапия в стоматогностике.
- •2.1. Компрессионные синдромы поясничного отдела Висцеральная, вертебральная, кранио-сакральная терапия.
- •2.2. Компрессионные синдромы шейного отдела позвоночника.
- •2.4. Патобиомеханики суставов конечностей.
- •2.6. Функциональные сколиозы различного генеза. Клиника, дифференциальная диагностика терапия.
- •2.7. Мануальная терапия новорождённых.
- •3.1. Функциональные нарушения химических процессов.
- •3.2. Эмоциональный дисбаланс.
- •3.3. Функциональные нарушения электромагнитных процессов.
- •3.4. Меридианный дисбаланс и его роль в формировании болевых мышечных синдромов.
- •3.5. Уровни регуляции канально-меридианальной системы с позиции прикладной кинезиологии.
- •3.6. Эндокринология.
- •1.5. Висцеральная мануальная диагностика и терапия с основами пк органов брюшной полости.
- •1.6. Висцеральная мануальная терапия органов грудной полости и таза.
- •1.8. Кранио-сакральная мануальная терапия в стоматогностике.
- •2.1. Компрессионные синдромы поясничного отдела Висцеральная, вертебральная, кранио-сакральная терапия.
- •2.2. Компрессионные синдромы шейного отдела позвоночника.
- •2.4. Патобиомеханики суставов конечностей.
- •2.6. Функциональные сколиозы различного генеза. Клиника, дифференциальная диагностика терапия.
- •2.7. Мануальная терапия новорождённых.
- •3.1. Функциональные нарушения химических процессов.
- •3.2. Эмоциональный дисбаланс.
- •3.3. Функциональные нарушения электромагнитных процессов.
- •3.4. Меридианный дисбаланс и его роль в формировании болевых мышечных синдромов.
- •3.5. Уровни регуляции канально-меридианальной системы с позиции прикладной кинезиологии.
- •3.6. Эндокринология.
- •Перечень дисков семинара выходного дня
- •1. Семинар
- •2. Семинар
- •3. Семинар
- •4. Семинар
- •5. Семинар
- •6. Семинар
- •Список литературы по прикладной кинезиологии
- •1 Год обучения
- •1. Теоретические основы прикладной кинезиологии.
- •12. Васильева л.Ф. Михайлов а.М. Патобиомеханика внутренних органов висцеральная диагнсотиика и висцеральная терапия.
- •3 Год обучения
- •Глубокоуважаемые коллеги!
- •Воспаление, кинезиологическая диагностика и коррекция
Причины воспаления
Любой повреждающий агент (флогогенный фактор), который по силе и длительности превосходит адаптационные возможности ткани, может вызвать воспаление. К внешним относятся микроорганизмы (бактерии, вирусы, грибы); животные организмы (простейшие, черви, насекомые), химические вещества (кислоты, щелочи), механические (инородные тела, давление, разрыв) и термические воздействия (холод, тепло), лучевая энергия (рентгеновские, радиоактивные, ультрафиолетовые лучи), токсические металлы и т.д. К эндогенным относят факторы, возникающие в самом организме в результате другого заболевания. Например, воспаление может возникнуть как реакция на опухоль, желчные или мочевые камни, образовавшийся в сосудах тромб. Причиной воспаления могут стать комплексы антиген— антитело, если они фиксируются в каком-либо органе. Решающее значение, определяющее начало воспаления, его развитие и исход: повреждение от действия флогогенного агента (первичная альтерация); выброс из клеток и образование биологически активных веществ — медиаторов воспаления, освобождение и активация лизосомальных ферментов, действие их на биологические макромолекулы (вторичная альтерация); нарушение микроциркуляции, повышение проницаемости стенки сосудов, экссудация; размножение клеток (пролиферация); ликвидация дефекта тканей.
СТАДИИ ВОСПАЛЕНИЯ
Общепринято выделять три стадии воспаления: 1. Стадия альтерации (повреждения): Первичная альтерация. Вторичная альтерация. Разрушение тканей с выделением каскадом медиаторов воспаления. 2. Стадия инфильтрации, экссудации и эмиграции. Сопровождается изменениями микроциркуляторного русла с повышением сосудистой проницаемости, экссудацией и эмиграцией лейкоцитов, фагоцитозом. 3. Стадия пролиферации и репарации: Пролиферация. Завершение воспаления. Сопровождается восстановлением ткани или образованием рубца.

Рис.2. Острая воспалительная реакция

Рис. 3. Механизмы развития острого воспаления (участие ПЯЛ и др. клеток по Дж. Х.Л. Плейфейер, Б.М. Чейн 2008)
Глава 2
Первичная альтерация. Первичная альтерация развивается в зоне действия патогенного фактора и характеризуется повреждением клеточных элементов ткани с последующим освобождением биологически активных веществ (БАВ), лизосомальных гидролитических ферментов, высокоактивных продуктов протеолиза (кининов) и липолиза (лейкотриенов-ЛТ и простагландинов-ПГ), а также активацией комплемента. Диффузия этих субстанций за пределы зоны первичной альтерации приводит к развитию вторичной альтерации. Этиологический фактор явился инициатором, пусковым механизмом процесса, а далее воспаление будет протекать по законам, свойственным ткани, органу, организму в целом. Вторичная альтерация. Действие БАВ, ионов водорода и гидролаз приводит к нарушениям обмена веществ, расстройствам кровообращения и лимфообращения в очаге воспаления. Известно более 100 эндогенных молекул, которые выполняют роль медиаторов воспаления. Они по своему происхождению разделяются на три большие группы: 1) сенсорные нейропептиды. выделяющиеся из окончаний нервных волокон, участвующих в восприятии боли, 2) тканевые или клеточные. Клеточные медиаторы подразделяются на существующие и вновь образованные на фоне воздействия повреждающего фактора; 3) плазменные.
Сенсорные нейропептиды - субстанция Р, нейропептид Y, пептид гена, родственного кальцитонину, и пептид протеинового гена, выделяющиеся уже на первой минуте после повреждения, оказывают мощное сосудорасширяющее действие, индуцируют репрессию молекул межклеточной адгезии на поверхности лейкоцитов и эндотелиальных клеток, способствуя тем самым эмиграции лейкоцитов. Под влиянием сенсорных нейроиептидов резко усиливается накопление в очаге воспаления нейтрофидов. макрофагов и лимфоцитов и значительно возрастает их функция. Активизируются тучные клетки. Освобождение БAB из тучных клеток происходит при их дегрануляции под влиянием лизосомальных ферментов.
Это энергозависимый процесс находится под контролем циклических нукдеотидовв - цАМФ и цГМФ. Увеличение содержания цАМФ в тучных клетках, которое наблюдается при воздействие – адреномиметиков, ПГЕ2 и ингибиторов фосфодиэстазы - фермента, разрушающего цАМФ, ослабляет, а повышение концентрации цГМФ (холинергические вещества, ПГЕ2) усиливает дегрануляцию тучных клеток и высвобождение из них медиаторов воспаления (см далее).
В том числе гистамин относится к числу первых вазоактивных субстанций, появляющихся вскоре после повреждения тканей, и с которых начинается вся цепь событий, характеризующая воспаление и серотонин.
Кроме того активизируются ПЯЛ, выделяются катионные белки и нейтральные протеазы, кининообразующие протеазы, активные метаболиты кислорода, ФАТ (фактор агрегации тромбоцитов выделяется практически всеми клетками участниками воспаления), липидные медиаторы (простагландины и лейкотриены- каскад арахидоновой кислоты, простациклины, тромбоксаны), цитокины (ИЛ1,6,8, ФНО).
Активизируется система комплемента, плазменные медиаторы воспаления (кинины активируются под влиянием XII фактора свертывания крови, который повышает проницаемость сосудов, усиливает миграцию нейтрофилов и агрегацию тромбоцитов).

Рис. 4. Инициация острого воспаления (участие клеток) (В. Войнов 2007)
КЛЕТКИ ВОСПАЛЕНИЯ
Макрофаги. Образуются из моноцитов в тканях. Участвуют в фагоцитозе. Синтезируют целый ряд БАВ: эстеразы, протеазы и антипротеазы; лизосомальные гидролазы — коллагеназа, эластаза, лизоцим, α-макроглобулин; монокины — ИЛ-1, колониестимулирующий фактор, фактор, стимулирующий рост фибробластов; антиинфекционные агенты — интерферон, трансферрин, транскобаламин; компоненты комплемента: С1, С2, СЗ, С4, С5, С6; дериваты арахидоновой кислоты: простагландин Е2, тромбоксан А2, лейкотриены. Активированные макрофаги синтезируют и свыделяют интерлейкин-1 (ИЛ-1). Он находит свои мишени (миоциты, синовиоциты, гепатоциты, костные клетки, лимфоциты, нейроциты). На мембранах этих клеток имеются специфические рецепторы, благодаря которым ИЛ-1 действует именно на них, а не на другие клетки. Действие ИЛ-1 универсально, т.е. срабатывает при любом инфекционном (воспалительном) заболевании, причем в самом начале, и таким образом дает сигнал указанным органам включиться в воспалительный (инфекционный) процесс. Характерные для ранних этапов заболевания симптомы (головная боль, боль в мышцах и суставах, сонливость, лихорадка, лейкоцитоз и увеличение содержания белков, в том числе иммуноглобулинов) объясняется именно действием ИЛ-1.
Стимулируют функцию макрофагов (моноцитов): Mg, Zn, P5P, малат, Бета каротин, В5, фолиновая кислота, вит.С, НАДН, масло печени акулы, карнитин, глютамин, сныть, астрагал, кошачий коготь. эхинацея, женьшень, желтокорень канадский, солодка, кукурма, мирра.
Угнетают: табак, Cu, Р5Р, SAM, глютатион, ацетил коэнзим А, глюкуроновая кислота, сера.
Нейтрофилы. Главная функция этих клеток — фагоцитоз. Из костного мозга они выделяются в кровь, эмигрируют из сосудов и в больших количествах скапливаются в воспаленной ткани. Их активное их размножение, и миграция, и фагоцитоз подвержены регулирующему влиянию БАВ. Действие их проявляется, только тогда, когда на клетках имеются рецепторы, специфически реагирующие с медиатором воспаления: гистамином, адреналином, глюкокортикоидами, гамма-глобулинами и т.д. В цитоплазме нейтрофилов имеется два типа гранул: первичные азурофильные (более крупные) — обычные лизосомы, вторичные, или специфические гранулы мельче содержащие: щелочную фосфатазу, лизоцим, лактоферрин, а также глюкозамингликаны и белки катионовой природы; в них не содержится кислых гидролаз. В первичных гранулах содержатся кислые гидролазы, лизоцим, миелопероксидаза и катионные белки. Нейтрофилы, после выполнения своей функции погибают. Они образуются из стволовых клеток — миелобластов в результате процесса прогрессирующей пролиферации (продолжительность 6 сут) и последующего процесса созревания (продолжительность тоже 6 сут), в ходе которого клетка лишается практически всех органелл. В костном мозге образуется депо нейтрофилов. Из костного мозга они выходят в кровоток. Из крови они поступают в ткани или фиксируются на поверхности кровеносных сосудов (соотношение 1:1). Полупериод их нахождения в крови—6—7 ч. Свои функции они осуществляют в тканях, где переживают еще около двух дней, а потом погибают.

Рис. 5. Эмиграция лейкоцитов в очаге воспаления (В. Войнов 2007)
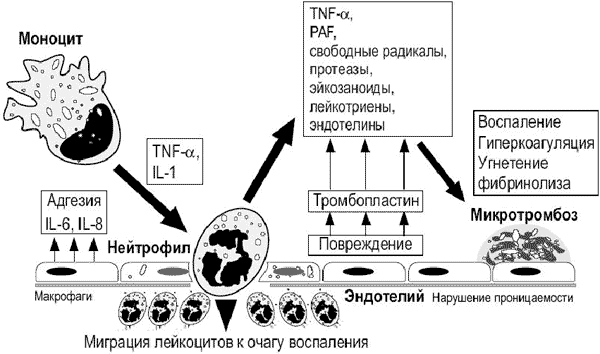
Рис. 6 .Роль нейтрофилов при воспалении
Предполагают, что после двухдневного пребывания в тканях нейтрофилы выходят на поверхность слизистых оболочек (прежде всего в пищеварительном тракте), откуда и выводятся из организма. Более чем 90% необходимой энергии (в виде АТФ) нейтрофилы получают за счет анаэробного гликолиза; роль аэробных путей в образовании АТФ незначительна (приблизительно 10% глюкозы превращается в пентозофосфатном цикле как источнике НАДФ-Н). В ходе фагоцитоза скорость гликолиза (и увеличение образования лактата) повышается на 25—30%, а скорость реакций пентозофосфатного пути повышается в 10 раз.
Бактерицидные факторы нейтрофилов:
1. Увеличение интенсивности дыхания (в 10—20 раз). Это, однако, не направлено на активацию аэробных путей обмена субстратов. Кислород необходим для ряда реакций, приводящих к образованию соединений пероксидной природы (С1_, I-; Br-, атомарного О2, ОН- и Н202) с участием супероксиддисмутазы, каталазы, миелопероксидазы, с помощью которых нейтрофилы уничтожают фагоцитированные микроорганизмы.
Радикалы ОН- являются нестабильными, но крайне реактивными образованиями, которые реагируют практически со всеми органическими соединениями. Они возникают и в ходе процесса липопероксидации: под влиянием липооксигеназ из ненасыщенных жирных кислот образуются их пероксидеривы.
В цитоплазме нейтрофилов возникает избыток Н202, который необходимо устранить. Одну из возможностей для этого предоставляет глютатионпероксидаза.
н2о2 + 2GSH ↔GSSG + Н20
Восстановленная форма глютатиона (GSH) образуется в результате обратной реакции, катализируемой глютатионредуктазой.
2GSSG +2НАДФ+ 2Н+ ↔ 2НАДФ+ 4GSH
Избыток Н202 может быть устранен и в результате действия каталазы, но эта реакция идет при очень высоких концентрациях Н202.
2Н202→ 2Н20 + 02

Рис.7.Роль нейтрофилов в процессе повреждения эндотелия

Рис. 8.Эффекты нейтрофилов
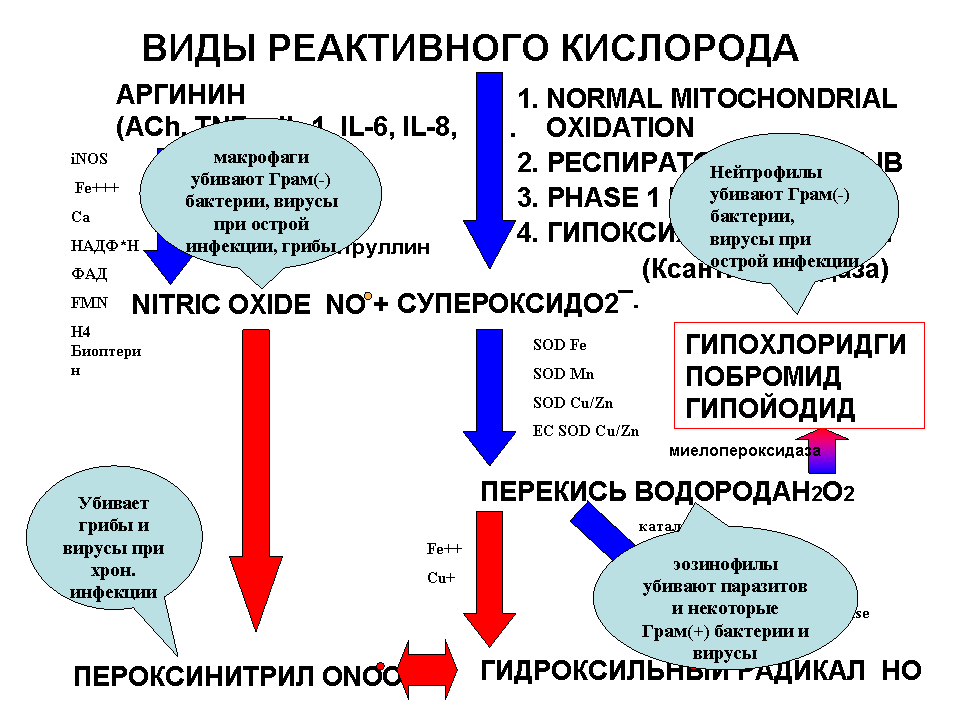
Рис. 9. Образование и функция реактивного кислорода по К. Смиту (2007).
НАДФН-оксидаза локализуется на поверхности цитоплазматической мембраны нейтрофилов, поэтому в результате ее действия большие количества 02-, Н202 и 1О2 оказываются и в промежуточном веществе. В ходе фагоцитоза этот фермент становится частью внутренней поверхности фагосомы и продукты его активности выделяются в ее полость, где и оказывают свое бактерицидное действие. Избыток Н202 возникает в цитоплазме благодаря дисмутации 02- который проникает сюда из фагосом и межклеточного пространства.
Одной из немногих реакций синтеза, протекающих в нейтрофилах, является синтез фосфатидов, особенно во время фагоцитоза. Очевидно, это связано с восстановлением липидных компонентов мембран, утрачиваемых при фагоцитозе.
2. Высокой концентрацией Н+, возникающей при диссоциации конечного продукта анаэробного гликолиза— лактата. В течение нескольких минут фагоцитоза рН в фагосомах снижается до 4—5, что уже само по себе действует бактерицидно па некоторые микроорганизмы. С другой стороны, это создает оптимальные условия для действия гидролаз, находящихся в гранулах, которые устраняют погибшие микробные тела.
3. Лизоцим, т. е. аминополисахаридаза, который расщепляет полисахаридные цепи пептидогликанового слоя клеточной стенки.
4. Комплекс основных белков, называемый фагоцитином. Этот комплекс представляет собой смесь белков, действующих главным образом при низких значениях рН. Он реагируют с отрицательно заряженными группами, находящимися на поверхности микробных тел и способствующими натяжению мембраны в результате взаимного отталкивания. При блокировке этих групп мембрана теряет стабильность своей структуры.
5. Лактоферрин. Это белковая молекула, имеющая высокое сродство к железу при низких значениях рН (в этом его отличие от трансферрина). Тонкий механизм действия неизвестен.
Все вышеперечисленные бактерицидные соединения неферментной природы локализуются в малых гранулах. Присутствующие там гликозамингликаны, очевидно, структуру, предназначенную для связывания основных белков тем же способом, что и гистамин.
Функция нейтрофилов обеспечивается рядом процессов: наличие собственного движения, накопление на поверхности эндотелия в зоне воспаления, активное движение по направлению к микробам (хемотаксис), фагоцитоз, дегрануляция, бактерицидное действие и растворение погибших микробов. Движение нейтрофилов в крови и особенно их миграция в очаг воспаления происходит на основе хемотаксиса (общее биологическое явление, заключающееся в изменении положения их тела в пространстве, обусловленное изменениями собственной подвижности под воздействием определенного химического сигнала (агента)). Хемотаксическим действием обладают фрагменты составляющих комплемента, главным образом СЗа и C5B. C5в. Цитоплазматическая мембрана нейтрофилов содержит для него специальный рецептор, который после взаимодействия с ним индуцирует повышение проницаемости мембраны для К+, Na+ и Са2+ с увеличением содержания последнего иона в цитоплазме. Как и у бактерий, после этого происходит метилирование определенного белка мембраны с последующей конденсацией актиновых волокон и их накопление в том полюсе клетки, который обращен в сторону движения. Кроме петидов — производных комплемента, хемотаксические сигналы подает 12-гидрокси-5, 8, 10,14-эйкозотетраеновая кислота (ЭТЭК), являющаяся продуктом окисления арахидоновой кислоты липооксигеназой. Она при агрегации тромбоцитов, но может возникать при любом процессе, при котором освобождается арахидоновая кислота, например, при лизисе мембран под влиянием компонентов комплемента. С этих же позиций можно объяснить и хемотаксическое действие расщепления коллагена (адгезия тромбоцитов — ЭТЭК) или каликреина (продуцирование кининов и необратимое повреждение клеток — ЭТЭК). Все это указывает на то, что на поверхности мембраны нейтрофилов находятся рецепторы, способные трансформировать изменения импульсов в изменение направления движения. Нейтрофил всегда направляется к поврежденным, но никогда к погибшим клеткам. Действие нейтрофилов не всегда бывает таким успешным, как это было описано. В некоторых случаях нейтрофилам не удается элиминировать вредные агенты, более того, их действие приводит к гибели нейтрофилов Погибающие нейтрофилы становятся источником эндогенного пирогенна.
Стимулируют функцию нейтрофилов: I, Br, Cl, Se, Zn, Вит А.Е, С, В3,П5Ф,Mg, Cu, карнитин, глутамин. таурин. аденозилкабаламин, фолиевая кислота NAC, аденозилкабаламин, кведцертин, кукурма, имбирь, горчица, эхинацея.
Угнетают: сахароза, фруктоза, глюкоза, медь, П-5-Ф, SAM (Mg , ATФ), глютатион, Вит В5, глюкуроновая кислота, сера.
Эозинофилы. На наружных мембранах имеются рецепторы для комплемента, иммунных комплексов, содержащих IgE, IgG. Из ферментов следует упомянуть гистаминазу и арилсульфатазу В. Важную роль играет большой катионный белок, который способен нейтрализовать гепарин, повреждать личинки ряда паразитов. Миграция и активация эозинофилов происходит под влиянием комплемента (С5а и С5—С7), пептидов тучных клеток, ПГД, веществ, продуцируемых гельминтами.
Стимулируют функцию эозинофилов: Mg, Cu, Zn, Fe,ГАМК,П5Ф, таурин, глицин, кукурма, имбирь, горчица, хрен, косточка дикой яблони, арбуз.
Угнетают: Гинко-билоба, фолиновая кислота, П5Ф, Вит В2 (ФАДН2), В3 (НАДН), Zn.
Тромбоциты. Самые постоянные и самые универсальные участники воспаления. В них содержатся вещества, влияющие на проницаемость сосудов, на их сократимость, на рост и размножение клеток, а главное — на свертываемость крови.
Табл. 1. Клетки, участвующие в воспалении
Название клеток |
Вырабатываемые и секретируемые вещества |
Участие в воспалении |
Макрофаги: |
Интерлейкин-1, |
Фагоцитоз |
фиксированные |
ферменты |
Кооперация с другими клетками воспаления. Действие на фибробласты, лимфоциты, гепатоциты, нейроны |
подвижные |
интерферон |
|
печеночные |
фрагменты комплемента |
|
легочные |
простагландины |
|
селезеночные |
ингибиторы протеаз |
|
Тучные клетки |
Гистамин, фактор хемотаксиса эозинофилов, гепарин, фактор активации тромбоцитов, медленно реагирующая субстанция |
Выработка биологически активных веществ |
Нейтрофилы |
Фактор активации тромбоцитов, лейкотриены, ферменты, антимикробные факторы |
Хемотаксис, фагоцитоз, цитотоксическое действие |
Эозинофилы |
Гистаминаза, арилсульфатаза, большой катионный белок |
Деградация гистамина, лейкотриенов |
Тромбоциты |
Простагландины, тромбоксан, лейкотриены; тромбоцитарный фактор роста, фактор проницаемости, катионные белки, серотонин, гистамин, гидролазы, адреналин |
Агрегация, свертывание крови |
Лимфоциты Т и В |
Интерлейкины, лимфокины, иммуноглобулины |
Иммунитет, киллерное действие |
Фибробласты |
Коллаген, гликозамингликаны, фибронектин |
Миграция, пролиферация, созревание; восстановление дефекта |
Тучные клетки (лаброциты). Происходят из базофилов в тканях. При повреждении они выбрасывают содержащиеся в их гранулах гистамин и гепарин. А так как эти клетки в большом количестве располагаются по краям сосудов, то и действие указанных веществ проявляется прежде всего на сосудах (гиперемия). Макрофаги и лаброциты находятся в тканях постоянно (клетки-резиденты). Другие клетки воспаления проникают в зону воспаления со стороны (клетки-эмигранты). К ним относятся полиморфно-ядерные нейтрофилы, эозинофилы и лимфоциты. Стимулируют функцию базофилов: аллергены, гистидин, Р5Р, Mg, Zn.
Ингибируют: Mg, Zn, Cu, АТФ, Витамин Е, В5,каротиноиды, SAM, Лютеин (зеаксантин),кверцетин, гесперадин, глютатион, глюкуроновая кислота, сера, черника. Лимфоциты. Эти клетки играют роль при любом воспалении, особенно при иммунном. Фибробласты. Действие фибробластов проявляется в последней стадии процесса, когда в очаге воспаления увеличивается число этих клеток, оживляется синтез в них коллагена и гликозамингликанов.

Рис.10. Тучная клетка, биохимические функции

Рис. 11. Фагоцитоз (общие сведения, недостаточность) (В. Войнов 2007)
