
Билеты экзамен / Bilet_28
.docxБилет 28
-
Фагоцитоз, его эффекторы, стадии, зависимость от различных факторов



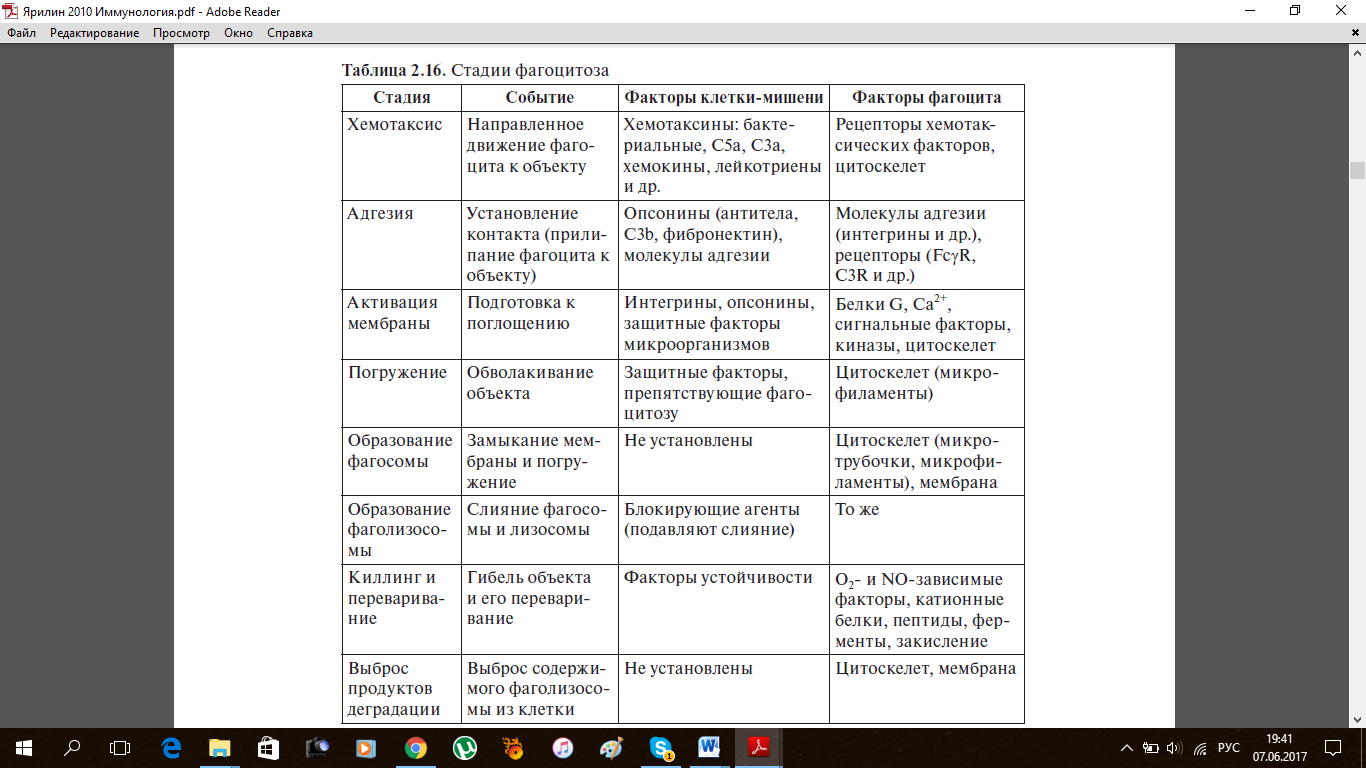
20. Фагоцитоз, его эффекторы, стадии, зависимость от различных факторов.
Фагозитоз - процесс поглощения АГ клетками иммунной системы.
Эффекторы:
● ДК. Локализация в барьерных тканях, лимфоидных органах. Представляют АГ белков,
аллергенов, вирусные. Экспрессируют MHC 1,2. Эндоцитоз, макропиноцитоз, инфекция
вирусов.
● Макрофаги. Локализация - соединительные ткани и паренхима всех солидных органов и
полостей. Представляет АГ, которые фагоцитировала (бактериальные, например). Экспрессия
MHC 2. Не могут поглощать частицы (клетки) больше себя по размеру. Опсонин - C3b.
● Нейтрофилы. Циркулируют в периферической крови, в норме в ткани не выходят, лишь при
наличии очага воспаления. В роли АПК не выступают. Выброс ферментов.
● B лимфоцит. Локализация - В-зависимые органы. Использует HLA II для презентации АГ. При
низкой концентрации АГ и вторичном иммунном ответе могут быть основными АПК.
Основные стадии:
1) Хемотаксис
2) Опсонизация, адгезия и “респираторный взрыв”;
3) Эндоцитоз и цитотоксичность;
4) Деградация патогена и выброс (экзоцитоз)
Факторы влияюшие на фагоцитоз:
● Стимулирующее фагоцитоз
○ Наличие активаторов фагоцитов в среде (IFNγ, гистамин)
○ Наличие опсонинов (фрагменты комплемента)
● Угнетаюшие фагоцитоз
○ Наличие бактериальных белков для зашиты от фагоцитоза (агрессины, антифагины,
лейкоцидины)
○ Наличие капсулы у бактерий
Механизмы цитотоксичности при фагоцитозе.
Цитотоксичность обусловлена дегрануляцией эффектора непосредствено на поверхность микробной
клетки. При дегрануляции, на клеточную мембрану попадают сильные окислители или ферменты,
которые осуществляют повреждение мембраны, что приводит к осмолизу клетки-мишени.
Может быть реализована через кислород-зависимые и кислород-независимые механизмы.
● Кислород-зависимые:
○ образование перекиси H2O2
○ супероксидного аниона — О2-
○ гидроксильного радикала -ОН
○ синглетного кислорода — О2
○ оксида азота NO
○ гипохлорной кислоты HOCl.
● Кислород-независимые:
○ лизоцим
○ α-дефензин - садится на мембрану и делают в ней пору
○ лактоферрин - садится на клеточную стенку, и вызывает её окисление
○ кислые гидролазы
-
Этиоиммунопатогенез аутоиммунного тиреоидита. Клиника. Диагностика. Принципы терапии
Аутоиммунный тиреоидит Хасимото (АИТ) – органоспецифическое преимущественно Тх2-зависимое аутоиммунное заболевание щитовидной железы (ЩЖ), которое сопровождается лимфоидной инфильтрацией и, как правило, заканчивается нарушением её функции (гипотиреоз). В детском и подростковом возрасте АИТ отличается минимальными морфо-функциональными изменениями ЩЖ, у взрослых эти изменения часто бывают значительными.
Встречается чаще у женщин старше 50 лет, характеризуется отсутствием симптомов или скудной клинической симптоматикой:
-
давление в области шеи,
-
болезненность.
Выделяют субклиническую и манифестную формы АИТ, по характеру изменений ЩЖ:
-
диффузный,
-
диффузно-узловой
-
и узловой АИТ,
а по функциональному состоянию ЩЖ принято регистрировать при АИТ
-
гипертиреоз,
-
эутиреоз
-
и гипотиреоз.
Патогенез
II тип - цитотоксический.
Антиген, расположенный на клетке "узнается" антителами классов IgG, IgM. При взаимодействии типа "клетка-антиген-антитело", происходит активация комплемента и разрушение клетки по трем направлениям: комплемент-зависимый цитолиз (А); Фагоцитоз (Б); антителозависимая клеточная цитотоксичность (В).
Если затронуть сам принцип развития аутоиммунного хронического тиреидита, то можно сказать, что в основе заболевания лежит нарушение распознавания белка по принципу свой, чужой. Антитела начинают уничтожать клетки щитовидной железы, как чужеродный белок.
В основном антителами уничтожаются белки:
-
тиреоглобулин;
-
тиреопероксидаза;
-
микросомальные фракции.
Диагностические критерии АИТ.
-
наличие характерных ультразвуковых изменений структуры ЩЖ (диффузная гетерогенность, сниженная эхогенность, наличие узлов);
-
лимфоидная инфильтрация ЩЖ при пункционной биопсии;
-
наличие повышенного титра тиреоидных антител к 1) тиреоглобулину (более 1:1000), 2) тиреоидной пероксидазе (ТПО, микросомальной фракции);
-
неравномерное накопление нуклида (131I, 99Tc) на сцинтиграмме;
-
повышенный базальный уровень ТТГ или сниженный ответ ЩЖ на стимулирование экзогенным ТТГ (менее 15%).
Снижение функции ЩЖ не является облигатным симптомом заболевания и не может служить его основным диагностическим критерием. Однако исследование гормонов ЩЖ является очень полезным. Исследуют уровни ТТГ, Т3, общего и свободного Т4, тиреокальцитонина (для дифференциальной диагностики с медуллярным раком ЩЖ)
Лечение АИТ.
В настоящее время отсутствуют доказательные методы воздействия на собственно аутоиммунный процесс в ЩЖ при АИТ (иммунодерпессанты, иммуномодуляторы, глюкокортикоиды, плазмаферез и т.д.).
При манифестном гипотиреозе (при повышении уровня ТТГ и снижении уровня Т4) показана заместительная терапия L-T4 (L-тироксин) в средней дозе 1,6 – 1,8 мкг/кг веса больного. Критерием адекватности указанной терапии является стойкое поддержание нормального уровня ТТГ в крови.
При субклиническом гипотиреозе (при повышении уровня ТТГ в сочетании с нормальным уровнем Т4 в крови), рекомендуется:
-
повторное гормональное исследование через 3-6 месяцев с целью подтверждения стойкого характера изменения функции щитовидной железы; если субклинический гипотиреоз выявлен во время беременности, терапия L-T4 (L-тироксин) в полной заместительной дозе назначается немедленно;
-
заместительная терапия L-T4 (L-тироксин) при стойком субклиническом гипотиреозе (при повышении уровня ТТГ в крови более 10 мЕд/л, а также в случае как минимум двукратного выявления уровня ТТГ между 5 – 10 мЕд/л); у лиц старше 55 лет и при наличии сердечно-сосудистых заболеваний заместительная терапия L-T4 проводится при хорошей переносимости препарата и отсутствии данных о декомпенсации этих заболеваний на фоне приема препарата;
-
критерием эффективности заместительной терапии при субклиническом гипотиреозе является стойкое поддержание нормального уровня ТТГ в крови.
Назначение препаратов тироксина при АИТ при наличии диагностического уровня антител к ткани ЩЖ и/или ультразвуковых признаков аутоиммунной патологии без нарушения функции щитовидной железы (нормальный уровень ТТГ в крови) нецелесообразно.
Физиологические дозы йода не способны индуцировать развитие АИТ и не влияют отрицательно на функцию ЩЖ при уже существующем гипотиреозе. Что касается фармакологических доз йода, то риск всегда следует соотносить с пользой. При назначении препаратов, содержащих большое количество йода, следует помнить о возможном риске развития гипотиреоза и контролировать функцию ЩЖ.
Наличие узловатой формы АИТ при размере узлов более 2 см является показанием для оперативного вмешательства.
-
Методы определения цитокинов
ИФА: Основным реагентом являются моноклональные АТ к иммуноцитокину, сорбированные на поверхности лунок. На первой стадии исследуемые и контрольные образцы (с известной концентрацией цитокина) инкубируют в лунках с иммобилизованными АТ. Имеющийся в образцах цитокин связывается с иммобилизированными АТ. Не связавшийся материал удаляется отмывкой. Связавшийся цитокин выявляется при инкубации с конъюгатом АТ к цитокину с пероксидазой хрена. После второй отмывки количество связавшегося конъюгата определяют цветной реакцией с использованием субстрата пероксидазы хрена – перекиси водорода и хромогена – тетраметилбензидина. Реакцию останавливают добавлением р-ра серной кислоты и измеряют оптическую плотность растворов в лунках. Интенсивность желтого окрашивания пропорциональна количеству содержащегося в образцах цитокина
