
- •Введение
- •Механизм полимеразной цепной реакции.
- •Компоненты реакционной пцр-смеси
- •Подготовка пробы биологического материала
- •Выделение днк фенол-хлороформной экстракцией.
- •Работа 1. Методика выделения днк методом фенол- хлороформной экстракции из лейкоцитов крови.
- •Работа 2. Методика выделения геномной днк с использованием стаb (гексадецилтриметиламмониум бромид).
- •Работа 3. Методика выделения рнк методом фенол- хлороформной экстракции в присутствии хлорида лития
- •Работа 5. Определение чистоты препарата днк или рнк.
- •Основнык принЦипы пцр-лаборатории
- •А. Оборудование лаборатории
- •Б. Подготовка постановки пцр
- •Стандартная методика для проведения полимеразной цепной реакции.
- •Методика проведения полимеразной цепной реакции
- •Методика проведения стандартной пцр-реакции:
- •Проблема контаминации
- •Электрофоретическая детекция продуктов пцр-реакции
- •Метод горизонтального электрофореза
- •Метод вертикального электрофореза
- •Электрофорез нуклеиновых кислот в агарозном геле
- •Работа 6. Методика горизонтального электрофореза нуклеиновых кислот в агарозном геле.
- •Анализ результатов
- •Список использованной литературы:
Электрофорез нуклеиновых кислот в агарозном геле
Для нуклеиновых кислот широко применяется метод гель-электрофореза. Его принцип заключается в следующем. Исследуемый препарат (раствор ДНК или РНК) вносят в лунку, расположенную у края геля. Находящиеся в буферном растворе макромолекулы обладают некоторым суммарным электрическим зарядом, и когда через гель пропускают элек-трический ток, они перемещаются в электрическом поле. Для учета результатов выделения нуклеиновых кислот среднего размера обычно применяют агарозные гели в присутствии специфического красителя (как правило, бромистый этидий или SYBR Green I). Для фракционирования более крупных молекул ДНК (миллионы пар оснований) денатурированной ДНК и РНК приходится использовать специальные системы электрофореза. Иногда для решения специальных задач для разделения ДНК применяют полиакриламидные гели. Так, в 20 % полиакриламидном геле можно разделить фрагменты ДНК, состоящие всего из шести оснований и различающиеся лишь одним нуклеотидом. Детекция НК основана на использовании интеркалирующих веществ, активирующих свою способность к флуоресценции в результате присоединения к ДНК или РНК. В качестве основного представителя применяется ромистый этидий и SYBR Green I. Этот способ детекции основан на том факте, что флуоресценция бромистого этидия под действием ультрафиолетового излучения значительно возрастает при их внедрении в двухцепочечные молекулы ДНК. Однако он способен взаимодействовать и с молекулами РНК, но менее интенсивно.
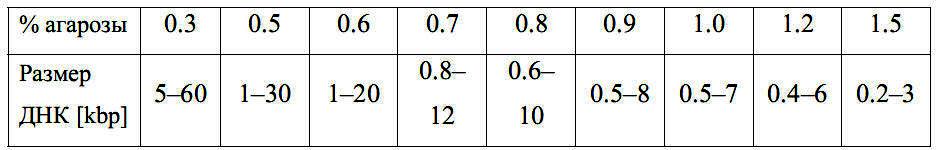
Для разделения нуклеиновых кислот применяют различные концентрации геля, в зависимости от длины исследуемой НК. Диапазон нормального разделения линейных ДНК молекул для гелей с различной концентрацией агарозы приведен в таблице 1.
Таблица 1
Зависимость разделения линейных молекул ДНК от концентрации агарозного геля.
Работа 6. Методика горизонтального электрофореза нуклеиновых кислот в агарозном геле.
1. Взвесить необходимое количество агарозы (ее количество зависит от концентрации используемого геля).
2. Долить 1х ТАЕ буфер до нужного объёма (можно использовать концентрированный – 50х ТАЕ – буфер (2М Tris-HCI, 5.71 % ледяной уксусной кислоты, 2мМ EDТА, довести рН до 8.5).
3. Довести до кипения, кипятить до полного растворения агарозы на электрической плите или в СВЧ-печи.
4. Остудить до 50–60°С (можно держать банку в руках), добавить бромистый этидий до концентрации 0,1 %.
5. Залить форму, дать агарозе застыть в течение 0.5–1 часа.
6. В кармашки внести образцы НК, предварительно добавив буфер для электрофореза (0.1% бромфеноловый синий, 0.1% ксиленцианол, 60% глицерин, 60мМ ЭДТА).
7. Подключить электрофоретическую камеру к источнику питания и задать напряжение, соответствующее напряженности электрического поля из расчета 6-10 В на 1 см геля. Провести электрофоретическое разделение продуктов амплификации в направлении от катода (-) к аноду (+). Контроль за электрофоретическим разделением осуществляется визуально по движению полосы красителя. Полоса красителя должна пройти от старта 2-4 см.
Визуализация результатов электрофореза
8. Вынуть гель из формы и перенести его на стекло УФ-трансиллюминатора.
ВНИМАНИЕ! С гелем агарозы следует работать в перчатках. Бромистый этидий является сильным мутагеном.
9. Включить трансиллюминатор и проанализировать результаты анализа. Фрагменты анализируемой ДНК проявляются в виде светящихся оранжево-красных полос при облучении УФ-излучением с длиной волны 310 нм.
Комментарии к методике:
1. Использовать гель в течение ~2 часов, либо, не вынимая гребёнку, завернуть в пленкой, убрать в холодильник (можно хранить в течение месяца; для < 1% гелей вынимать гребенку из геля можно лишь непосредственно перед применением).
2. При работе с короткими по длине фрагментами ДНК можно использовать ТВЕ буфер (50х: 1М Трис-HCI, 0.9М борной кислоты, 1мМ ЭДТА, довести рН до 8.5), способствующий их лучшему разделению.
