
- •2. Анализ пожарной опасности технологического процесса
- •2.1. Анализ пожаровзрывоопасных свойств веществ, обращающихся в производстве
- •2.2. Оценка возможности образования горючей среды внутри технологического оборудования
- •2.3. Оценка возможности образования горючей среды при выходе веществ наружу из технологического оборудования
- •2.3.1. Расчет смеситель - разбавитель
- •2.4. Анализ причин повреждения аппаратов и трубопроводов, разработка необходимых средств защиты
- •2.4.1. Образование повышенного давления в аппаратах
- •2.5. Анализ причин возможных причин и условий самопроизвольного возникновения горения и зажигания горючих смесей
- •2.5.1. Природные источники зажигания
- •2.5.2. Технологические источники зажигания
- •2.6. Определение возможных причин и условий для распространения пожара
2. Анализ пожарной опасности технологического процесса
2.1. Анализ пожаровзрывоопасных свойств веществ, обращающихся в производстве
В технологическом процессе принимает участие легковоспламеняющиеся жидкость, газы и твердые горючие вещества в холодном и нагретом состоянии при давлении до 0,16 МПа. Рассмотрим ниже пожароопасные свойства основных веществ, обращающихся в процессе:
ЭТИЛЕН
(этен) СН2
= СН2,
молекулярная масса 28,05; горючий бесцветный
газ со слабым запахом; температура
плавления -169,15°С, температура кипения
-103,71°С;
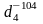 0,566; tкрит
9,2 °С, ркрит
5,042 МПа;
0,566; tкрит
9,2 °С, ркрит
5,042 МПа;
 (жидкости) 0,161 мПа×с;
(жидкости) 0,161 мПа×с;
 (жидкости) 16,4 мН/м; давление пара (кПа):
4110 (0°С), 2200 (-25°С), 151 (-100 °С); Ср
62,16 Дж/(моль×К) (-193 °С);
(жидкости) 16,4 мН/м; давление пара (кПа):
4110 (0°С), 2200 (-25°С), 151 (-100 °С); Ср
62,16 Дж/(моль×К) (-193 °С);
 -1400
кДж/моль.
-1400
кДж/моль.
Растворимость (мл в 100 мл растворителя при 0°С): вода 25,6, этанол 359; хорошо растворим в диэтиловом эфире и углеводородах. В природе этилен практически не встречается. В незначительных количествах образуется в тканях растений и животных как промежуточный продукт обмена веществ. Он обладает свойствами фитогормонов - замедляет рост, ускоряет старение клеток, созревание и опадение плодов. При взаимодействии этилена с хлором образуется дихлорэтан, который при дегидрохлорировании превращается в винилхлорид; последний может быть получен в одну стадию в присутствии силицида кремния при 450-550°С. Гидратация этилена приводит к этиловому спирту, гидрогалогенирование – к этилхлориду, взаимодействие с SCl2 или S2Cl2 – к иприту S(CH2CH2Cl)2, окисление кислородом или воздухом в присутствии оксида Ag при 200-300°С – к этиленоксиду; жидкофазное окисление кислородом в водных растворах PdCl2 и СuСl2 при 130°С и 0,3 МПа – к ацетальдегиду; в тех же условиях в присутствии СН3СООН образуется винилацетат. Этилен алкилирующий агент, широко используется для алкилирования бензола; реакцию проводят в газовой фазе при 400-450°С и давлении 1,4 МПа в присутствии АlСl3 в стационарном слое кизельгура, пропитанного Н3РО4 (возможно использование BF3 и цеолитов).
Этилен исходное соединение для получения полиэтилена высокого и низкого давления и олигомеров этилена, являющихся основой ряда синтетических смазочных масел. Сополимеризацией этилена с пропиленом на катализаторах Циглера - Натты получают этилен-пропиленовые каучуки, обладающие повышенной устойчивостью к окислению и истиранию. В промышленности получают также сополимеры этилена со стиролом и винилацетатом.
Основной
метод получения этилена – пиролиз
жидких дистиллятов нефти или низших
парафиновых углеводородов. Реакцию
обычно проводят в трубчатых печах при
750-900°С и давлении 0,3 МПа. В России, Западной
Европе и Японии сырьем служит прямогонный
бензин; выход этилена около 30% с
одновременным образованием значительного
количества жидких продуктов, в том числе
ароматических углеводородов. При
пиролизе газойля выход этилена 15-25%. В
США основное сырье – легкие алканы
(этан, пропан, бутан), что обусловлено
их высоким содержанием в природном газе
месторождений Северной Америки; выход
этилена около 50%. Разработан метод
получения этилена из метана: 2СН4 С2Н4
+ Н2;
реакцию проводят на оксидах Mn, Tl, Cd или
Рb при 500-900°С в присутствии кислорода.
Газы пиролиза разделяют дробной
абсорбцией, глубоким охлаждением и
ректификацией под давлением. Наиболее
чистый этилен получают дегидратацией
этанола при 400-450°С над Аl2О3;
этот метод пригоден для лаб. получения
этилена.
С2Н4
+ Н2;
реакцию проводят на оксидах Mn, Tl, Cd или
Рb при 500-900°С в присутствии кислорода.
Газы пиролиза разделяют дробной
абсорбцией, глубоким охлаждением и
ректификацией под давлением. Наиболее
чистый этилен получают дегидратацией
этанола при 400-450°С над Аl2О3;
этот метод пригоден для лаб. получения
этилена.
Применяют этилен в промышленном органическом синтезе (в ряде процессов он вытесняет ацетилен), а также как регулятор роста растений, для ускорения созревания плодов, дефолиации растений и снижения преждевременного опадания плодов.
Этилен взрывоопасен, КПВ 3-34% (по объему), температура вспышки 136,1°С, температура самовоспламенения 540°С, ПДК в атмосферном воздухе 3 мг/м3, в воздухе рабочей зоны 100 мг/м3 [5].
Средства тушения – объёмное тушение хладонами, 85% (масс.) СО2 + 15% (масс.) С2F4Br2 .
ТРИЭТИЛАЛЮМИНИЙ (C2H5)3Al, молекулярная масса 114,16; бесцветная подвижная жидкость; температура плавления -52,5°C, температура кипения 136°C; плотность 0,875 г/см3 (25°C), смешивается с органическими растворителями.
По химическим свойствам триэтилалюминий – типичный представитель алюминийорганических соединений; на воздухе самовоспламеняется; в реакциях с H2O, спиртами, аминами, галогенами отщепляет три группы C2H5, с третичными спиртами или вторичными аминами может отщепляться одна группа C2H5, что используют для количественного анализа триэтилалюминия; с галогенидами щелочных металлов и солями аммония образует кристаллические комплексы состава 1:1, например (C2H5)3Al·KCl, температура плавления 40°C, или 2:1, например 2(C2H5)3Al·KF, температура плавления 129°C; с неорганическими солями металлов II-IV групп – соединений со связью М–С2Н5.
В промышленности триэтилалюминий получают в основном реакцией этилена с мелкораздробленным Al и H2 в гексане при 110-115°C и давлении 15-16 МПа, в лаборатории – взаимодействием C2H5Li или C2H5MgHal с AlCl3 или этилалюминийсесквибромидом в бензоле в инертной атмосфере.
Триэтилалюминий – компонент катализаторов Циглера - Натты, восстанавливающий агент (например, для превращения карбонильной группы в спиртовую); применяется также для нанесения пленок.
Средства тушения: при крупных проливах – распылённая вода, пена, порошки ПСБ и ПФ; в помещениях – объёмное тушение СО2, хладонами; малые очаги – СО2 .
ЦИКЛОГЕКСАН, молекулярная масса 84,16; бесцветная жидкость с характерным запахом; температура плавления 6,5°С, температура кипения 79-81°С; температура вспышки -17°С. Не растворим в воде, смешивается со спиртами, простыми и сложными эфирами, хлорируется углеводородами, аминами, жирными кислотами. Образует азеотропные смеси с водой (температура кипения 69°С, 96,1% циклогексана по массе), бензолом (77,5 °С, 45% циклогексана).
При обычных температурах молекула циклогексана существует в виде двух кресловидных конформаций, быстро переходящих одна в другую. Длины связей (нм): 0,15 (С—С), 0,11 (С—Н), угол ССС 111,4°.
Циклогексан содержится в нефтях (0,9-1,5% по массе). По химическим свойствам циклогексан – типичный представитель циклоалканов. При жидкофазном окислении воздухом при 142-145°С и 0,7 МПа образует смесь циклогексанона и циклогексанола. Нитрование 30%-ной HNO3 или NO2 приводит к нитроциклогексану, при действии более концентрированной HNO3 окисляется до адипиновой кислоты, нитрозирование циклогексана NOCl приводит к циклогексаноноксиму (полупродукту в производстве капролактама). При дегидрировании циклогексана над Ni, мелкораздробленной Pt или Pd образуется бензол (в присутствии Pd реакция обратима), при действии брома – гексабромбензол, при хлорировании –хлорциклогексан с примесью полихлорпроизводных, при действии йода – бензол. При нагревании до 30-80°С над АlСl3 циклогексан изомеризуется в метилциклопентан. Пиролиз циклогексана при 450-600°С дает смесь насыщенных и ненасыщенных углеводородов.
Получают циклогексан гидрированием бензола в жидкой фазе над Ni-Ренея при 150-250°С и 1-2,5 МПа (выход 99%), а также выделяют ректификацией из нефтепродуктов.
Циклогексан – сырье в органическом синтезе, растворитель эфирных масел, восков, лаков, красок и др., экстрагент в фармацевтической промышленности.
Циклогексан раздражает дыхательные пути. ПДК в атмосферном воздухе 1,4 мг/м3. Температура вспышки -20°С, температура самовоспламенения 260°С, КПВ 1,3-8% (по объему) [8].
Средства тушения: при крупных проливах – пена, порошок ПСБ-3; в помещениях – объёмное тушение СО2, хладонами; небольшие очаги – ПСБ, СО2 .
БЕНЗИНЫ (франц. benzine, от араб. любан джави – яванское благовоние), смеси различных углеводородов, выкипающие в пределах 30-205°С. В состав бензинов, кроме углеводородов (парафиновых, олефиновых, нафтеновых и ароматических), могут входить примеси – серо-, азото- и кислородсодержащие соединения. Бензины готовят смешением компонентов, получаемых в основном переработкой нефти – прямой перегонкой (так называемый прямогонный бензин), а также крекингом, риформингом, коксованием и др. Применяют главным образом в качестве горючего для двигателей внутреннего сгорания с принудительным воспламенением (карбюраторных и с непосредственным впрыском). Небольшие количества бензина используют как растворители и промывочные жидкости.
Температура замерзания бензина ниже -60°С, температура вспышки ниже 0°С. При концентрации паров бензина в воздухе 74-123 г/м3 образуются взрывчатые смеси. (низшая) 41-44 МДж/кг; Ср 2,0-2,1 кДж/(кг*К); 0,50-0,65 мм2/с (20°С); плотность 0,700-0,780 г/см3 (20°С); среднее значение коэффициент диффузии для паров бензина при атмосферном давлении и 20°С 9,1 мм2/с. Основные эксплуатационные характеристики бензинов, применяемых как горючее, – испаряемость, горючесть, воспламеняемость, химическая стабильность, склонность к образованию отложений, коррозионная активность.
Бензин проникает в организм в основном через легкие. Опасность отравления существует на всех этапах его производства, транспортировки и особенно при его использовании. ПДК паров от 100 до 300 мг/м3. При остром отравлении парами появляются головная боль, неприятные ощущения в горле, кашель, раздражение слизистой оболочки глаз, носа, в тяжёлых случаях – головокружение, неустойчивая походка, психическое возбуждение, замедление пульса, иногда - потеря сознания. При хроническом отравлении обычны жалобы на головную боль, головокружение, расстройство сна, раздражительность, повышенную утомляемость, похудание, боли в области сердца и др.
При острых отравлениях необходимы свежий воздух, кислород, сердечные и успокоительные средства. При попадании бензина в желудок принимают внутрь растительное масло (30-50 г). Лица, страдающие функциональными заболеваниями нервной системы и эндокринных органов, к работе с бензином не допускаются [6].
Средства тушения: при крупных проливах – распылённая вода, пена, порошок ПСБ; в помещениях – объёмное тушение СО2, хладонами; малые очаги – СО2 .
МЕТИЛОВЫЙ СПИРТ (метанол, карбинол, древесный спирт) СН3ОН, молекулярная масса 32,04.
Метанол бесцветная, легкоподвижная жидкость с запахом, аналогичным запаху этилового спирта; температура плавления -93,9°С, температура кипения 64,509°С.
Метиловый спирт смешивается во всех соотношениях с водой, спиртами, ацетоном, бензолом; образует азеотропные смеси с ацетоном (температура кипения 55,7°С; 12% метилового спирта), бензолом (температура кипения 57,5°С; 39% метилового спирта), CS2 (температура кипения 37,65°С; 14% метилового спирта), ССl4 (температура кипения 55,7°С; 20,66 % метилового спирта) и многими другими соединениями.
По
химическим свойствам метиловый спирт
– типичный одноатомный алифатический
спирт: сочетает свойства очень слабого
основания и еще более слабой кислоты.
Со щелочными металлами образует метилаты,
например CH3ONa,
с кислотами – сложные эфиры (реакция
ускоряется в присутствии сильных
минеральных кислот), например с HNO2
дает метил-нитрит CH3ONO
(количественно), с H2SO4
при температуре ниже 100°С –метилсульфат
CH3OSO2OH,
с карбоновыми кислотами – RCOOCH3.
Окисляется кислородом воздуха (кат.-Ag,
Сu, оксиды Fe, Mo, V и др.) при 500-600°С до
формальдегида: СН3ОН
+ 0,5О2![]() НСНО
+ Н2О;
при пропускании паров метилового спирта
над медьсодержащим катализатором
образуется метилформиат: 2СН3ОН
НСНО
+ Н2О;
при пропускании паров метилового спирта
над медьсодержащим катализатором
образуется метилформиат: 2СН3ОН![]() НСООСН3
+ 2Н2.
Последний получается также при
взаимодействии метилового спирта и СО
в присутствии метилатов щелочных
металлов, а в присутствии родиевого
катализатора и СН3I
они дают уксусную кислоту. При
взаимодействии со смесью СО и Н2
метиловый спирт превращается в этанол
и др. спирты. Он разлагается водяным
паром на катализаторе: СН3ОН
+ Н2О
НСООСН3
+ 2Н2.
Последний получается также при
взаимодействии метилового спирта и СО
в присутствии метилатов щелочных
металлов, а в присутствии родиевого
катализатора и СН3I
они дают уксусную кислоту. При
взаимодействии со смесью СО и Н2
метиловый спирт превращается в этанол
и др. спирты. Он разлагается водяным
паром на катализаторе: СН3ОН
+ Н2О![]() ЗН2
+ СО2.
После очистки от СО2
получают Н2
98%-ной чистоты. Таким способом производят
Н2
в передвижных установках небольшой
мощности.
ЗН2
+ СО2.
После очистки от СО2
получают Н2
98%-ной чистоты. Таким способом производят
Н2
в передвижных установках небольшой
мощности.
При взаимод. с NH3 в присут. дегидратирующих катализаторов метиловый спирт образует метиламины:
![]()
Ароматические
амины метилируются метиловым спиртом
в присутствии H2SO4
(200°С;
3 МПа): C6H5NH2
+ 2CH3OH
![]() C6H5N(CH3)2+
+2Н2О.
При 3,5 МПа и 340-380°С он реагирует с бензолом,
образуя толуол. Дегидратацией метилового
спирта при повышенных температурах
(катализатор - Аl2О3)
получают диметиловый эфир: 2СН3ОН
C6H5N(CH3)2+
+2Н2О.
При 3,5 МПа и 340-380°С он реагирует с бензолом,
образуя толуол. Дегидратацией метилового
спирта при повышенных температурах
(катализатор - Аl2О3)
получают диметиловый эфир: 2СН3ОН![]() СН3ОСН3
+ +Н2О.
На высококремнистых цеолитах при
340-450°С метиловый спирт превращается в
парафины и ароматические углеводороды.
С галогеноводородными кислотами, SO2Cl2
или РОСl3
образует метилгалогениды. Взаимодействует
метиловый спирт с йодом и фосфором в
промышленности получают метилиодид:
10СН3ОН
+ 5I2
+ 2Р
СН3ОСН3
+ +Н2О.
На высококремнистых цеолитах при
340-450°С метиловый спирт превращается в
парафины и ароматические углеводороды.
С галогеноводородными кислотами, SO2Cl2
или РОСl3
образует метилгалогениды. Взаимодействует
метиловый спирт с йодом и фосфором в
промышленности получают метилиодид:
10СН3ОН
+ 5I2
+ 2Р![]() 10СН3I
+ +2Н3РО4
+ 2Н2О.
При повышенных температурах на
катализаторе метиловый спирт разлагается
на СО и Н2.
10СН3I
+ +2Н3РО4
+ 2Н2О.
При повышенных температурах на
катализаторе метиловый спирт разлагается
на СО и Н2.
В промышленности метиловый спирт получают главным образом каталитической реакцией из синтез-газа:
СО2
+ ЗН2![]() СН3ОН
+ Н2О
+ 49,53 кДж;
СН3ОН
+ Н2О
+ 49,53 кДж;
Образующаяся вода вступает в реакцию:
Н2О
+ СО![]() СО2
+ Н2
+ 41,2 кДж.
СО2
+ Н2
+ 41,2 кДж.
Константа равновесия образования метилового спирта из СО2 и Н2 с учетом ассоциации паров может быть рассчитана по уравнению:

Сырьем для производства метилового спирта служат главным образом природный газ и отходы нефтепереработки, а также коксующийся уголь, газы производства ацетилена пиролизом природного газа и других До 1960-х гг. метиловый спирт синтезировали только на цинкхромовом катализаторе при 300-400°С и давлении 25-40 МПа. Впоследствии распространение получил синтез метилового спирта на медьсодержащих катализаторов (медьцинкалюмохромовом, медьцинкалюминиевом или др.) при 200-300°С и давлении 4-15 МПа.
Температура вспышки 15,6°С (в открытой чашке), температура самовоспламенения 464°С, КПВ 6,70-36,5%. метиловый спирт – сильный, нервный и сосудистый яд с резко выраженным кумулятивным действием; отравление наступает при приеме внутрь (смертельная доза для человека 30 г, а 5-10 г могут вызвать тяжелое отравление), вдыхании паров и проникновении через кожу. ПДК 5 мг/м3 .
Средства тушения: при крупных проливах – распылённая вода, пена, порошки ПСБ и ПФ; в помещениях – объёмное тушение СО2, хладонами; малые очаги – СО2. При тушении пенами использовать ПО-1с и Форэтол с интенсивностью подачи 0,5 л/(м2×с) .
Вывод по разделу: Из анализа пожароопасных свойств веществ видно, что в данном производстве применяются вещества, которые могут образовать горючую среду как в помещении.
