
§5 Основное уравнение молекулярно-кинетической теории идеальных газов.
Применим распределение Максвелла для вывода основного уравнения кинетической теории газов. Наша задача установить путем статистического усреднения микрохарактеристик молекул системы, некоторые макрохарактеристики, описывающие газ в целом. Известно, что давление газа создается за счет ударов молекул газа о стенки сосуда. Примем, что удар является абсолютно упругим и молекулы бомбардируют стенки как материальные точки под разными углами и с различными скоростями.
По второму закону Ньютона:
![]() ,
,
![]() .
.
Молекулы ударяются о стенку и отскакивают,
меняя только
![]() -составляющую
скорости. Подсчитаем изменение
-составляющей
импульса всех молекул за время
-составляющую
скорости. Подсчитаем изменение
-составляющей
импульса всех молекул за время
![]() .
Надо подсчитать поток импульса молекул
в положительном направлении оси
.
Надо подсчитать поток импульса молекул
в положительном направлении оси
![]() ,
т.е.
,
т.е.
![]() м2,
м2,
![]() с,
поток – число частиц пролетающих за
единицу времени через единичную площадку.
В стенку ударятся только те молекулы,
которые движутся к ней, а не от нее, т.е.
с,
поток – число частиц пролетающих за
единицу времени через единичную площадку.
В стенку ударятся только те молекулы,
которые движутся к ней, а не от нее, т.е.
![]() .
За время
до стенки долетают все молекулы в объеме
.
За время
до стенки долетают все молекулы в объеме
![]() ,
,
![]() .
.
Вероятность частиц иметь такую скорость
![]() ,
тогда число частиц, имеющих такую
скорость
,
тогда число частиц, имеющих такую
скорость
![]() .
.
Импульс, передаваемый стенке сосуда
![]()
![]() ,
вычислим
,
вычислим
![]() отдельно внутренний интеграл и подставим
в выражение
отдельно внутренний интеграл и подставим
в выражение
![]()
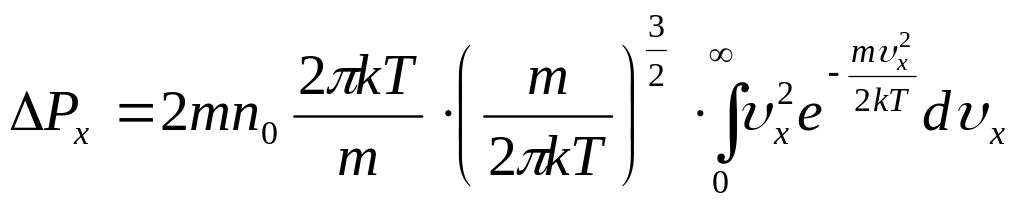 ,
рассчитаем интеграл, сделав замену
переменной,
,
рассчитаем интеграл, сделав замену
переменной,
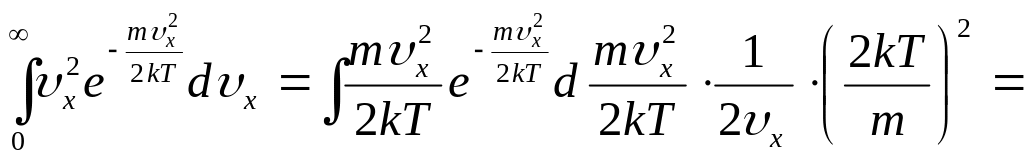
![]() ,
,
![]() ,
,
![]() ,
отсюда
,
отсюда
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
подставим полученное в интеграл:
,
подставим полученное в интеграл:
![]() .
Таким образом давление на стенку
.
Таким образом давление на стенку
![]() .
.
Аналогично для других стенок
![]() ,
с другой стороны
,
с другой стороны
![]() ,
тогда
,
тогда
![]() ,
таким образом
,
таким образом
![]() ,
,
![]() - основное уравнение молекулярно-кинетической
теории идеального газа.
- основное уравнение молекулярно-кинетической
теории идеального газа.
Отсюда можно получить уравнение состояния идеального газа:
![]()
![]() - уравнение состояния идеального газа.
- уравнение состояния идеального газа.
Если имеется смесь газов, то
![]() - закон Дальтона.
- закон Дальтона.
§6 Функция Больцмана
Плотность вероятности того, что молекула
имеет положение в интервале
![]() – функция распределения Больцмана
– функция распределения Больцмана
![]()
Вероятность того, что частица находится
в объеме
![]() ,
вблизи точки
,
вблизи точки
![]() -
-
![]() .
.
Определим зависимость плотности
![]() идеального газа в поле сил тяжести при
изотермических условиях. Потенциальная
энергия частицы в поле силы тяжести:
идеального газа в поле сил тяжести при
изотермических условиях. Потенциальная
энергия частицы в поле силы тяжести:
![]() ,
,
![]() ,
тогда число частиц в объеме
,
,
тогда число частиц в объеме
,
![]() .
.
Масса частиц в объеме
![]() ,
отсюда
,
отсюда
![]() .
.
Пусть
![]() ,
тогда обозначив,
,
тогда обозначив,
![]() - плотность на уровне моря, а
- плотность на уровне моря, а
![]() ,
получим
,
получим
![]() зависимость плотности от высоты
зависимость плотности от высоты
![]() .
.
Если учтем уравнение состояния идеального газа, то получим зависимость давления от
высоты
![]() получим
получим
![]() - барометрическая формула.
- барометрическая формула.
Используя распределение молекул по высоте Ж.Перрен экспериментально определил постоянную Авогадро. Он исследовал под микроскопом распределение броуновских частиц, т.е. считал под микроскопом число таких частиц на разных высотах в сосуде. Частицы были помещены в жидкость, плотность которой лишь на немного меньше плотности материала частиц, для того чтобы тяжелые частицы не «осели на дно», а распределились в достаточно большом слое по высоте.
![]() ,
где
,
где
![]() - масса частицы,
- масса частицы,
![]() - масса вытесненной воды.
- масса вытесненной воды.
![]() ,
,
![]()
![]()
![]() .
.
§7 Распределение энергии по степеням свободы.
Среднее значение энергии одной молекулы
![]() .
Если бы мы посчитали отдельно
.
Если бы мы посчитали отдельно
![]() ,
то получили бы величину ровно в три раза
меньшую, чем полная энергия. Такие же
значения и для
,
то получили бы величину ровно в три раза
меньшую, чем полная энергия. Такие же
значения и для
![]() .
.
Таким образом, если вы молекула могла
двигаться только вдоль оси
,
ее средняя энергия была бы
![]() .
Говорят, что у молекулы, которая может
совершать только одномерные движения
– одна степень свободы:
.
Говорят, что у молекулы, которая может
совершать только одномерные движения
– одна степень свободы:
![]() .
Это значит. Что нужна только одна
переменная, чтобы описать движение
частицы. Для материальной точки таких
переменных нужно 3:
.
Это значит. Что нужна только одна
переменная, чтобы описать движение
частицы. Для материальной точки таких
переменных нужно 3:
![]() .
Если же молекула может еще и вращаться,
то число степеней свободы увеличивается.
Средняя энергия, приходящаяся на одну
степень свободы вращательного движения,
а также на одну колебательную степень
свободы (как потенциальной , так и
кинетической) равна
.
.
Если же молекула может еще и вращаться,
то число степеней свободы увеличивается.
Средняя энергия, приходящаяся на одну
степень свободы вращательного движения,
а также на одну колебательную степень
свободы (как потенциальной , так и
кинетической) равна
.
Теорема о равнораспределении энергии по степеням свободы: на все степени свободы статистической системы приходится одна и та же энергия . Это не относится к потенциальной энергии системы во внешних полях.
Средняя энергия одной молекулы
![]() ,
где число степеней свободы
,
где число степеней свободы
![]() .
.
Р асхождение
теории теплоемкости идеального газа с
экспериментом.
асхождение
теории теплоемкости идеального газа с
экспериментом.
Например, для некоторого количества
идеального газа:
![]() ,
его молярная теплоемкость
,
его молярная теплоемкость
![]()
Для двух атомных молекул всего может
быть 3-поступательных, 2-вращательных,
1-колебательная степени свободы. По
расчетам для водорода (идеального газа)
теплоемкость не зависит от температуры
![]() .
.
Зависимость теплоемкости молекулярного
водорода от температуры, полученная в
ходе экспериментов, дается на графике
![]() .
.
Молекула водорода ведет себя при низкой температуре как точечная частица, у которой отсутствуют внутренние движения, при нормальной температуре – как жесткая гантель и наряду с поступательным движением также совершает вращательные движения, а при очень высокой температуре к этим движениям добавляются также колебательные движения атомов, входящих в молекулу. Объяснить эту зависимость классической теории не удалось.
Отличие экспериментальной кривой от теоретической прямой имеет квантовое объяснение. При низких температурах вращательные и колебательные степени свободы «выключены», т.е. они не возбуждаются. При температурах 116К могут возбуждаться вращательные степени свободы, а при температурах 4100К возбуждаются и колебательные степени свободы. Однако переход от одного режима движения к другому происходит не скачком при определенной температуре, а постепенно в некотором интервале температур. Это объясняется тем, что при определенной температуре возникает лишь возможность перехода молекул в другой режим движения, но эта возможность не реализуется сразу всеми молекулами, а лишь их частью.
