
- •Оглавление
- •Введение
- •Правила работы с тестами
- •Аминокислот, пептидов и белков». Занятие 1. Введение в практикум. Аминокислоты, пептиды.
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний:
- •1.1. … Является незаменимой аминокислотой для человека
- •1.2. Формула … соответствует глутаминовой кислоте в форме диполярного иона.
- •2.1. Из колонки 2 выберите боковые радикалы, соответствующие α-аминокислотам, указанным в колонке 1.
- •3.1. Какие из приведенных ниже высказываний согласуются с представлениями о строении и свойствах пептидной группы?
- •3.2. Выберите из приведенных ниже высказываний те, которые согласуются с представлениями о трансаминировании α аминокислот.
- •Работа 2. Нингидриновая реакция.
- •Работа 3. Реакция глицина с формальдегидом.
- •Работа 4. Реакция глицина с азотистой кислотой.
- •Работа 5. Амфотерные свойства α-аланина.
- •Работа 6. Биуретовая реакция.
- •Работа 7. Ксантопротеиновая реакция (Мульдера).
- •Работа 8. Реакция Фоля.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний Задание 1. Выберите наиболее правильный ответ.
- •1.1. …Придают белкам основный характер.
- •1.2. Атомы остова полипептидной цепи располагаются в следующем порядке:
- •2.2. Структура белка – стабилизирующие связи.
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Самостоятельная работа студентов
- •Работа 1. Количественное определение белка сыворотки крови биуретовым методом.
- •Техника выполнения работы
- •Фотоэлектроколориметр
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Занятие 3. Физико-химические свойства белков.
- •Методические указания к подготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Дан трипептид гли – ала – вал
- •1.2. В полипептидной цепи прерывает -спирализацию … .
- •2.2. Уровень организации белковой молекулы – ее структурный элемент.
- •3.1. Предложите наиболее оптимальный метод осаждения белка-фермента с целью дальнейшего использования его каталитической активности.
- •3.2. Выберите метод, которым можно очистить белки сыворотки крови от сернокислого аммония при разделении их высаливанием.
- •Ход работы
- •Работа 2. Осаждение белков при кипячении.
- •Ход работы
- •Работа 3. Осаждение белков солями тяжелых металлов.
- •Осаждение белков медным купоросом.
- •Осаждение белков уксуснокислым свинцом.
- •Работа 4. Осаждение белков органическими кислотами.
- •Ход работы
- •Задача 2.
- •Занятие 4. Методы выделения и очистки белков.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Молекулярная масса белков … .
- •2.2. Установите соответствие.
- •3.2. … Основаны на различии размера молекул.
- •Примеры ситуационных задач Задача 1.
- •Устройство прибора для электрофореза
- •Проведение электрофореза
- •Выключение прибора и выявление белковых фракций
- •Количественное определение белковых фракций
- •Денситометрический метод
- •Работа 2. Диск-электрофорез в полиакриламидном геле. Принцип метода
- •Ход работы
- •Работа 4. Очистка от низкомолекулярных примесей методом гельфильтрации на сефадексе (молселекте).
- •Ход работы
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Гемоглобин связывается с углекислым газом …..
- •1.2. … По структуре является гликопротеином.
- •3.1. Во многих гликопротеинах углеводный компонент присоединяется к белку посредством гликозидной связи через… .
- •3.2. Протеогликановые комплексы (мукополисахариды) характеризуются … .
- •Работа 2. Выделение муцина слюны и определение в нем углеводного компонента.
- •Ход работы
- •Работа 3. Выделение казеиногена из молока.
- •Ход работы
- •Занятие 6. Коллоквиум по модулю «Строение и функции белков.
- •Методические указания к самоподготовке
- •Контрольные вопросы по модулю «Строение и функции аминокислот, пептидов и белков».
- •Модуль 2. Ферменты Занятие 7. Классификация, структура и свойства ферментов.
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •3.1. Фермент от неорганического катализатора отличает ....
- •3.2. Для количественного определения глюкозы в сыворотке крови применяют ...
- •Порядок выполнения работы
- •Качественная реакция на крахмал
- •Реакция Фелинга
- •Работа 3. Термолабильность ферментов.
- •Порядок выполнения работы
- •Работа 4. Влияние рН среды на активность амилазы слюны.
- •Порядок выполнения работ
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.2. Молярная активность (число оборотов) ферментов выражается в...
- •Задача 1.
- •Задача 2.
- •Ход работы
- •Практическое значение работы
- •Работа 4. Определение активности щелочной фосфатазы в сыворотке крови по гидролизу n-нитрофенилфосфата.
- •Принцип метода
- •Ход работы
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •3.1. Вещества-антиметаболиты являются...
- •3.2. Иммобилизованные ферменты используются...
- •Примеры ситуационных задач Задача 1.
- •Работа 6. Конкурентное торможение сукцинатдегидрогеназной активности. Принцип метода
- •Ход работы
- •Иммуноферментный анализ.
- •1. Прямой ифа
- •Модуль 3. Биологические мембраны. Регуляторные молекулы. Занятие 11. Биологические мембраны. Особенности цитоплазматических мембран у бактерий ( семинар).
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Избирательная проницаемость мембран достигается путем активного транспорта. Активный транспорт отличается от пассивного тем, что… .
- •1.2. Маркером плазматической мембраны является фермент…
- •2.2. Липид – его характеристика
- •3.1. Из перечисленных ферментов антиоксидантной активностью обладают… .
- •3.2. Жирная кислота, в молекуле которой содержится 20 атомов углерода и 4 двойные связи -… .
- •Примеры ситуационных задач Задача 1.
- •Занятие 12. Регуляторные механизмы у эукариот и прокариот. Рецепторы (семинар).
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Занятие 13. Гормоны пептидной и белковой природы.
- •Методические указания к самоподготовке
- •Примеры ситуационных задач
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов к ситуационным задачам Задача 1.
- •Задача 2.
- •Занятие 14. Стероидные гормоны. Тканевые гормоны.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Примеры ситуационных задач.
- •Работа 2. Качественное определение 17-кетостероидов в моче.
- •Эталоны ответов к тестовым заданиям.
- •Эталоны ответов к ситуационным задачам Задача 1.
- •Задача 2.
- •Занятие 15. Коллоквиум по модулю «Биомембраны. Регуляторные молекулы».
- •Методические указания к самоподготовке
- •Контрольные вопросы к коллоквиуму:
- •Модуль 4. Энергетический обмен. Занятие 16. Введение в обмен веществ. Биохимия питания.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •3.1. Полноценные пищевые белки – это … .
- •3.2. Биологическая роль пектинов ...
- •Работа 4. Количественный анализ желудочного сока.
- •Техника выполнения работы
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи Задача 1.
- •100 Г белка – 16 г n
- •80 Г белка – х
- •Задача 2.
- •3500 Ккал – 100%
- •Занятие 17. Витамины и факторы роста бактерий. Биологическая роль в метаболизме.
- •Методические указания к самоподготовке
- •1.1. По химической природе витамины – это...
- •1.2. Витамин е является …
- •2.1. Витамин – химическая структура.
- •2.2. Сопоставьте химическое название витамина и название по проявлению недостаточности
- •3.1. Активирование витамина д заключается ...
- •3.2. Утверждения относительно витамина а являются верными:
- •Примеры ситуационных задач
- •Оформление работы
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Занятие 18. Введение в биоэнергетику. Макроэргические соединения. Общие пути катаболизма.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний Задание 1. Выберите один наиболее правильный ответ:
- •Примеры ситуационных задач Задача 1.
- •Принцип метода
- •Ход работы
- •Работа 2. Качественное определение активности сукцинатдегидрогеназы мышц.
- •Ход работы
- •Расчеты
- •Практическое значение работы
- •Работа 4. Восстановление цитохрома с.
- •Ход работы
- •Работа 5. Обнаружение активности цитохромоксидазы.
- •Задача 2.
- •Занятие 19. Тканевое дыхание и окислительное фосфорилирование (семинар).
- •Методические указания к самоподготовке
- •Примеры тестовых заданий Задание 1. Выберите один наиболее верный ответ:
- •1.1. Бурая жировая ткань ...
- •Задание 2. Установите соответствие.
- •2.1. Дайте определение перечисленным типам окисления:
- •3.2. Соединения, обладающие разобщающим действием: ...
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Занятие 20. Образование энергии в фотосинтезирующих организмах (семинар).
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •1.1. В состав фотосистемы I входят все компоненты, кроме:
- •1.2. Реакции световой фазы фотосинтеза протекают в:
- •2.1. Установите принадлежность кофакторов фотосинтеза:
- •2.2. Установите соответствие:
- •3.1. Переносчиками электронов в фс1 при нециклическом транспорте являются:
- •3.2. Процесс, который не относится к реакции световой фазы:
- •4.1. Компонентов акцепторной системы реакционного центра фс1:
- •4.2. Циклического потока электронов в фс1:
- •Примеры ситуационных задач Задача 1
- •Задача 2
- •Занятие 21. Коллоквиум по модулю «Энергетический обмен».
- •Контрольные вопросы к коллоквиуму:
- •Модуль 5. Обмен углеводов. Занятие 22. Структура и свойства моносахаридов, дисахаридов и полисахаридов.
- •Методические указания к самоподготовке
- •Примеры тестов для контроля исходного уровня знаний
- •Примеры вопросов контрольной работы:
- •Работа 3. Реакция Фелинга.
- •Работа 4. Взаимодействие моносахаридов с аммиачным раствором оксида серебра (проба Толленса).
- •Работа 5. Реакция Селиванова на фруктозу.
- •Работа 8. Отсутствие восстанавливающей способности у сахарозы.
- •Работа 9. Реакция Барфеда.
- •Работа 10. Качественная реакция на крахмал.
- •Работа 11. Кислотный гидролиз крахмала.
- •Эталоны ответов на тесты
- •Эталоны ответов на контрольные упражнения
- •Занятие 23. Пути поступления и расходования углеводов в организме. Метаболизм гликогена.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Все известные амилазы желудочно-кишечного тракта осуществляют расщепление:
- •1.2. Переносчиком гликозильных групп в реакции биосинтеза гликогена является ...
- •3.1. Уровень глюкозы в крови повышают ...
- •3.2. Моносахариды в кишечнике всасываются ...
- •Примеры ситуационных задач Задача 1.
- •Самостоятельная работа студентов
- •Глюкозооксидазным методом. Принцип метода
- •Ход определения
- •Эталоны ответов к тестам
- •Эталоны ответов к ситуационным задачам Задача 1.
- •Задача 2.
- •Занятие 24. Катаболизм глюкозы. Анаэробный и аэробный гликолиз. Спиртовое и молочнокислое брожение.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний:
- •1.1. При окислительном декарбоксилировании пирувата в аэробных условиях образуется ... .
- •3.1. В процессе гликолиза необратимыми являются реакции образования:
- •3.2. При распаде углеводов у микроорганизмов обнаруживают ....
- •Порядок выполнения работы
- •Работа 2. Открытие продуктов дрожжевого сбраживания глюкозы.
- •Порядок выполнения работы
- •Ход определения
- •Работа 4. Обнаружение продуктов спиртового брожения. Ход работы
- •Эталоны ответов на тестовые задания
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Занятие 25. Глюконеогенез. Пентозофосфатный путь превращения глюкозы. Путь Энтнера-Дудорова у бактерий. Регуляция обмена углеводов (семинар).
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Энергетические расходы в глюконеогенезе на одну молекулу глюкозы из двух молекул пировиноградной кислоты составляют ... Атф.
- •1.2. Пентозофосфатный путь окисления глюкозы ....
- •3.1. Общими метаболитами для пентозного цикла и гликолиза являются...
- •3.2. Установите правильную последовательность процесса глюконеогенеза из липидов:
- •Задача 2.
- •Занятие 26. Коллоквиум по модулю «Обмен углеводов».
- •Контрольные вопросы к коллоквиуму
- •Модуль 6. Структура, функции и обмен липидов. Занятие 27. Структура и свойства липидов.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Из приведенных высказываний относительно ненасыщенных жирных кислот, входящих в состав липидов, является верным…
- •1.2. Из приведенных высказываний относительно свойств липидов, является верным…
- •2.2. Жирная кислота-количество углеродных атомов в цепи:
- •3.1. … Образуются при омылении фосфолипидов .
- •3.2. …Встречаются в составе ганглиозидов.
- •Занятие 28. Переваривание и всасывание липидов. Обмен нейтрального жира.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Ферменты, участвующие в расщеплении жиров в желудочно-кишечном тракте относятся к классу….
- •1.2. Высшие жирные кислоты образуются из всех перечисленных соединений, кроме….
- •3.1. Особенно высокая активность фермента глицеролкиназа обнаруживается в….
- •3.2. Переваривание и всасывание липидов нарушается при дефиците ….
- •Работа 3. Количественное определение суммарных липидов в сыворотке крови. Принцип метода
- •Ход работы
- •Занятие 29. Обмен жирных кислот, окисление и синтез. Синтез кетоновых тел.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Окисление жирных кислот является источником энергии во всех тканях, кроме…
- •1.2. Транспорт жирной кислоты из цитозоля в митохондрии осуществляется с помощью… .
- •3.1. При бета-окислении жирных кислот с нечетным количеством углеродных атомов образуются… .
- •3.2. Катаболизм жирных кислот до со2 и н2о включает следующие стадии…. .
- •Ход работы
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов к ситуационным задачам Задача 1.
- •Занятие 30. Обмен стероидов. Метаболизм холестерина. Обмен фосфолипидов.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Донором метильных групп для синтеза фосфатидилхолина из фосфатидилэтаноламина является… .
- •1.2. Фосфатидная кислота образуется в результате… .
- •3.1. Биохимические функции лхат:
- •3.2. Липотропными факторами являются… .
- •Эталоны ответов к тестовым заданиям.
- •Эталоны ответов к ситуационным задачам. Задача 1.
- •Задача 2.
- •Занятие 31. Коллоквиум по модулю « Структура и функциии липидов».
- •Методические указания к самоподготовке
- •Контрольные вопросы
- •Модуль 7. Обмен аминокислот, белков и нуклеопротеинов. Занятие 32. Переваривание и всасывание белков. Протеолитические ферменты.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Работа 2. Определение активности пепсина и уропепсина. Принцип метода
- •Ход определения активности уропепсина
- •Принцип метода
- •Ход определения
- •Эталоны ответов на тестовые задания
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Занятие 33. Общие пути метаболизма аминокислот: переаминирование, дезаминирование, декарбоксилирование.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. В состав коферментов аминотрансфераз входит витамин....
- •1.2. Серотонин синтезируется из....
- •3.1. …. Являются производными этого соединения:
- •3.2. Функции гистамина:....
- •Принцип метода
- •Ход работы
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Занятие 34. Конечные продукты азотистого обмена.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний Задание 1. Выберите один наиболее верный ответ.
- •1.1. Предшественник мочевины в орнитиновом цикле … .
- •2.2. В ходе орнитинового цикла последовательно образуются … .
- •5. Орнитин, карбамоилфосфат, аргининосукцинат, аргинин, цитруллин
- •2.1. Реакция – фермент
- •2.2. При катаболизме указанных аминокислот образуются....
- •3.1. Источниками аммиака в организме являются ... .
- •3.2. В синтезе мочевины участвуют следующие ферменты ... .
- •Работа 2. Определение содержания мочевины в сыворотке крови ферментативным методом. Принцип метода
- •Эталоны ответов на тесты
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Занятие 35. Специфические пути метаболизма отдельных аминокислот.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Заболевание (синдром), при котором наблюдается моча черного цвета – ... .
- •1.2. В данной реакции образуется ....
- •3.1. При развитии фенилкетонурии в крови и моче накапливаются ... .
- •3.2. Метиленовая группа в молекуле метилен-н4-фолата может превращаться в ... .
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Самостоятельная работа студентов
- •Занятие 36. Метаболизм нуклеопротеинов и нуклеотидов.
- •Методические указания к самоподготовке
- •Примеры тестового контроля
- •1.1. Нуклеотиды расщепляются ферментами:
- •1.2. В биосинтезе пиримидиновых нуклеотидов используется фермент ... .
- •2.2. Выберите соединения, являющиеся донорами азота в синтезе пуриновых и пиримидиновых нуклеотидов:
- •3.1. Ксантиноксидаза катализирует реакции:
- •3.2. Выберите из перечисленных условий возможные причины подагры:
- •Работа 2. Определение содержания мочевой кислоты в сыворотке крови фосфорновольфрамовым методом. Принцип метода
- •Ход определения
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Нуклеотиды соединяются между собой ... .
- •1.2. Синтез рнк-затравки катализирует фермент ... .
- •3.1. Компоненты и факторы необходимые для биосинтеза рнк ...
- •3.2. Закономерности, раскрывающие вторичную структуру днк – правила американского биохимика Чаргаффа ... .
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Самостоятельная работа студентов
- •Работа 1. Метод выделения плазмидной днк из дрожжей для последующего введения в клетки e.Coli.
- •Ход работы
- •Секвенирование - исследование последовательности нуклеотидов днк.
- •Полимеразная цепная реакция.
- •Клонирование - способ получения больших количеств идентичных молекул нуклеиновых кислот или их фрагментов
- •Занятие 38. Биосинтез белка и его регуляция. Особенности биосинтеза у микроорганизмов (семинар).
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Энхансеры представляют собой участки днк размером 10-20 пар оснований, присоединение к которым регуляторных белков ... .
- •1.2. Реакцию
- •Катализирует фермент ...
- •2.2. Оператор – это участок молекулы прокариотической днк, отвечающий в транскрипции за:
- •3.1. … Используются в ходе трансляции как макроэрги
- •3.2. К посттрансляционной модификации белков не относится ...
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Эталоны ответов на тесты контроля исходого уровня знаний
- •Эталоны ответов к ситуационным задачам
- •Задача 2.
- •Занятие 39. Молекулярные механизмы генетической изменчивости. Мутации (семинар).
- •Методические указания к самоподготовке
- •13. Перечислите формы переноса генетического материала у бактерий.
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Для проведения генно-инженерных процедур необходимо ... .
- •1.2. Частота мутаций на одну гамету за поколение составляет ... .
- •3.1. Для трансформации чаще всего используют:
- •3.2. Внедрение генов в компетентные клетки осуществляется при помощи:
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Эталоны ответов на тесты контроля исходого уровня знаний
- •Эталоны ответов к ситуационным задачам Задача 1.
- •Задача 2.
- •Занятие 40. Коллоквиум по модулю «Обмен аминокислот, белков и нуклеопротеинов».
- •Методические указания к самоподготовке
- •Контрольные вопросы к коллоквиуму
- •Модуль 8. Функциональная биохимия специализированных тканей и органов. Занятие 41. Водно-солевой обмен и его регуляция.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний.
- •1.1. Влияние кальцитонина на минеральный обмен характеризуется…
- •1.2. Микроэлементами в организме человека являются… .
- •3.1. В регуляции водно-натриевого гомеостаза участвуют…
- •3.2. Стимулом для увеличения секреции ренина является…
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Самостоятельная работа студентов
- •Принцип метода
- •Ход работы
- •Эталоны ответов к тестовым заданиям.
- •Эталоны ответов к ситуационным задачам Задача 1.
- •Задача 2.
- •Занятие 42. Взаимосвязь обмена веществ и его регуляция.
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний.
- •1.1. Повышение концентрации глюкозы при пищеварении стимулирует…
- •1.2. Универсальным энергетическим субстратом для всех тканей является….
- •3.1. Обмен углеводов, липидов и аминокислот главным образом регулируют …
- •3.2. Уровень глюкозы крови контролируют гормоны поджелудочной железы… .
- •Техника определения
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи Задача 1
- •Задача 2.
- •Занятие 43. Механизмы обезвреживания токсических веществ.
- •Методические указания для самоподготовки
- •Примеры тестов контроля исходного уровня знаний.
- •1.1. В реакциях микросомального окисления участвует цитохром…
- •1.2. Сульфаниламидные препараты, инактивируются в результате реакции… .
- •2.1.Основными поставщиками протонов и электронов в реакции микросомального окисления являются:
- •3.1. В реакциях инактивации активных форм кислорода участвуют…
- •3.2. Для выяснения антитоксической функции печени применяют… .
- •Примеры ситуационных задач
- •Ход определения
- •Работа 3. Проба Квика-Пытеля. Принцип метода
- •Задача 2.
- •Занятие 44. Перекисное окисление липидов. Активные формы кислорода. Механизмы антиокислительной защиты.
- •Методические указания для самоподготовки
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Супероксидрадикал генерируют все ферменты, кроме….
- •1.2. … Образуется при взаимодействии перекиси водорода с супероксидрадикалом.
- •3.1. Основные свойства радикалов кислорода...
- •3.2. Продуцируют природные радикалы кислорода… .
- •Эталоны ответов на ситуационные задачи Задача 1 .
- •Занятие 45. Биохимия крови
- •Методические указания для самоподготовки
- •Примеры тестов контроля исходного уровня знаний
- •3.1 К возникновению железодефицитных анемий чаще всего приводят…
- •3.2. Белки плазмы крови выполняют следующие функции…
- •Работа 2. Определение активности альфа-амилазы в сыворотке крови амилокластическим методом. Принцип метода
- •Ход работы
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Задача 2.
- •Занятие 46. Биохимия печени.
- •Методические указания для самоподготовки
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Содержание в крови прямого билирубина и активность алт возрастает при….
- •1.2. Утверждение, относящееся к синтезу гема …
- •2.1. Гем распадается с образованием железа и желчных пигментов. Какова дальнейшая судьба этих соединений?
- •3.1. В основе детоксикации ядовитых веществ в печени лежат процессы…
- •3.2. Процессы… … происходят только в печени.
- •Примеры ситуационных задач Задача 1.
- •Задача 2.
- •Самостоятельная работа студентов.
- •Работа 1. Пробы на коллоидоустойчивость.
- •Ход работы
- •Работа 2. Количественное определение активности альдолазы в сыворотке крови (метод Брунса в модификации е.Н. Валуйской и в.И. Товарницкого).
- •Принцип метода
- •Ход работы
- •Работа 3. Определение активности альдолазы фруктозо-1-монофосфата.
- •Принцип метода
- •Ход работы
- •Работа 4. Количественное определение билирубина в сыворотке крови по методу Иендрашека. Принцип метода
- •Ход работы
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи Задача 1.
- •Задача 2.
- •Занятие 47. Система гемостаза
- •Методические указания для самоподготовки
- •Примеры тестов контроля исходного уровня знаний
- •Работа 2. Определение времени рекальцификации плазмы.
- •Ход работы
- •Эталоны ответов к тестовым заданиям
- •Эталоны тветов на ситуационные задачи
- •Задача 2.
- •Занятие 48. Основы иммунохимии (семинар).
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •Эталоны тветов на ситуационные задачи
- •Занятие 49. Биохимия специализированных тканей и органов.
- •Методические указания для самоподготовки
- •Примеры тестов контроля исходного уровня знаний
- •1.1. Способностью связывать кальций обладает белок… .
- •1.2. … Процессы, обеспечивающие энергией интенсивно работающую мышцу.
- •3.1. Гидроксилирование аминокислот … … в коллагене нарушается при авитаминозе витамина «с».
- •3.2. Среди свободных аминокислот мозга преобладает… .
- •Работа 2. Количественное определение свободного оксипролина в моче.
- •Ход работы
- •Работа 3. Определение холинэстеразы в головном мозге.
- •Работа 4. Выделение гликогена из мышечной ткани.
- •Ход работы
- •Эталоны ответов к тестовым заданиям
- •Эталоны ответов на ситуационные задачи
- •Методические указания к самоподготовке
- •Примеры тестов контроля исходного уровня знаний
- •2.1. Установите соответствие цифровых и буквенных положений.
- •Эталоны ответов на ситуационные задачи
- •Приложения
- •Рекомендуемая литература
- •Журналы по биохимии (библиотека бгму)
- •Некоторые биохимические показатели жидких сред организма
- •Экзаменационные вопросы
Работа 6. Конкурентное торможение сукцинатдегидрогеназной активности. Принцип метода
Основан на изменение окраски метиленовой сини при восстановлении его в ходе дегидрогеназной активности. При дегидрировании янтарной кислоты сукцинатдегидрогеназой акцептором водорода является метиленовая синь, которая при восстановлении обесцвечивается. Чем быстрее обесцвечивается метиленовая синь, тем выше активность сукцинатдегидрогеназы. Ингибирование фермента замедляет скорость обесцвечивания метиленовой сини.
Ход работы
В три пронумерованные пробирки поместить 3-4 капли мышечной кашицы и добавить: в первую – 0,8 мл воды, во вторую – 0,2 мл 1% раствора малоновой кислоты и 0,6 мл воды, в третью – 0,8 мл 1% раствора малоновой кислоты. Во все три пробирки добавляют по 1 мл 1% раствора янтарной кислоты и по 1 капле 1% раствора метиленовой сини. После перемешивания добавляют по 3 капли вазелинового масла. Пробирки ставят в водяную баню, нагретую до 370С. Через 5 мин наблюдают изменение окраски раствора. Сравнить степень уменьшения голубого окрашивания в 3-х пробирках и сделать вывод о механизме действия малоновой кислоты на активность сукцинатдегидрогеназы.
Иммуноферментный анализ.
Иммуноферментный анализ (ИФА, англ. enzyme-linked immunosorbent assay, ELISA) – лабораторный иммунологический метод качественного определения и количественного измерения антигенов и антител.
В основе метода ИФА лежит принцип специфического взаимодействия между антигеном и соответствующим ему антителом. Выявление образовавшегося комплекса проводят с использованием так называемого конъюгата, который представляет собой анти-антитело, соединённое с ферментной меткой (обычно используют пероксидазу хрена либо другие пероксидазы).
Конъюгат может быть получен с использованием поликлональных антивидовых антител (например, кроличьи антитела против иммуноглобулинов человека) или моноклональных антител, направленных против человеческих иммуноглобулинов определённого класса (M, G, А).
В зависимости от того, какие антитела использованы, тест-система будет выявлять в исследуемом образце или специфические антитела независимо от их класса, или антитела лишь определённого класса (например, только иммуноглобулин G или только иммуноглобулин M).
Для проведения анализа используют различные схемы ИФА:
1 – прямой; 2 – конкурентный; 3 – «сэндвич».
1. Прямой ифа
1 – вносят антиген в 0,05 М натрий-бикарбонатном буферном растворе (рН 9,2) на полистироловый 96-ти луночный планшет (по 50 мкл в лунку), в концентрации 10 мкг/мл;
2 – вносят 1%-ный раствор бычьего сывороточного альбумина (BSA 10) по 100 мкл в лунку;
3 – вносят исследуемые антитела в буферный раствор с добавлением 0,05%-ного твина (PBSТ) по 50 мкл в лунку;
4 – вносят конъюгат кроличьих антител против IgG мыши конъюгированных с пероксидазой хрена (ПХ) по 50 мкл в лунку в буферном растворе PBSТ (рабочее разведение 1 : 1000);
5 – вносят субстрат: раствор ортофенилендиамина (ОФД) – 5 мг на 10 мл 0,05 М цитратного буфера, рН 4,5, с добавлением 5 мкл 30% перекиси водорода, по 100 мкл в лунку;
6 – через 5-30 минут инкубации (после развития желто-коричневой окраски) для остановки реакции вносят 5% серную кислоту по 50 мкл в каждую лунку.
После каждого этапа (за исключением 5) планшеты с соответствующими растворами инкубируют при 37oС в течение 1 часа. После 2, 3 и 4 этапов планшеты отмывают 6-10 раз холодной водой и трижды раствором PBSТ.
Результаты учитывают на спектрофотометре “Multiskan” при длине волны 492 нм, оптическом пути 3 мм (соответствует 100 мкл раствора в лунке 96-ти луночного планшета).
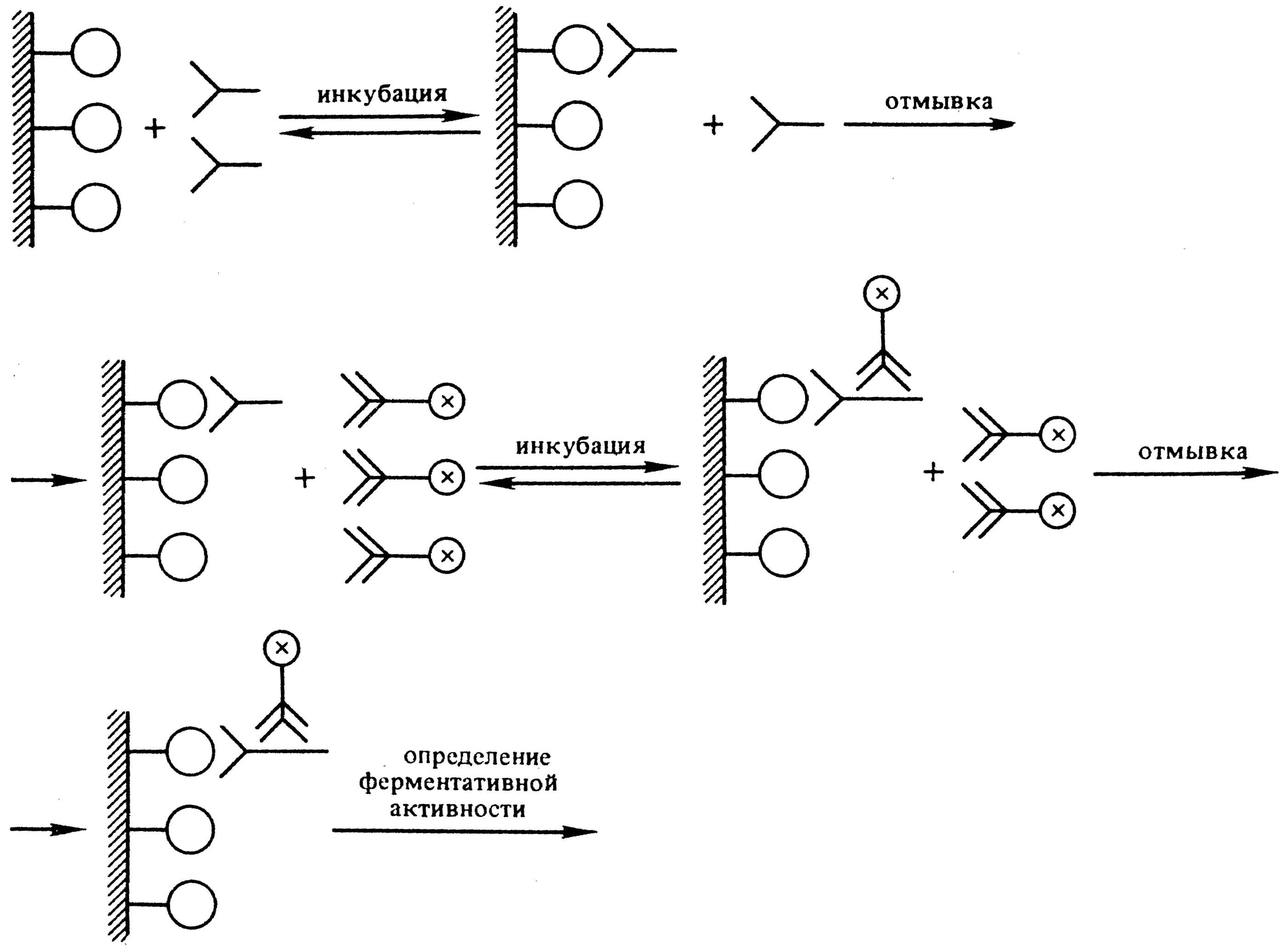
2. Конкурентный ИФА
В конкурентном ИФА на 3 этапе вместе с конъюгированными с ПХ антителами, вносят исследуемый антиген.
Остальные этапы проводят аналогично – как в непрямом ИФА.

3. «Сэндвич» ИФА

В "сэндвич" ИФА на первом этапе вносят раствор антитела, на третьем этапе – растворы антигенов, на четвертом – конъюгат поликлональных кроличьих антител с ПХ.
Остальные этапы проводят аналогично – как в непрямом ИФА.
Во всех схемах используются следующие условные обозначения:

Эталоны ответов к тестовым заданиям
1.1. – 3
1.2. – 3
2.1. – 1-В; 2-А; 3-Б; 4-Г
2.2. – 1-А; 2-В; 3-Б; 4-Г; 5-Д
3.1. – 2,4
3.2. – 1,2,3
4.1. – Д (- + -)
4.2. – С (+ - -)
Эталоны ответов на ситуационные задачи
Задача 1.

График Лайнуивера-Берка – график двойных
обратных величин (![]() против
против
![]() ).
).
Отрезок на горизонтальной оси = -1/Кm
Отрезок на вертикальной оси = 1/Vmax
Тип ингибирования неконкурентный, т.к. в присутствии ингибитора Кm (т.е. сродство фермента к субстрату ) не изменилась.
Задача 2.

Отрезок на оси абсцисс = Кm (график Михаэлиса-Ментен) или-1/Кm (график Лайнуивера-Берка). Отрезок на оси ординат = Vmax или 1/Vmax соответственно.
В присутствии ингибитора Кm увеличилась (т.е. сродство фермента к субстрату снизилось), а Vmax не изменилась. Следовательно, тип ингибирования конкурентный.
Занятие 10. Коллоквиум по модулю «Ферменты».
Цель занятия. Проверить усвоение студентами учебного материала модуля «Ферменты».
Содержание занятия:
– оценка знания усвоения учебного материала данного модуля каждым студентом с использованием тестового компютерного контроля;
– индивидуальное собеседование преподавателя с каждым студентом по вопросам к коллоквиуму.
Контрольные вопросы к коллоквиуму
Что такое фермент? История развития учения о ферментах.
Номенклатура и классификация ферментов. Цифровой шифр ферментов. Характеристика отдельных классов и подклассов ферментов. Примеры реакций.
Сходства и отличия ферментов и неорганических катализаторов.
Общие свойства ферментов. Какие опыты позволяют их обнаружить?
Химическая природа ферментов. Простые и сложные ферменты. Что такое кофермент, апофермент, холофермент?
Коферменты и их химическая природа. В чем заключается связь между витаминами и ферментами?
Активный центр фермента: особенности его строения и роль.
Зависимость скорости ферментативной реакции от температуры и рН, графическое изображение зависимости.
Специфичность действия ферментов. Виды специфичности. Основные теории специфичности.
Константа Михаэлиса, ее вывод и физический смысл.
Зависимость ферментативной реакции от концентрации субстрата. Уравнение Михаэлиса-Ментен. График зависимости. Анализ уравнения Михаэлиса-Ментена (различные соотношения S и Км). Уравнение Лайнуивера-Берка, его графическое выражение.
Зависимость скорости ферментативной реакции от концентрации фермента. График зависимости.
Активаторы ферментов, типы их действия.
Виды ингибиторования ферментов: специфическое и неспецифическое, обратимое и необратимое, конкурентное и неконкурентное. Примеры.
Опыт, иллюстрирующий конкурентное ингибирование сукцинатдегидрогеназы.
Механизм действия ферментов с точки зрения изменения энергетики. Влияние ферментов на энергию активации реакции.
Механизм действия ферментов с точки зрения событий в активном центре на примере ацетилхолинэстеразы.
Единицы выражения активности ферментов.
Изоферменты. Значение определения изоферментов в медицинской практике. Изоферменты лактатдегидрогеназы.
Понятие о мультиферментных комплексах.
Что лежит в основе количественного определения ферментов? Принцип методов количественного определения амилазы и фосфатазы.
Медицинская энзимология.
Понятие и примеры энзимопатий.
Иммобилизованные ферменты (ИФ). Понятие об инженерной энзимологии. Применение ИФ в промышленности.
Методы иммуноферментного анализа.
