
- •3.4. Смачивание жидкостью твердой поверхности. Краевой угол смачивания
- •3.5. Капиллярная конденсация
- •Получаем
- •2. Адгезия между жидкостью и твердым телом. Адгезия хорошая, если жидкость смачивает твердую поверхность. На поверхности твердого тела 3 находится капля жидкости 1 в среде 2 (см. Рис. 3.13).
- •Уравнение Дюпре – Юнга.
- •3. Адгезия между твердыми телами. Для достижения максимальной адгезии процесс соединения следует проводить при температурах, близких к температуре плавления одного из составляющих.
3.5. Капиллярная конденсация
В различных процессах, связанных со смачиванием, важную роль играет капиллярное давление, которое возникает из-за искривления поверхности жидкости.
Между искривленной и плоской поверхностью раздела существует разность давлений, которая называется капиллярным давлением. Для пояснения физического смысла капиллярных явлений проведем качественное их рассмотрение на примере мыльного пузыря. Если в процессе выдувания пузыря открыть конец трубочки, то пузырь, находящийся на другом конце, начнет уменьшаться в размерах и втянется в трубку. Поскольку в этом обратном процессе воздух внутри пузыря сообщается с атмосферой, то для поддержания равновесного состояния давление изнутри должно быть больше внешнего.
Если в данном опыте соединить трубку с манометром, то он зарегистрирует избыточное давление в объемной фазе газа с вогнутой стороны поверхности пузыря. Найдем количественную зависимость между ним и кривизной поверхности. Воспользуемся для этого термодинамическим выражением для изменения энергии Гельмгольца, полученным ранее.
![]()
![]()
Рассмотрим две контактирующие фазы и , разделенные искривленной поверхностью. В состоянии равновесия возможны вариации площади поверхности ds и объема dV без изменения числа молей dn в системе. Таким образом, в нашем случае dn = 0 и dT = 0.
В соответствии с последним уравнением для рассматриваемой системы можно записать
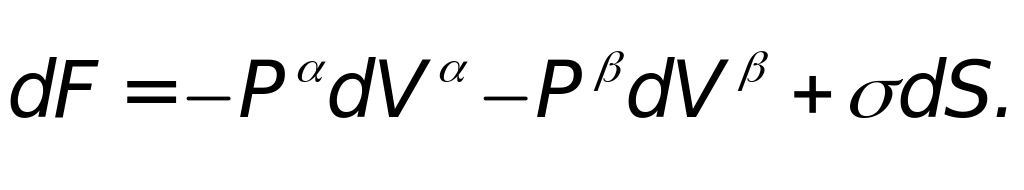
![]()
Исходя из равенства:
Получаем
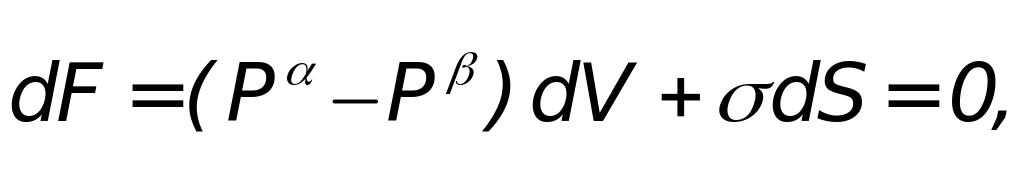
где dF = 0, так как система находится в равновесии.
Отсюда находим
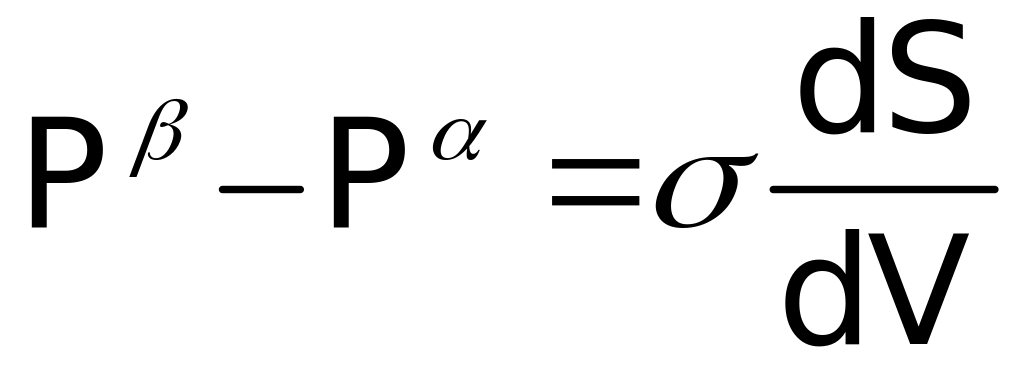
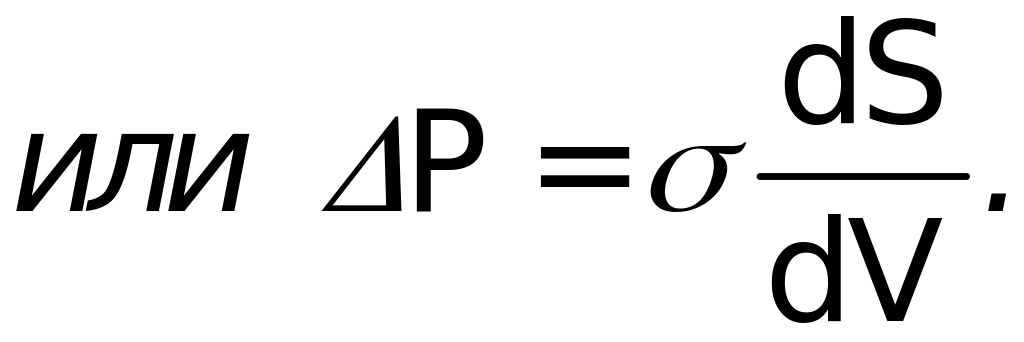
Предположим, что поверхность имеет сферическую форму. Тогда
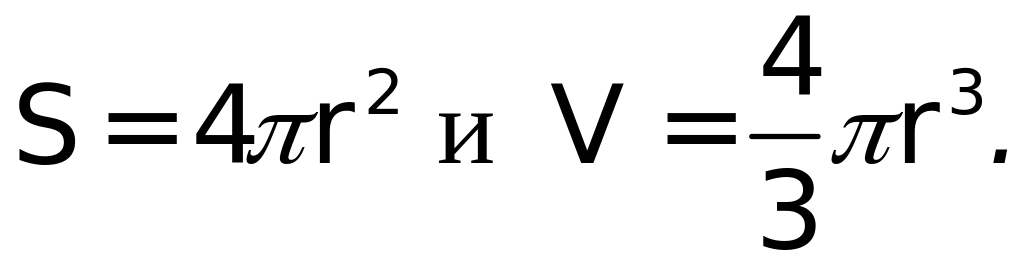
С учетом этого получаем уравнение Лапласа:
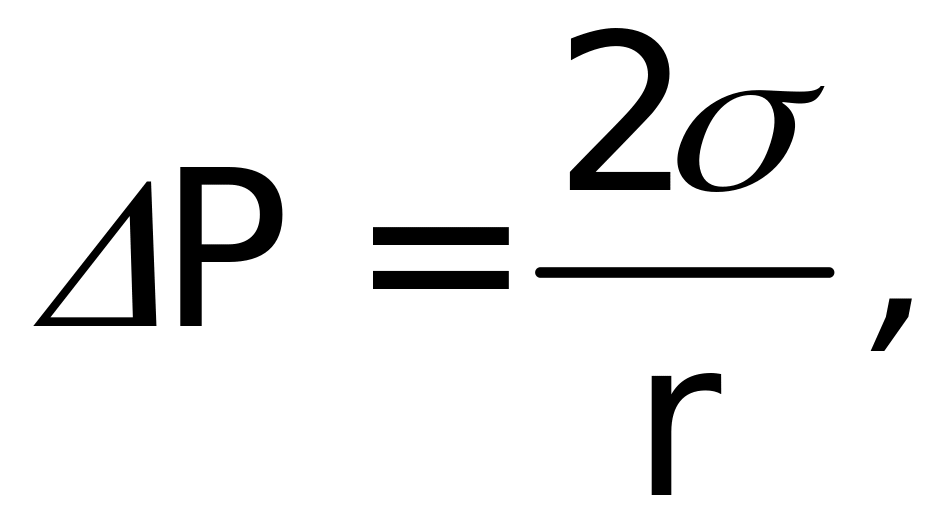
Искривление поверхности характеризуют радиусом кривизны r, направленным внутрь жидкости при выпуклой поверхности и наружу при вогнутой поверхности. В общем случае, для несферических поверхностей, уравнение Лапласа имеет следующий вид:
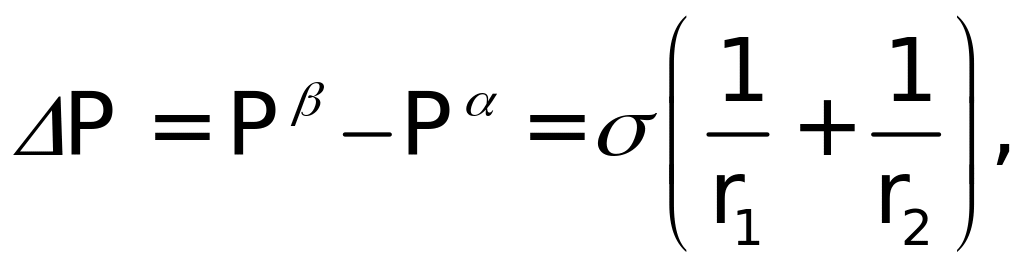
где r1, r2 – главные радиусы кривизны; Р называют капиллярным давлением.
При опускании тонкого стеклянного капилляра в воду (рис. 3.14, а) краевой угол смачивания близок к нулю и мениск вогнутый. Давление р при этом ниже, чем давление при плоской поверхности. В результате мениск поднимается на высоту h, при которой вес поднятого столба жидкости уравновешивает разность давлений между обеими поверхностями. При погружении капилляра в несмачиваемую жидкость, напротив, происходит опускание уровня жидкости в капилляре (рис. 3.14, б).
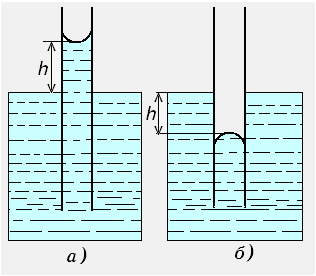
Рис. 3.14. Капиллярное поднятие (а) и опускание (б) жидкости
Изменение давления пара над искривленной поверхностью по сравнению с плоской определяется уравнением Кельвина–Томсона. Оно получается из условия равенства химических потенциалов в смежных фазах, находящихся в состоянии термодинамического равновесия.
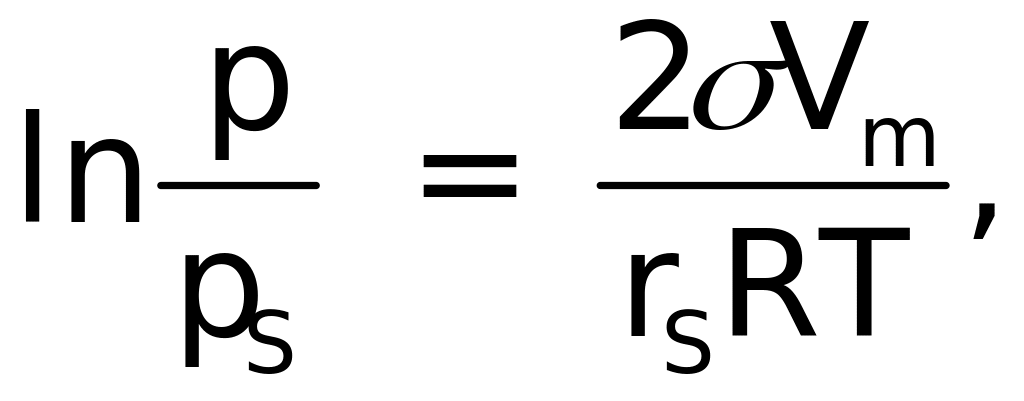
где – поверхностное натяжение конденсированной жидкости; р, рs – давления насыщенного пара над сферическими каплями жидкости и плоской поверхностью; Vm – молярный объем; rs – радиус средней кривизны поверхности раздела фаз.
В соответствии с данным уравнением, давление насыщенного пара вблизи искривленной и плоской поверхностями не одинаково. В уравнение входят кривизна поверхности (1/r) и поверхностное натяжение . Видно, что, чем больше кривизна, тем больше относительная разница давлений пара. Она возрастает также при увеличении поверхностного натяжения . Известно, что выпуклая поверхность имеет положительную кривизну (знак “+”), вогнутая – отрицательную (знак “–”). Поэтому, исходя из уравнения, можно заключить, что над выпуклой поверхностью давление пара больше, чем над плоской; над вогнутой же – меньше. Следствием этого является то, что в тонкодисперсных адсорбентах капиллярного типа конденсация паров влаги протекает значительно раньше, чем на плоской поверхности.
В результате на плоских поверхностях конденсация начинается при давлении насыщения рнас, а в узких капиллярах тонкопористых адсорбентов давление насыщенного пара будет ниже, чем над плоской поверхностью и пар в капилляре, не достигнув давления насыщения, уже пересыщен и конденсируется при рs < рнас. Этот процесс называется капиллярной конденсацией. При наличии капиллярной конденсации изотерма адсорбции при давлении насыщенного пара круто поднимается вверх (рис. 3.15).
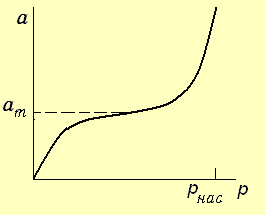
Рис. 3.15. Изотерма адсорбции при капиллярной конденсации
Положение кривой зависит от характера пор адсорбента. Любая капиллярная конденсация начинается с адсорбции и идет по законам адсорбции, а заканчивается процессами конденсации. Капиллярная конденсация наблюдается только на вогнутых поверхностях, если адсорбат смачивает стенки капилляра адсорбента. Чем больше кривизна поверхности, тем меньше давление конденсации.
3.6. Когезия. Адгезия. Работа адгезии. Уравнение Дюпре–Юнга
Если соприкасаются две поверхности твердого тела, т.е. судить о смачивании невозможно, то вводится аналогичное смачиванию понятие адгезии как явления и меры взаимодействия двух поверхностей твердых тел.
В гетерогенных системах различают два вида межмолекулярных сил взаимодействия:
1) притяжение между атомами и молекулами внутри фазы;
2) взаимодействие между молекулами различных фаз.
Если имеется система, состоящая из молекул однородной жидкости (например, вода), то для создания новых поверхностей раздела (например, вода – воздух) потребуется затрата работы. Эта работа, затраченная на преодоление сил сцепления между молекулами однородной жидкости, называется работой когезии. Когезия описывается силами взаимодействия одноименных частиц. Когезию характеризуют такие параметры как энергия кристаллической решетки, энергия парообразования, температура кипения, равновесное давление пара.
Межфазное взаимодействие или взаимодействие между приведенными в контакт поверхностями конденсированных фаз разной природы называется прилипанием или адгезией.
|
Если имеются две взаимно нерастворимые жидкости, либо жидкость и твердое тело, или два твердых тела, приведенных в тесный контакт друг с другом, то для создания новой поверхности раздела (их разделения) нужно затратить работу на преодоление сил сцепления между разными молекулами. Такая работа называется работой адгезии.
Работа адгезии WА равна работе обратимого разрыва адгезионной связи, отнесенной к единице площади.
Работа адгезии WА измеряется в единицах [Дж/м2].
|
Полная работа адгезии по поверхности
WS = WА·S.
Процесс образования адгезионной связи делится на 2 стадии:
1) транспортная стадия – перемещение молекул адгезива к поверхности тела, на которую он наносится. Первая стадия зависит от фазовых процессов, которые проходят при этом и от состояния поверхности и способа ее обработки.
2) ориентирование молекул в межфазном адгезионном слое, стадия непосредственного взаимодействия адгезива и поверхности твердого тела. Это взаимодействие может определяться различными силами от сил Ван-дер-Ваальса (от 100 до 1 нм) до химических сил ковалентной связи (менее 0,5 нм).
Различают три случая адгезии.
1. Адгезия между двумя жидкостями, не смешивающимися друг с другом. Состояние поверхности каждой фазы характеризуется величиной поверхностного натяжения.
Для иллюстрации понятия адгезии служит рис. 3.16. Предположим, что цилиндр содержит две жидкости 1 и 3 (ССl4 и Н2О). Осуществим разрез по стрелке так, чтобы разрезающая плоскость проходила через имеющуюся поверхность раздела между несмешивающимися жидкостями. 1,3 исчезнет при мысленном разделении жидкостей 1 и 3 в среде 2.
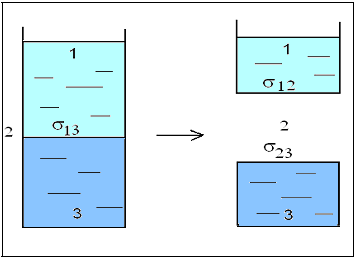
Рис. 3.16. Схема, иллюстрирующая понятие адгезии
Для определения Wа сравниваются силы поверхностного натяжения. Работа адгезии, т.е. работа, которая нужна для разделения единицы поверхности одной жидкости от другой, определяется по уравнению Дюпре:
WА = – G = Gкон – Gнач = 1,2 + 2,3 – 1,3.
Процесс самопроизвольный, должен идти в сторону уменьшения поверхностной энергии.
Уравнение Дюпре отражает закон сохранения энергии при адгезии. Из уравнения следует, что работа адгезии тем больше, чем больше поверхностное натяжение исходных компонентов, и чем меньше конечное межфазное натяжение.
На основании схемы рис.3.16. для однородной жидкости (например, воды) могут образоваться две поверхности раздела вода – воздух. Тогда можно определить работу когезии:
WК = 21,2 ,
где 1,2 – поверхностное натяжение на границе воздух – вода.
