- •Разработчик
- •Зав. Кафедрой Химии
- •Предисловие (общие методические указания)
- •Рекомендуемая литература Основная
- •Дополнительная
- •Примерный тематический план
- •Содержание программы и методические указания к самостоятельной работе по изучению дисциплины
- •1. Введение: основные понятия физической химии
- •2. Химическая термодинамика
- •3. Химическое равновесие
- •4. Применение термодинамики к фазовым переходам
- •5. Растворы неэлектролитов
- •6. Растворы электролитов
- •7. Электропроводность растворов электролитов
- •8. Электродные процессы и электродвижущие силы
- •9. Химическая кинетика и катализ
- •Методические указания к выполнению расчётно-графических заданий (ргз)
- •Контрольные вопросы
- •1. Вопросы к коллоквиуму №1 «Химическая термодинамика. Химическое равновесие»
- •2. Вопросы к экзамену
- •Контрольные задачи, выносимые на экзамен
- •A. Химическая термодинамика
- •1. Закон Гесса и следствия из него
- •2. Изменение термодинамических параметров при нагревании (охлаждении) вещества
- •3. Расчёт абсолютной энтропии вещества
- •4. Расчёт термодинамических параметров химических реакций и фазовых переходов
- •B. Фазовое равновесие
- •1. Переход между конденсированными фазами
- •2. Испарение
- •3. Сублимация
- •C. Коллигативные свойства растворов
- •1. Давление насыщенного пара
- •2. Понижение температуры замерзания и повышение температуры кипения
- •3. Осмотическое давление
- •D. Растворы электролитов
- •1. Изотонический коэффициент и степень диссоциации электролита
- •2. Ионная сила, средний коэффициент активности
- •3. Электропроводность растворов
- •4. Доннановское равновесие
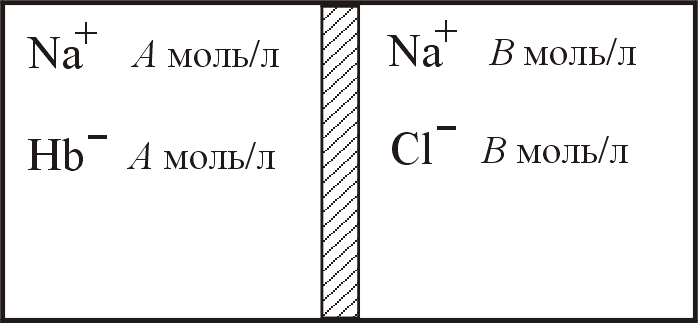
4. Доннановское равновесие
21.
Контейнер разделён полупроницаемой
мембраной на два отделения (см. рисунок).
В левое отделение поместили раствор
гемоглобина (200 г в 1 л раствора), в правое
– раствор NaCl
(6 г в 1 л раствора). Рассчитайте осмотическое
давление раствора гемоглобина после
установления доннановского равновесия
при Т = 298 К, если молекулы гемоглобина
находятся в форме Na+Hb-
(молярная масса гемоглобина 65000
![]() ).
Результаты расчёта округлять до
4-го знака.
).
Результаты расчёта округлять до
4-го знака.
|
|
до начала диффузии |
при равновесии |
Ответ: = 7,433 кПа.
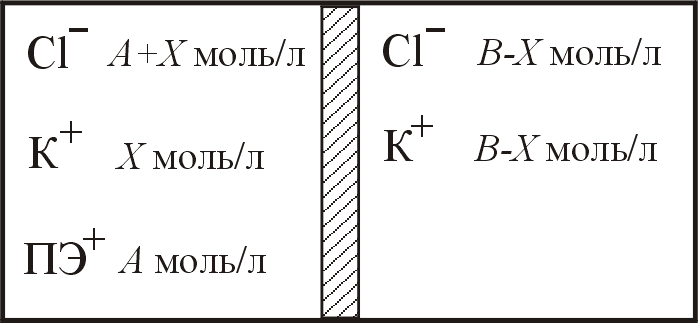
22. Контейнер разделён полупроницаемой мембраной на два отделения (см. рисунок). В левое отделение поместили раствор полиэлектролита ПЭ+Cl- (См = 0,001М), в правое – раствор KCl (Cм = 0,010М). Рассчитайте осмотическое давление раствора полиэлектролита после установления доннановского равновесия при Т = 298 К. Результаты расчёта округлять до 3-го знака.
|
|
до начала диффузии |
при равновесии |
Ответ: = 4,96 кПа.
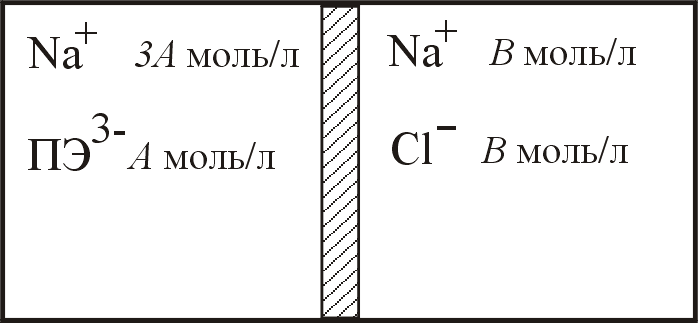
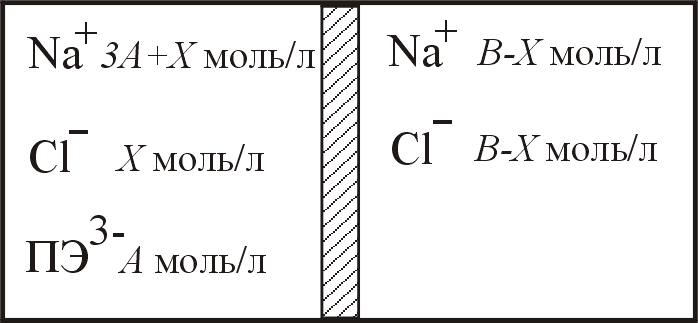
23. Контейнер разделён полупроницаемой мембраной на два отделения (см. рисунок). В левое отделение поместили раствор полиэлектролита Na+3ПЭ3- (См = 0,005М), в правое – раствор NaCl (Cм = 0,020М). Рассчитайте осмотическое давление раствора полиэлектролита после установления доннановского равновесия при Т = 313 К. Результаты расчёта округлять до 3-го знака.
|
|
до начала диффузии |
при равновесии |
Ответ: = 20,8 кПа.