- •Разработчик
- •Зав. Кафедрой Химии
- •Предисловие (общие методические указания)
- •Рекомендуемая литература Основная
- •Дополнительная
- •Примерный тематический план
- •Содержание программы и методические указания к самостоятельной работе по изучению дисциплины
- •1. Введение: основные понятия физической химии
- •2. Химическая термодинамика
- •3. Химическое равновесие
- •4. Применение термодинамики к фазовым переходам
- •5. Растворы неэлектролитов
- •6. Растворы электролитов
- •7. Электропроводность растворов электролитов
- •8. Электродные процессы и электродвижущие силы
- •9. Химическая кинетика и катализ
- •Методические указания к выполнению расчётно-графических заданий (ргз)
- •Контрольные вопросы
- •1. Вопросы к коллоквиуму №1 «Химическая термодинамика. Химическое равновесие»
- •2. Вопросы к экзамену
- •Контрольные задачи, выносимые на экзамен
- •A. Химическая термодинамика
- •1. Закон Гесса и следствия из него
- •2. Изменение термодинамических параметров при нагревании (охлаждении) вещества
- •3. Расчёт абсолютной энтропии вещества
- •4. Расчёт термодинамических параметров химических реакций и фазовых переходов
- •B. Фазовое равновесие
- •1. Переход между конденсированными фазами
- •2. Испарение
- •3. Сублимация
- •C. Коллигативные свойства растворов
- •1. Давление насыщенного пара
- •2. Понижение температуры замерзания и повышение температуры кипения
- •3. Осмотическое давление
- •D. Растворы электролитов
- •1. Изотонический коэффициент и степень диссоциации электролита
- •2. Ионная сила, средний коэффициент активности
- •3. Электропроводность растворов
- •4. Доннановское равновесие
2. Понижение температуры замерзания и повышение температуры кипения
7. В водном растворе этилового спирта мольная доля спирта 0,042. Определите температуру замерзания этого раствора при Р = 1 атм.
Ответ: tз = -4,54 С.
8. 55,16 г сахарозы растворено в 316,3 г воды. Рассчитайте точку кипения и точку замерзания этого раствора.
Ответ: Тк = 373,41 К; Тз = 272,2 К.
9.
Широко применяемый антифриз для
радиаторов автомобилей содержит
этиленгликоль (СН2ОН
– СН2ОН).
Сколько этого вещества следует добавить
в воду радиатора общим объёмом 7,5 л, если
принять за самую низкую температуру
эксплуатации –20 С.
Плотность этиленгликоля 1110
![]() .
.
Ответ: m (СН2ОН – СН2ОН) = 3125 г.
10. К очень слабым водным растворам для предотвращения замерзания в зимнее время обычно прибавляют глицерин СН2ОН-СНОН-СН2ОН. Допустив, что закон Рауля применим для растворов такой концентрации, вычислите сколько глицерина нужно прибавить, чтобы раствор, содержащий 0,1 кг воды, не замерзал до 268,16 К.
Ответ: m (СН2ОН-СНОН-СН2ОН) = 24,75 г.
11. 10 мг органического вещества растворено в 1 г камфоры. Понижение температуры замерзания камфоры составило 1,33 К; криоскопическая постоянная камфоры 40. Рассчитайте молярную массу растворённого вещества.
Ответ: М = 301 .
12. В 0,0106 кг раствора содержится 0,410-3 кг салициловой кислоты, растворённой в этиловом спирте. Этот раствор кипит при температуре на 0,337 К выше температуры кипения чистого спирта. Определите молярную массу салициловой кислоты, учитывая, что эбулиоскопическая постоянная этилового спирта 1,19.
Ответ: М = 138,6 .
13. Вычислите температуру замерзания водного раствора мочевины, если её мольная доля в растворе 0,0032, а теплота плавления льда mН = 6010 . Считайте раствор предельно разбавленным.
Ответ: Тз = 272,82 К.
14. Рассчитайте точку замерзания раствора, содержащего 5 г никотина С10Н14N2 в 250 г этанола. Температура замерзания чистого этанола 156 К, а теплота плавления этанола mН=5,02103 .
Ответ: Тз = 155,77 К.
15. Температура кипения бензола равна 353,36 К, а теплота кипения 30795 . Рассчитайте эбулиоскопическую постоянную бензола.
Ответ: Э = 2,629.
3. Осмотическое давление
16. Вычислите осмотическое давление водного раствора сахарозы (С12Н22О11) и давление насыщенного пара над раствором по следующим данным. Температура раствора 293 К; на 100г раствора приходится 6,84 г сахарозы; давление насыщенного пара чистой воды при 293 К Р= 23,38 гПа.
Ответ: = 487 кПа; Р = 23,3 гПа.
17. Калифорнийская секвойя – самое высокое дерево в мире. Считая, что её высота 105,4 м, оцените осмотическое давление, необходимое для подъёма воды от корней до вершины.
Ответ: = 10,2 атм.
18.
Если трубу
с полупроницаемой мембраной на одном
конце поместить в морскую воду на
достаточную глубину, гидростатическое
давление воды должно привести к обратному
осмосу – пресная вода потечёт в трубу.
Морская вода имеет осмотическое давление
23 атмосферы и плотность 1,03
![]() .
На какую глубину необходимо опустить
трубу для обратного осмоса?
.
На какую глубину необходимо опустить
трубу для обратного осмоса?
Ответ: h = 235 м.
19. 20 мг белка растворено в 10 г воды. При температуре 25 С осмотическое давление раствора составляет 0,3 Торр. Определите молярную массу белка, считая раствор идеальным.
Ответ: М = 1,24105 .
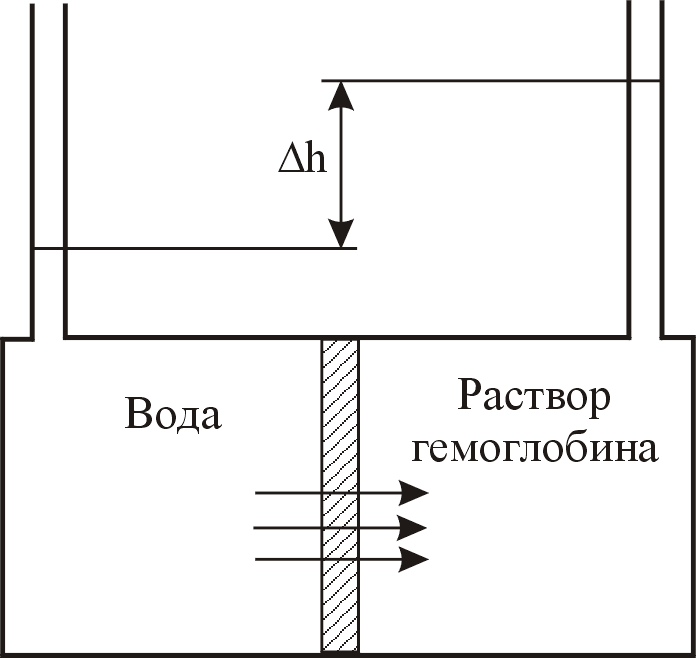
20. Раствор, содержащий 20 г гемоглобина в 1 л, помещён в правый сосуд, а чистая вода – в левый, отделённый от правого полупроницаемой мембраной (см. рисунок). В состоянии равновесия высота столба воды в правом сосуде на 77,8 мм превышает высоту в левом сосуде. Температура системы поддерживается постоянной, равной 298 К. Какова молярная масса гемоглобина? Ответ: М = 6,5104 .
|
|