
- •Микрофлора влагалища и ее значение в норме и патологии
- •Грамположительные облигатно-анаэробные бактерии
- •Грамотрицательные облигатно-анаэробные бактерии
- •Факультативно-анаэробные бактерии
- •Бактериальный вагиноз Этиология и патогенез
- •Диагностика
- •Лечение
- •Контроль лечения
- •8. Микробиоценоз кишечника у цыплят-бройлеров при применении пробиотиков
- •8.1. Изменение микробиоценоза желудочно-кишечного тракта уцыплят-бройлеров при колибактериозе под влиянием ветома 1.1
- •Микробиоценоз кишечника и иммунитет
Лечение
Целью проводимой терапии является элиминация условно патогенных микроорганизмов, нехарактерных для данного биотопа и восстановление нормальной микрофлоры влагалища.
Современное лечение бактериального вагиноза является двухэтапным.
На первом этапе используются антибактериальные препараты, обладающие антианаэробной активностью. К этой группе препаратов относится метронидазол, содержащий имидазоловое кольцо и обладающий выраженной активностью по отношению к неспорообразующим анаэробным бактериям, но не имеющий активности по отношению к гарднереллам. Подавляя рост и размножение неспорообразующих анаэробов метронидазол нарушает синергическое взаимодействие между анаэробами и гарднереллами, что проявляется положительным эффектом в лечении БВ.
Основным альтернативным препаратом в лечении БВ в настоящее время является клиндамицин. Пероральное применение клиндамицина может осложняться развитием псевдомембранозного колита. Учитывая, что наряду с высокой эффективностью при пероральном применении наблюдается большое количество нежелательных побочных реакций, клиницисты отдают предпочтение местному интравагинальному применению этих препаратов (3-х дневный курс лечения). Клиническая эффективность применения метронидазола и клиндамицина достигает 85-94%. К сожалению, клиндамицин не обладает селективным воздействием и наряду с элиминацией бактероидов, превотелл, гарднерелл оказывает негативное влияние и на лактобактерии. Дефицит лактобактерий, усугубляющийся после лечения антибактериальными препаратами служит предрасполагающим фактором для возникновения возвратных БВ. В этой связи, после проведения успешной антибиотикотерапии частота рецидивов БВ достигает 30%. Поэтому важной составной частью лечения БВ является использование препаратов-пробиотиков на втором этапе лечения.
В настоящее время для второго этапа лечения БВ применяются препараты-пробиотики: «Ацилакт», «Лактобактерин», «Бифидумбактерин». Они представляют собой лиофилизированную биомассу лакто- или бифидобактерий, выделенных из кишечника здоровых людей и применяются на тампонах или в виде свечей интравагинально.
В процессе жизнедеятельности вносимых лактобактерий снижается рН вагинального содержимого, возникает антагонистическая активность по отношению к условно патогенным микроорганизмам, стимулируется рост индигенной лактофлоры. Кроме того, в исследованиях последних лет подтвердили и противовоспалительный эффект пробиотиков. Использование препаратов-пробиотиков на втором этапе лечения БВ позволяет значительно снизить частоту рецидивов БВ.
Контроль лечения
Наиболее информативным методом, позволяющим контролировать эффективность лечебных мероприятий, является полноценное микробиологическое исследование отделяемого с заднего свода влагалища (так же, как и для диагностики БВ). К сожалению, этот метод достаточно длительный в исполнении, дорогостоящий и дающий ложноотрицательные результаты в случае персистенции (некультивируемые формы).
Используя полуколичественное определение концентрации лактобактерий методом ПЦР (тест-система ЗАО «ЛАГИС»), можно быстро и надежно контролировать эффективность лечения дисбиоза, так как восстановление микробиоценоза однозначно соответствует восстановлению уровня лактобактерий более 106 кл/мл.
Используя ПЦР-тест-системы ЗАО «ЛАГИС» для выявления условно-патогенных анаэробов (см. выше) можно определить маркеры дисбиоза в диагностическом количестве (более 104кл/мл).
В случае успешного лечения условно-патогенная флора не должна выявляться, так как количество этих бактерий должно уменьшиться до неопределяемого.
микробиоценоз Микробиоценоз – это совокупность популяций разных видов микроорганизмов, которые обитают в определенном биотопе (в водоеме, в полости рта). У здоровых людей и животных и в биотопах окружающей среды микробиоценоз состоит из большого числа видов (более 300 видов). Как правило, во внутренней среде организма микробиоценоз менее разнообразен. Качественный и количественный состав зависит от условий обитания, изменчивости микробов, миграции потока и соседних биотопов. В старых биотипах в случаях изменения условий обитания (при развитии патологических процессов или при длительном воздействии антимикробных факторов), а также в молодых биотопах (ожоговых ранах) резко обостряются конкурентные взаимоотношения между сочленами микробиоценоза и организмом хозяина, что может привести к развитию дисбактериоза.
Биохимический экспресс-анализ слюны (микробиоценоз полости рта)
Раздел: Исследование слюны

Исследование слюны - Биохимический экспресс-анализ слюны (микробиоценоз полости рта) - это лабораторное исследование, основанное на определении уровня биохимических показателей. Биохимический анализ слюны на дисбактериоз – это лабораторное исследование, основанное на определении уровня биохимических показателей, а именно метаболитов летучих жирных кислот (уксусной, пропионовой, масляной), которые продуцируют микроорганизмы, живущие в полости рта и отражающие состояние желудочно-кишечного тракта. При различной патологии, как полости рта, так и со стороны желудка, кишечника, печени изменяется микрофлора, а соответственно и биохимические параметры. Определяя спектр летучих жирных кислот, можно судить о локализации и заболевании пищеварительного тракта. Для исследования метаболитов микрофлоры используется новый способ газожидкостный хроматографический анализ, позволяющий адекватно оценить состояние микробиоценоза ротовой полости. Одним из преимуществ данного метода по сравнению с микробиологическим анализом (посев из ротовой полости) является быстрота его выполнения (2-5 дней). Дисбактериоз – это изменение как качественного, так и количественного состава бактериальной флоры ротовой полости, возникающее под влиянием различных факторов: характера питания, воспалительных процессов в организме и лечения антибиотиками, физический и психический стресс, оперативные вмешательства, состояние иммунодефицита, проживание человека в нехарактерной для него зоне. Микроорганизмы участвуют в процессах пищеварения с образованием метаболитов – летучих жирных кислот (уксусная, пропионовая, масляная). Результаты изучения летучих жирных кислот в ротовой полости показали, что уменьшение или увеличение концентраций кислот соотносится с определённой патологией, таким образом, легко можно диагностировать пародонтоз, гингивит, стоматит. Возможности данного анализа обширны, он позволяет оценить состояние микрофлоры непосредственно полости рта, а также составить представление о функции желудка, кишечника, печени. На основании полученных данных производится индивидуальный подбор терапии выявленной патологии, в случае эффективного лечения происходит нормализация количественного и качественного состава жирных кислот в полости рта. Ценность данного исследования в том, что оно позволяет понять характер изменений микробиоценоза ротовой полости и выявить основную патологию, приведшую к его развитию. Слюна - прозрачная бесцветная жидкость, жидкая биологическая среда организма выделяемая в полость рта тремя парами крупных слюнных желез (подчелюстные, околоушные, подъязычные) и множеством мелких слюнными железами полости рта. В полости рта образуется смешанная слюна или ротовая жидкость, состав которой отличается от состава смеси секретов желез, так как в ротовой жидкости присутствуют микроорганизмы и продукты их жизнедеятельности и различные компоненты пищи, компоненты зубного налета и зубного камня. Слюна смачивает полость рта, способствуя артикуляции, обеспечивает восприятие вкусовых ощущений, смазывает пережёванную пищу. Кроме того, слюна очищает полость рта, обладает бактерицидным действием, предохраняет от повреждения зубы. Под действием ферментов слюны в ротовой полости начинается переваривание углеводов. Слюна обладает pH от 5,6 до 7,6. На 98,5 % и более состоит из воды, содержит соли различных кислот, микроэлементы и катионы некоторых щелочных металлов, лизоцим, ферменты амилазу и мальтазу, расщепляющие углеводы до олиго- и моносахаридов, а также другие ферменты, некоторые витамины. Также состав секрета слюнных желез меняется в зависимости от характера раздражителя.
СРЕДСТВА РЕГУЛЯЦИИ МИКРОБИОЦЕНОЗА У ЖИВОТНЫХ |
|
Эпидемиологическая статистика последних лет свидетельствует о чрезвычайно высоком проценте дисбактериозов ЖКТ среди домашних животных от 70 до 90%. Число больных дисбактериозом животных сравнимо с количеством людей, которых прямо или косвенно коснулись сталинские репрессии, что лишний раз доказывает значимость проведения комплексных мероприятий для профилактики и лечения заболевания. В современной терминологии под дисбактериозом (дисбиоценозом или дисбиозом) понимают изменение количественного и качественного состава бактериальной микрофлоры организма, обусловленное нарушением микроскопической экологии в результате ослабления защитных и компенсаторных механизмов организма (срыв процесса адаптации). Нарушения нормофлоры в организме животных часто развиваются на фоне различных видов инфекционных и соматических патологий. Основными факторами, определяющими формирование дисбактериоза, являются неблагоприятные экологические факторы (загрязнение воды, воздуха), нерациональное питание животных, широкое применение антибиотиков, сульфаниламидов, гормональных и других средств, применяемых при откорме скота. Как правило, состояние дисбактериоза животных вторично и осложняет течение основного заболевания. Поэтому средства для коррекции микробиоценоза чаще используют как вспомогательные средства в комплексной терапии основного заболевания животного, сопровождающегося дисбактериозом. Первичный дисбактериоз встречается в основном у животных первых месяцев жизни, который возникает на фоне неразвитой иммунной системы. Следует подчеркнуть, что на практике не всегда просматривается четкая корреляция между степенью нарушения микробиоценоза и клиническим проявлением дисбактериоза. Это подтверждается данными о значительном количестве латентных, субклинических форм дисбактериоза у домашних животных. Компенсированная форма нарушения микробиоценоза является неблагоприятным фоном любой патологии животных и нуждается в своевременной коррекции с помощью средств, способствующих восстановлению нормальной флоры. Комплекс этих обстоятельств и побудил активное развитие этого направления в производстве лекарственных средств, премиксов и комбикормов для животных. Больших успехов в данной сфере достигло русское зарубежье, заложив платформу для дальнейшего изучения проблемы. Решение вопросов регуляции равновесия нормофлоры является чрезвычайно актуальной задачей, стоящей перед целым спектром средств разнородных по своему происхождению, свойствам и механизмам взаимодействия с ассоциацией микроорганизмов ЖКТ животных. Все средства, использующиеся для регуляции микробиоценоза ЖКТ животного, можно охарактеризовать как группу средств, состоящую из продуктов различных категорий (лекарственные средства, комбикорма, премиксы). Они обладают различными степенями селективности, механизмами, принципами и уровнями воздействия на равновесие индигенной микрофлоры ЖКТ, и могут использоваться для комплексной профилактики, терапии дисбактериозов и реабилитации больных животных этого профиля. Все средства, регулирующие равновесие индигенной микрофлоры (микробиоценоз) ЖКТ, условно можно разделить на две ассоциации. К первой группе относятся средства с неселективным принципом воздействия, антимикробная избирательная активность, которой отсутствует (кишечные антисептики, антибиотики, ферментные препараты, энтеросорбенты, иммуномодуляторы, вяжущие средства, пищевые волокна, обволакивающие, противовоспалительные средства и витамины). Вторая группа объединяет средства селективного (избирательного) воздействия: эубиотики (средства, содержащие живые культуры микроорганизмов нормофлоры), пробиотики (средства, содержащие культуры микроорганизмов, не являющихся представителями нормофлоры – самоэлиминирующиеся, транзитные антагонисты), постбиотики (средства содержащие продукты жизнедеятельности нормофлоры) и другие. Далеко не все средства, регулирующие микробиоценоз ЖКТ животных, могут являться добавками к основному корму, а выступают как самостоятельные лекарственные средства. |
Становление микробиоценоза кишечника
Новорожденный ребенок не имеет ни сформированного биоценоза, ни развитой системы барьерной, в том числе иммунологической, защиты. Общепринято считать, что первое заселение ЖКТ происходит в процессе родов, однако есть данные о наличие небольшого количества микробов в кишечнике даже внутриутробно в последние недели гестации. Предполагают, что эти бактерии проникают из кишечника матери, поскольку идентичны штаммам материнской кишечной флоры.
Родовые пути беременной женщины в последние недели перед родами несколько изменяют свой микробиологический пейзаж, в котором начинают преобладать свойственные кишечнику виды: лактобациллы, бифидо-бактерии, молочнокислые стрептококки и т.д. Возможно, эти микробы проникают туда из кишечника матери и становятся той самой первой микробиологической закваской, которая определяет формирование стартового кишечного биоценоза новорожденного.
Действительно, одни и те же микробы удается выделить из родовых путей матери, ротовой полости новорожденного в первые часы жизни и стула новорожденного на 3-4 день жизни. Однако плазмидный профиль энтеробактерий, лактобактерий и бифидобактерий влагалища и толстой кишки матери не совпадает, но совпадают свойства микрофлоры кишечника матери и ребенка. Более того, спектр штаммов бифидобактерий в первые дни жизни ребенка соответствует таковым у матери и представлен, в основном, свойственными взрослым В.adolescentis и В.breve.
Таким образом, первичное заселение ЖКТ новорожденного ребенка происходит под влиянием кишечной микрофлоры матери. Под влиянием кишечной микрофлоры матери формируется биоценоз ее родовых путей, некоторые штаммы лактобактерий кишечного происхождения обнаружены на коже ареол молочных желез вокруг соска. Этот факт подтверждает необходимость раннего прикладывания новорожденного к груди матери. Дети, рожденные путем Кесарева сечения, лишенные естественного микробиологического заряда в родах, демонстрируют в дальнейшем более долгий путь становления кишечной флоры. Эти данные подчеркивают важность состояния здоровья матери, биоценоза ее кишечника и родовых путей и открывают возможности для профилактики дисбиоза у ребенка путем приема матерью про- и пребиотических препаратов в последние недели перед родами.
Таблица 1. Динамика секреции иммуноглобулинов с грудным молоком |
|||
Возраст ребенка (день жизни) |
Секреция иммуноглобулинов (мг/сут) |
||
IgG |
IgM |
IGА |
|
1 |
80 |
120 |
11000 |
3 |
50 |
40 |
2000 |
7 |
25 |
10 |
1000 |
7-28 |
10 |
10 |
1000 |
29-50 |
10 |
10 |
1000 |
В целом, биоценоз новорожденных характеризуется широким спектром высеваемой из кала флоры, при этом могут доминировать аэробы, практически всегда присутствуют условно-патогенные бактерии -любой ребенок в первые недели жизни проходит период транзиторного дисбиоза. Эти микроорганизмы меняют первоначально аэробный ЖКТ, делая его пригодным для колонизации анаэробами: бифидобактериями, бактероидами, клостридиями и т.д.
В дальнейшем становление биоценоза во многом определяется характером питания: у детей, находящихся на грудном вскармливании, уже через несколько недель в микробном пейзаже доминируют бифидобактерий, на искусственном - длительно сохраняется смешанный характер флоры, она более разнообразна, чаще наблюдается присутствие аэробных и анаэробных условных патогенов. Спектр бифидобактерий также отличается: у детей на грудном вскармливании доминируют В.bifidum, на искусственном - В.longum, В.breve, В. infantis. В чем причина этих различий? Она заключается в свойствах материнского молока.
Молоко, являясь незаменимым пищевым субстратом, одновременно служит источником поступления более ста биологически активных субстанций, среди которых неспецифические факторы защиты (лакто-феррин, лизоцим, пропердин, интерферон и т.д.), иммуноглобулины, макрофаги, активные лимфоциты. В частности, с молоком матери ребенок ежедневно получает более 1000 мг секреторного IgА - необходимого компонента для формирования кишечного барьера. В молоке, а также в области ареолы соска на коже матери обнаруживаются лактобактерий (L.gasseri, L.rhmnosus), по своим характеристикам они соответствуют микрофлоре кишечника матери.
Термическая обработка полностью инактивирует иммуноглобулины, поэтому донорское молоко не обладает этими иммунозместительными свойствами. В молозиве и молоке матерей недоношенных новорожденных содержание SIgА в 2-2,5 раза ниже, что является одной из причин меньшей иммунологической "защищенности" этих детей.
Таблица 2. Иммунологические и фармакологически активные компоненты и гормоны в молоке |
||
Гуморальные |
Клеточные |
Гормоны и гормоноподобные субстанции |
|
|
|
Молоко и молозиво содержат также антиинфекционные неспецифические гуморальные факторы (таблица 2):
лактоферрин - доминирующий железосодержащий белок молока (нормальная концентрация его 2 г/л и более), в молозиве концентрация его еще выше - до 4-18 г/л. При пастеризации лактоферрин также разрушается.
лизоцим содержится в молоке в высокой концентрации (100 мкг/мл), которая значительно превышает таковую в плазме крови (4-10 мгк/мл). В молозиве содержание его еще выше (450-500 мкг/мл). При пастеризации молока уровень лизоцима падает в 5-6 раз. У матерей недоношенных в молозиве и молоке содержится лизоцима гораздо больше, чем у матерей доношенных, то есть недоношенный ребенок получает в сутки лизоцима больше, чем доношенный.
комплемент - это одно из главных звеньев, осуществляющих "стыковку" специфического и "неспецифического" иммунитета. В молозиве отмечен высокий уровень С3 (20% от концентрации в крови), в молоке - в 2 раза меньше. Комплемент разрушается в кислой среде, но так как у новорожденных в желудке почти нейтральный рН, то разрушения его не происходит, и в сочетании с IgМ и IgG он может образовывать иммунные комплексы и оказывать бактерицидное действие. Грудное молоко содержит также пропердин, пероксидазу, интерферон.
В формировании местной иммунной системы кишечника новорожденного ребенка принимают участие лимфоциты молока. Молочную железу и кишечник можно рассматривать как единую защитную систему, так как В- и Т-лимфоциты способны мигрировать из лимфатической ткани кишечника матери в ее молочную железу, то есть лимфоциты грудного молока проходят своеобразное "обучение" в кишечнике и сенсибилизированы именно к кишечной микрофлоре. Они попадают с молоком матери в кишечник ребенка и осуществляют не только местную защиту, но и способны проникать в кровь и участвовать в общем иммунном ответе. Лимфоциты молока очень активны, они способны к РБТЛ, синтезу иммуноглобулинов, продукции комплемента и интерферона. Содержат грудное молоко и макрофаги. Все клеточные элементы молока термолабильны и при пастеризации разрушаются.
Таблица 3. Качественный и количественный состав микрофлоры кишечника у детей первого года жизни в зависимости от характера вскармливания (по В.М.Коршунову с соавт.,1999) |
||
Группа микроорганизмов |
Грудное lg КОЕ/г |
Искусственное lg KОЕ/г |
Бифидобактерий |
10-11 В.bifidum, В.breve |
8,5-10 В.longum |
Лактобактерии |
6-7 |
7-8 |
Бактероиды |
7-8 кpоме В.fragilis |
8-9 кроме В.fragilis |
Фузобактерии |
- |
Ниже 6 |
Вейлонеллы |
- |
Ниже 5 |
Эубактерии |
- |
6-7 |
Пептострептококки |
- |
Ниже 5 |
Клостридии (лецитиназопозитивные) |
- |
Ниже 5 |
Клостридии (лецитиназонегативные) |
- |
Ниже 7 |
Энтерококки |
5-7 |
6-7 |
Стафилококки |
3-5 |
4-5 |
Стафилококки коагулирующие |
- |
ниже 2 |
Аэробные бациллы |
2-3 |
Ниже 4 |
Энтеробактерии: |
||
Е.соli с типичными свойствами |
7-8 |
7-8 |
Е.соli с измененными свойствами |
- |
не более 10% |
Клебсиеллы |
- |
ниже 4 |
Энтеробактеры |
- |
ниже 4 |
Цитробактеры |
- |
ниже 4 |
Протеи |
- |
ниже 4 |
Пpовиденции |
- |
ниже 4 |
Особенно благотворно сказывается на становлении нормального микробиоценоза кишечника новорожденного раннее прикладывание к груди. При прикаладывании в первые 2 ч содержание в кишечнике SIgА в 2 раза выше, по сравнению с детьми, приложенными через 12-24 ч, более высокий уровень пропердина и комплемента, в 2 раза большее количество бифидобактерий. Эти дети быстро и благополучно преодолевают период транзиторного дисбактериоза, лучше прибавляют в массе. Оказывает положительное влияние на становление нормальной микрофлоры и совместное пребывание матери и ребенка с первых часов жизни.
Доминирующее развитие бифидофлоры объясняется присутствием в женском молоке галактоолигосахаридов (ГОС). Это фукозилированные и сиализированные олигосахариды-дериваты лактозы, например, лакто-N-фукопентаоза, сиалил-лакто-N-тетраоза и т.д. Лактоза, являющаяся основным углеводом женского молока, представляет собой дисахарид, в состав которого также входит галактоза.
Вероятнее всего, именно галактоза ГОС и лактозы оказывает наиболее значимое бифидогенное воздействие и способствует формированию нормального биоценоза грудного ребенка.
В дальнейшем микрофлора кишечника детей первых месяцев жизни отличается ограниченностью видового разнообразия и, как следствие, - "уменьшением биологической устойчивости", недостаточной способности к саморегуляции. Микробиоценоз детей на грудном вскармливании отличается более высоким уровнем бифидобактерий и меньшим количеством условных патогенов, при искусственном вскармливании, как правило, высеваются аэробные и анаэробные условно-патогенные микробы (таблица 3).
Динамическое исследование микробиоценоза здоровых детей первого года жизни показало, что в 60% при посеве кала обнаруживаются те или иные условно-патогенные бактерии, количество которых уменьшается только к году (рис.1).
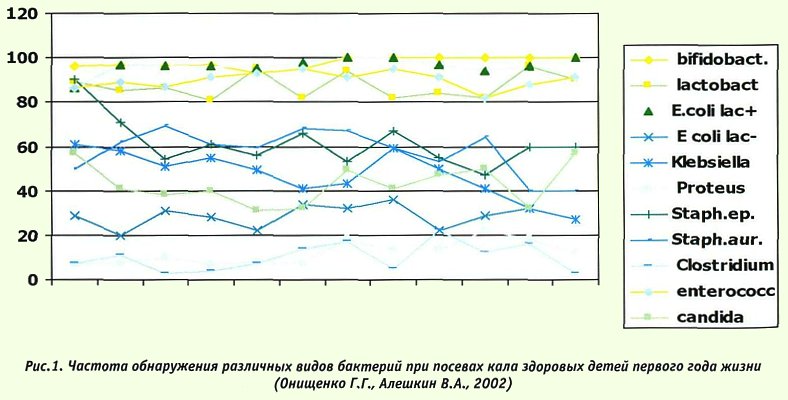
Возможно, представительство аэробной условно-патогенной микрофлоры в небольшом количестве необходимо для более активной стимуляции местного иммунитета. Поэтому само по себе присутствие условных патогенов в кишечнике детей первых месяцев жизни не должно расцениваться, как признак патологии, за исключением случаев избыточного роста, сопровождаемого появлением патологических симптомов.
После введения прикорма состав флоры претерпевает изменения, он имеет более разнообразный характер, меняется внутривидовой состав бифидобактерий, увеличивается количество лактобацилл, становится более многочисленным представительство строгих анаэробов, микробиоценоз приобретает черты взрослого типа. Окончательное формирование кишечного биоценоза происходит лишь к 2 годам. В этом возрасте характер кишечной микрофлоры несколько меняется: немного снижается количество бифидобактерий (от log 10-11 в грудном возрасте до log 8-9 у детей старше 3 лет), увеличивается количество лактобацилл (log 7-8), бактероидов и других представителей анаэробной флоры. Меняется и спектр штаммов бифидобактерий: преобладающими становятся В.adolescentis и В.longum. При устойчивом функционировании взаимодействия оси: микрофлора — эпителий — иммунная система слизистой оболочки кишечника, биоценоз имеет достаточно стабильный состав.
Микробиоценоз кожи и методы его коррекции |
Е.Ф.Колмакова, ОС. Панова, С.А. Чубатова, В.М. Попова, Е.Л. Жиленков, О.Г. Голубкова, Н.Н. Домашенко Медицинский центр "Эклан", ЗАО "Мирра", Москва, Областная больница №2, Ростов-на-Дону Нарушение микробиоценоза кожи, а именно изменение количественного и качественного состава микроорганизмов, как правило, сопровождается воспалительными заболеваниями. Как показал опыт, применение средств нового поколения на основе бактериофагов и липидных везикул на этапе противовоспалительной терапии высоко эффективно. Цель настоящей работы - изучение возможности применения геля с бактериофагами при различных воспалительных процессах кожи (угревая болезнь, фурункулез, синдром диабетической стопы), при бактериальной обсемененности очагов поражения стафилококками, стрептококками, клебсиеллами, кишечной палочкой, псевдомонадами, протеями, коринебактериями и грибами Candida albicans. Остановимся подробнее на результатах лечения угревой болезни. ПАТОГЕНЕЗ ВОСПАЛИТЕЛЬНОГО ПРОЦЕССА Угревая болезнь (УБ) - одно из самых распространенных заболеваний кожи, поражающее от 80 до 100% подростков и молодых людей в возрасте от 11 до 30 лет, причем почти у 50% пациентов формируются стойкие акнеформные элементы, не поддающиеся лечению и приводящие к тяжелым последствиям |1]. К осложнениям акне относятся застойные пятна, атрофические и реже гипертрофические рубцы. При этом даже легкие формы УБ могут вызывать значительные расстройства и имеют серьезные психологические последствия [7]. Успешное лечение акне базируется на правильном выборе препаратов с учетом конкретной стадии УБ, индивидуального подхода к пациенту, его анамнестических и психологических особенностей [9]. Главной мишенью патофизиологических изменений, происходящих при акне, является пилосебацейный комплекс. Ключевую роль в развитии этого заболевания играют 4 фактора:
УБ является мультифакториальным дерматозом, но многие авторы считают, что одна из причин развития акне - увеличение продукции кожного сала и его вязкости под действием андрогенов. В предпубертатном периоде наблюдается повышенная продукция дегидроепиандростерон сульфата, который может быть метабол изирован в потенциальные андрогены в коже, вызывая при этом гипертрофию сальных желез и избыточную продукцию в них кожного сала. Уровень дегидроепиандростерон сульфата коррелирует с тяжестью УБ |10]. Часто начало УБ в подростковом возрасте ассоциировано с повышенной чувствительностью рецепторов сальных желез к нормальному уровню андрогенов. У девушек избыточная овариальная и надпочечниковая продукция андрогенов редко может быть причиной развития акне, особенно при позднем начале УБ. В этом случае заболевание характеризуется упорным течением и может сопровождаться развитием гирсутизма [11]. Перечисленное выше подтверждает необходимость индивидуального подхода. В патогенезе УБ основные изменения происходят в сально-волосяном фолликуле. При этом наблюдается преобладание процессов пролиферации и дискератоза над процессами нормальной десквамации, что приводит к закупорке протока сально-волосяного фолликула. Первичные повреждения при акне представляют собой микрокомедоны, малозаметные невооруженным глазом. Со временем фолликул наполняется продуктами расщепления липидов, бактериями и фрагментами клеток, а клинически наблюдается возникновение открытых или закрытых комедонов. В случае изменения количества и пролиферации P.acnes и присоединения медиаторов воспаления появляются папулы и пустулы. Одновременно происходит диерегуляция диффереицировки и скорости пролиферации кератиноцитов, которая сопряжена со снижением концентрации линоленовой кислоты. При обструкции протока сально-волосяного фолликула создаются наиболее благоприятные условия для размножения анаэробных микроорганизмов, в том числе P.acnes, который продуцирует факторы хемотаксиса, привлекающие противовоспалительные цитокины, в результате чего клиническая картина ухудшается. При дальнейшем развитии воспалительной реакции происходит разрыв стенки сальной железы, ее содержимое попадает в дерму, в процесс вовлекаются другие формы микроорганизмов и медиаторы межклеточного пространства. Клинически это проявляется возникновением папул, пустул, кистозных и узловатых элементов и прогрессированием воспалительного процесса. ЗНАЧЕНИЕ ПРОТИВОВОСПАЛИТЕЛЬНОЙ ТЕРАПИИ Понимание патогенеза УБ внесло некоторые коррективы в терапевтические подходы к данной нозологии. Сейчас уже не вызывает сомнения тот факт, что для воздействия на разные звенья патогенеза акне оправданной является комбинированная терапия, назначаемая по возможности в самом начале заболевания. В случае комедонального акне показано применение ретиноидов, азелаиновой и салициловой кислот в сочетании с проведением механических или ультразвуковых чисток лица, а также назначение химических пилингов с гликолевыми кислотами. При развитии воспалительных элементов (папул, пустул) необходимо комбинировать перечисленные выше препараты, влияющие в основном на гиперкератоз, с противовоспалительными и противомикробными средствами. При выраженной папулезной сыпи с незначительным количеством пустул, а также при выраженной пустулезной сыпи с единичными узловыми элементами рекомендуется сочетать наружные антибактериальные препараты, топические ретиноиды и системную антибиотикотерапию. Лечение, как правило, бывает длительным. Еще труднее и дольше лечится фурункулез, что связано с дальнейшим изменением микробного пейзажа кожи, присоединением других форм микроорганизмов и диссоциацией внутри популяции одного вида бактерий, а также с возникновением их новых генотипов. Обобщение данных бактериологического анализа клинических материалов показало, что чаще всего в образцах гнойного отделяемого при фурункулезе обнаруживаются смеси стафилококков, кори небактерий, кишечных палочек и грибов Candida albicans, реже встречаются псевдомонады, стрептококки, клебсиеллы и протеи (см. таблицу; рис. 1).
Несмотря на огромный выбор современных антибактериальных препаратов, заболеваемость воспалительными процессами на коже не снижается. Это объясняется, с одной стороны, повышением резистентности микроорганизмов, а с другой, - непереносимостью антибактериальных препаратов некоторыми пациентами. Кроме того, при наружном применении препаратов устойчивость микроорганизмов формируется значительно быстрее, чем при пероральном. Поэтому в настоящее время актуальной задачей в терапии угревой болезни является поиск и применение препаратов, обеспечивающих снижение реакции воспаления с одновременной нормализацией биоценоза кожи. Очень важно быстро устранить воспалительный процесс и не допустить его пролиферации. Учитывая положительный опыт применения препаратов с бактериофагами на этапе противовоспалительной терапии в стоматологии, хирургии и офтальмологии [1, 3,4, 5]. В Медицинском центре "Эклан" и Областной больнице №2 (Ростов-на-Дону) совместно с ЗАО "МИРРА" проводились клинические исследования новых препаратов с бактериофагами для противоугревой терапии и других воспалений кожи. При изучении микробного пейзажа кожи, пораженной различными формами УБ, практически у 90% пациентов обнаруживали увеличение численности стафилококков, как золотистого, так и эпидермального (см. таблицу, рис. 2). Примерно у 65% больных отмечалось значительное увеличение количества стрептококков (до 10^6 или 10^8 кл/мл), причем на фоне существенного роста численности коринебактерий (до 10^6 кл/мл). При затяжных, упорных процессах, после применения целого ряда препаратов антибактериального действия, в том числе и на основе метронидазола, обнаруживали дисбактериозы кожи, увеличение количества грибковых форм микроорганизмов, вплоть до возникновения кандидозов. В ряде случаев выявили инфицирование кишечной палочкой, встречались отдельные факты обнаружения монокультуры стафилококка, стрептококка, клебсиелл, псевдомонад, протея. В большинстве случаев было зафиксировано наличие микстовых культур, где выявлялись различные стафилококки, стрептококки, при этом гемолитический стрептококк встречался приблизительно в 15% случаев.
Под наблюдением находились группы пациентов (приблизительно 70% женщин и 30% мужчин) в возрасте от 19 до 27 лет. Длительность заболевания составляла от 5 до 14 лет. У 56% пациентов диагностировали I степень тяжести УБ согласно классификации Американской академии дерматологов (открытые и закрытые комедоны, единичные папулы), у 44% пациентов была II степень тяжести УБ (папулезная сыпь, единичные пустулы). Перед началом лечения и в контрольной группе был проведен анализ микрофлоры кожи (результаты представлены на рис.3, а, б).
В качестве антибактериального средства применяли гель с бактериофагами. Активным началом геля является высокоочищенный концентрат бактериофагов, обладающих специфической литической активностью в отношении St. aureus, St. epidermidis, Str. pyogenes и др., Kl. pneumoniae, E. coli, Ps.aerugenosa, P. vulgaris, P. mirabilis. Гель наносили на кожу лица в утренние и вечерние часы. Перед нанесением геля кожу пациентов очищали пенящимися средствами (после чего пену тщательно удаляли) или очищающими лосьонами и прочими жидкостями. Для удаления пустулезных элементов дополнительно проводились механические чистки с последующей обработкой вскрытых элементов препаратом "Мастер-Дези", в состав которого входят азелаиновая и салициловая кислоты и концентраты лекарственных растений, обеспечивающие противовоспалительный и комедонолитический эффекты. Количество невоспалительных (открытые и закрытые комедоны), а также воспалительных (папулы и пустулы) элементов оценивалось до начала лечения и спустя 2 и 6 нед, параллельно проводили бактериологический анализ микрофлоры (см. рис. 3, в). К концу 2-й недели у всех пациентов отмечалось уменьшение воспалительных элементов, причем полный регресс наблюдался у 27% пациентов. В уменьшении открытых комедонов была отмечена незначительная динамика в среднем на 25%. Поэтому для улучшения результатов проводимой терапии в некоторых случаях применяли препарат "Дифферин" (1% гель) на ночь. В результате проводимого лечения в течение 2 мес мы наблюдали полный регресс воспалительных элементов, количество комедонов уменьшилось в среднем на 40%. Таким образом, применение препарата с бактериофагами полностью санирует очаг воспаления от патогенов в 45% случаев; в 55% - снижает количество возбудителей до уровня нормофлоры кожи. Полный регресс воспалительных элементов устраняет возникновение келлоидных рубцевых изменений кожи. Применение бактериофагов в качестве антибактериального средства обеспечивает за 2 мес полный регресс воспалительных элементов в 40% случаях у больных с 5-14-летним процессом. Данные бактериологического анализа (в %) гнойного отделяемого при фурункулах и вульгарных угрях.
Полученные нами предварительные данные позволяют рекомендовать "Бактериофаг-гель" в комбинированной терапии в качестве средства с противовоспалительными свойствами и сочетать его применение с проведением механических чисток лица и последующей поддерживающей терапией ретиноидами для нормализации гормонального фона. Результаты, полученные при лечении фурункулеза и синдрома диабетической стопы при отсутствии положительной динамики от традиционно используемых местных препаратов (диоксин, левомеколь, ируксол и др.), также позволяют предположить возможность расширения спектра применения препаратов с бактериофагами. Кроме того, фаготерапия совместима с антибиотикотерапией и другими видами лечения бактериальных инфекций, что является немаловажным при остром течении заболевания. |
Нарушение микробиоценоза кишечника и его лечение
Значение микрофлоры кишечника
Важнейшую роль в жизнедеятельности организма человека играет микробиоценоз кишечника – симбионтные микроорганизмы, активно участвующие в формировании иммунобиологической реактивности организма, в обмене веществ, в синтезе витаминов, необходимых аминокислот и целого ряда биологических соединений. Нормальная флора, проявляя антагонистическую активность по отношению к патогенным и гнилостным микроорганизмам, является важнейшим фактором, препятствующим развитию инфекций.
Нарушение подвижного равновесия симбионтных микроорганизмов нормальной микрофлоры, причиной которого может явиться массивное, а порой и бесконтрольное употребление антибиотиков и химиотерапевтических препаратов, экологическое или социальное неблагополучие (хронические стрессы), широкое использование человеком химических продуктов, попадающих в окружающую среду, так называемых ксенобиотиков, повышенный радиационный фон и неполноценность питания (употребление рафинированной и консервированной пищи) принято называть дисбиозом, или дисбактериозом. При дисбиозе нарушается состояние динамического равновесия между всеми ее компонентами (макро- и микроорганизмом и средой обитания) обозначают как эубиотическое. Состояние динамического равновесия между организмом хозяина, микроорганизмами, его заселяющими, и окружающей средой принято называть «эубиоз», при котором здоровье человека находится на оптимальном уровне.
В настоящее время доминирует представление о микрофлоре организма человека как о еще одном «органе», покрывающем кишечную стенку, другие слизистые оболочки и кожу человека. Масса нормальной микрофлоры около 5% массы взрослого человека (2,5–3,0 кг), и насчитывает порядка 1014 клеток (сто биллионов) микроорганизмов. Это число в 10 раз больше количества клеток организма хозяина.
Основным резервуаром микроорганизмов является нижней отдел толстой кишки. Число микробов в толстой кишке достигает 1010–1011 на 1 г кишечного содержимого, в тонкой – их количество значительно меньше, благодаря бактерицидности желудочного сока, перистальтике и, вероятно, эндогенным антимикробным факторам тонкой кишки, хотя может достигать у человека 108.
У здоровых лиц около 95–99% микробов, поддающихся культивированию, составляют анаэробы, которые представлены бактероидами (105–1012 в 1 г фекалий) и бифидобактериями (108–109 бактериальных клеток в 1 г испражнений). Основными представителями аэробной флоры фекалий являются: кишечная палочка (106–109), энтерококк (103–109), лактобациллы (до 1010). Кроме того, в меньших количествах и реже выявляют стафилококки, стрептококки, клостридии, клебсиеллы, протей, дрожжеподобные грибы, простейшие и др.
Нормальная микрофлора, являясь симбионтной, выполняет ряд функций, имеющих существенное значение для жизнедеятельности макроорганизма, и представляет собой неспецифический барьер – биопленку, которая, как перчатка, выстилает внутреннюю поверхность кишечника и состоит, помимо микроорганизмов, из экзополисахаридов различного состава, а также муцина. Биопленка регулирует взаимоотношения между макроорганизмом и окружающей средой.
Нормальная микрофлора кишечника оказывает важное влияние на защитные и обменно-трофические адаптационные механизмы организма:
– уменьшение потенциала патогенного воздействия на стенку кишечника со стороны болезнетворных микроорганизмов; – потенцирование созревания механизмов общего и локального иммунитета; – повышение концентрации неспецифических факторов иммунитета и их антибактериальной активности; – формирование на поверхности интестинальных слизистых оболочек защитного биослоя, «уплотняющего» стенку кишечника и препятствующего проникновению в кроваток токсинов болезнетворных возбудителей; – выделение органических кислот (молочная, уксусная, муравьиная, пропионовая, масляная), которые способствуют подкислению химуса, препятствуя размножению патогенных и условно-патогенных бактерий в кишечнике; – синтезируемые кишечной аутофлорой различные антибиотические вещества (колицины, лактолин, стрептоцид, низин, лизоцим и др.) непосредственно оказывают бактерицидное или бактериостатическое воздействие на болезнетворные микроорганизмы.
Нормальная кишечная микрофлора принимает активное участие в процессах пищеварения и в биохимических процессах жирового и пигментного обмена. Отмечено благоприятное влияние кишечной микрофлоры на процессы всасывания и обмена веществ, утилизации кальция, железа, витамина D.
Естественная микрофлора кишечника тормозит процессы декарбоксилирования пищевого гистидина, уменьшая тем самым синтез гистамина, а следовательно, снижает риск пищевой аллергии у детей. Благодаря нормальной кишечной аутофлоре осуществляется витаминосинтезирующая функция микроорганизмов, в частности витаминов С, К, В, В2, В6, В12, РР, фолиевой и пантотеновой кислот, а также улучшается всасывание витаминов D и Е, поступивших в организм с пищей. Важная роль отводится естественной флоре кишечника в синтезе незаменимых для организма аминокислот.
Вся микрофлора кишечника подразделяется на:
1) облигатную часть, к которой относятся микроорганизмы, постоянно входящие в состав индигенной флоры и играющие важную роль в метаболических процессах и защите организма хозяина от инфекции; 2) факультативную часть, к которой относятся бактерии, часто встречающиеся у здоровых людей, которые могут выступать в качестве этиологических факторов заболеваний в случае снижения резистентности микроорганизма; 3) транзиторную часть, обнаружение или выявление представителей которой носит случайный характер, так как они неспособны к длительному пребыванию в макроорганизме. Кроме того, в просвете кишечника здорового человека периодически могут находиться в небольших количествах возбудители инфекционных заболеваний, не вызывая формирования патологического синдрома до тех пор, пока защитные системы организма хозяина препятствуют их избыточному размножению.
Нередко возникают трудности в трактовке результатов бактериологического исследования кала в связи с широкими колебаниями их даже у практически здоровых людей, быстрой сменяемостью показателей у одного и того же больного при повторных исследованиях без какой-либо закономерности. К тому же известно, что микрофлора фекалий не всегда отражает содержание пристеночной, криптовой и, вероятно, даже внутрипросветной (полостной) микрофлоры кишечника.
Нарушение микробиоценоза кишечника
Разнообразные неблагоприятные воздействия на человека приводят к формированию различных патологических состояний и нарушений, происходят количественные и качественные изменения нормальной микрофлоры кишечника. Однако если после исчезновения неблагоприятного внешнего фактора эти изменения самопроизвольно исчезают, их можно отнести к категории ''дисбактериальных реакций''. Понятие ''дисбактерия'' кишечника является более широким, при этом качественные и количественные изменения нормальной микрофлоры кишечника более выраженные и стойкие. Дисбактерию рассматривают как проявление дисгармонии в экологической системе.
Дисбиоз же представляет собой состояние экосистемы, при котором происходит нарушение функционирования ее составных частей и механизмов взаимодействия, в результате чего развивается заболевание человека. Дисбиозами страдают пациенты практически всех клиник и стационаров, жители экологически неблагоприятных регионов, рабочие вредных производств. Нарушения нормальной микрофлоры этих категорий населения формируются в результате воздействия на организм физических, химических, радиационных и других факторов. Нерациональной питание, особенно в зимнее время, чрезмерное использование рафинированных продуктов, ежегодный переход с зимней на летнюю форму питания и возврат к ней можно отнести к факторам риска дисбиоза.
Микрофлора кишечника называется дисбиотической только в том случае, если выраженные и стабильные качественные изменения ее сопровождаются появлением ряда клинических симптомов болезни.
Дисбактериоз отражает состояние бактериальных форм представителей микрофлоры. Дисбактериоз – это состояние, характеризующееся нарушением подвижного равновесия кишечной микрофлоры, в норме заселяющей нестерильные полости и кожные покровы, возникновением качественных и количественных изменений в микрофлоре кишечника. Согласно ОСТу 91500.11. 0004–2003 дисбактериоз кишечника рассматривается как клинико-лабораторный синдром, возникающий при ряде заболеваний и клинических ситуаций, характеризующийся изменением качественного и/или количественного состава нормальной микрофлоры, метаболическими и иммунными нарушениями, сопровождающимися у части больных клиническими проявлениями.
Дисбактериоз наиболее часто проявляется уменьшением общего числа микробов, иногда до полного исчезновения отдельных видов нормальной микрофлоры с одновременным преобладанием видов, которые в норме присутствуют в минимальных количествах. Это преобладание может быть длительным или возникать периодически.
Выделяется четыре микробиологические фазы в развитии дисбактериоза кишечника. На первой (начальной) фазе резко уменьшается количество нормальных симбионтов в естественных (обычных) местах обитания. Во второй фазе резко уменьшается число одних микроорганизмов (или наблюдается исчезновение некоторых симбионтов) за счет увеличения количества других. Третья фаза характеризуется тем,что меняется локализация аутофлоры, т.е. наблюдается ее появление в органах, в которых она обычно не встречается. В четвертую фазу у отдельных представителей или ассоциаций микробной флоры возникают признаки патогенности. Дисбактериоз кишечника может протекать в латентной (субклинической), местной (локальной) и распространенной (генерализованной) формах (стадиях). При латентной форме изменение нормального состава симбионтов в кишечнике не приводит к возникновению видимого патологического процесса. При распространенной форме дисбактериоза, которая может сопровождаться бактериемией, генерализацией инфекции, вследствие значительного снижения общей резистентности организма поражается ряд органов, в том числе паренхиматозных, нарастает интоксикация, нередко возникает сепсис. По степени компенсации выделяют компенсированную (чаще протекающую латентно), субкомпенсированную (как правило, местную) и декомпенсированную (генерализованную) формы.
В возникновении дисбактериоза существенную роль играют антагонистические взаимоотношения представителей естественных ассоциаций. Небольшие временные колебания числа отдельных микроорганизмов устраняются самостоятельно, без каких-либо вмешательств. Причинами дисбактериоза могут быть заболевания, создающие условия, при которых увеличивается скорость размножения некоторых представителей микробных ассоциаций или накапливаются специфические вещества, подавляющие рост других микроорганизмов. Эти патологические состояния приводят к значительным изменениям состава микрофлоры и количественных соотношений различных микробов.
Наиболее часто дисбактериоз развивается на фоне заболеваний желудка, протекающих с ахлоргидрией, хронического энтерита и колита, хронического панкреатита, болезней печени и почек, В12-фолиеводефицитной анемии, злокачественных новообразований, резекции желудка и тонкой кишки, нарушения перистальтики, в частности толстокишечного стаза.
Нарушение функций тонкой и толстой кишки может приводить к возникновению диареи, в патогенезе которой существенную роль играют повышение осмотического давления в полости кишечника, расстройство процессов абсорбции и кишечная гиперсекреция, нарушение пассажа кишечного содержимого, кишечная гиперэкссудация. Для большинства форм диареи, связанных с поражением тонкой и толстой кишки, характерно значительное увеличение концентрации электролитов в фекалиях, которая достигает содержания их в плазме крови. Однако при нарушении всасывания лактазы в патогенезе диареи преобладает осмотический компонент, когда потери воды превышают потери солей.
У больных, страдающих хроническими заболеваниями печени, желчного пузыря и поджелудочной железы, а также у перенесших обширную резекцию подвздошной кишки, нарушается процесс всасывания жиров. При этом жирные и желчные кислоты стимулируют секреторную функцию толстой кишки путем активации кишечной аденилатциклазы и увеличения проницаемости слизистой оболочки, что ведет к развитию диареи у больных с указанной патологией.
При хронических состояниях расстройство процесса всасывания в кишечнике обусловлено дистрофическими, атрофическими и склеротическими изменениями эпителия и слизистой оболочки кишки. При этом укорачиваются и уплощаются ворсины и крипты, уменьшается число микроворсинок, в стенке кишки разрастается фиброзная ткань, нарушается крово- и лимфообращение. Уменьшение общей всасывающей поверхности и всасывательной способности приводит к нарушению процессов кишечного всасывания. Этот патологический процесс в тонкой кишке, возникающий при хронических заболеваниях желудочно-кишечного тракта, характеризуется истончением слизистой оболочки кишки, потерей дисахаридаз щеточной каймы, нарушением всасывания моно- и дисахаридов, уменьшением переваривания и всасывания белков, увеличением времени транспорта содержимого по кишке, заселением бактериями верхних отделов тонкой кишки.
Недостаточно сбалансированное питание в последнее время является причиной заболеваний тонкой кишки, при которых нарушаются обменные процессы и развивается дисбактериоз. Вследствие этого в организм в недостаточном количестве поступают продукты гидролиза белков, жиров, углеводов, а также минеральных солей и витаминов. Развивается картина патологического процесса в тонкой кишке, обусловленного белковой недостаточностью, напоминающая таковую при заболеваниях кишечника. Причиной развития дисбактериоза у больных являются ревматические заболевания, в основе которых лежит системное или локальное поражение соединительной ткани. Поражение кишечника при системных болезнях соединительной ткани определяется атрофией мышечных волокон, замещением их фиброзной соединительной тканью, инфильтрацией мышечного слоя стенки кишки лимфоидными элементами. Характерны также изменения сосудов: артерииты, пролиферация интимы артерий среднего и малого калибра с выраженным сужением их просвета. Наиболее часто поражаются подслизистый и мышечный слои стенки кишки. В результате этих изменений возникают нарушения двигательной, всасывательной и пищеварительной функций кишечника. Возникающие нарушения двигательной функции, лимфообразования и кровоснабжения кишечной стенки ведут к стазу содержимого кишечника, развитию синдрома нарушенного всасывания и росту патогенной и условно-патогенной флоры с ее дисбалансом.
Возникновению дисбактериоза способствуют необоснованное и бессистемное применение антибиотиков и других антибактериальных препаратов, которые уничтожают нормальные симбионты и приводят к размножению устойчивой к ним флоры, а также аллергические реакции, в том числе обусловленные сенсибилизацией микроорганизма штаммами микробов, ставших устойчивыми к указанным средствам.
Таким образом, в патогенезе заболевания существенное значение имеет повреждение слизистой оболочки кишки в результате длительного воздействия механических, токсических, аллергических факторов. В патологический процесс вовлекается нервный аппарат кишечника, что приводит к нарушению двигательной и секреторной функций кишки. Развивается дисбактериоз, характеризующийся уменьшением количества микроорганизмов, постоянно присутствующих в кишечнике (бифидобактерии, кишечная палочка, лактобактерии), нарушением соотношения бактерий в различных отделах кишечника, усиленным размножением условно-патогенной и появлением патогенной флоры. При резком ослаблении иммунитета эти микробы способны вызывать локализованные гнойно-воспалительные и генерализованные процессы.
Активное вмешательство в течение большинства заболеваний химиопрепаратами при условии множества протекающих одновременно заболеваний – полиморбидности очень часто приводит к нарушению микробиоценоза. Так, например, известно, что этиотропная терапия острых и хронических желудочно-кишечных заболеваний, особенно квадритерапия хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, ассоциированных с Helicobacter pylori, в 100% случаев ведет к усугублению дисбиотических явлений.
Нормальная микрофлора кишечника
Представителями нормальной микрофлоры кишечника человека являются: 1. Грамположительные облигатно-анаэробные бактерии: • бифидобактерии – грамположительные палочки, строгие анаэробы, представители облигатной микрофлоры, присутствующие в кишечнике на протяжении всей жизни здорового человека, с высокой антагонистической активностью по отношению к патогенным микроорганизмам, препятствуют проникновению микробов в верхние отделы желудочно-кишечного тракта и другие внутренние органы, оказывают выраженное иммуностимулирующее действие на систему местного иммунитета кишечника; • лактобактерии – грамположительные бактерии, микроаэрофилы. Относятся к облигатной флоре кишечника, подавляют гнилостные и гноеродные бактерии, за счет антибактериальной активности предохраняют слизистую оболочку кишечника от возможного внедрения патогенных микробов; • эубактерии – грамположительные неспорообразующие полиморфные палочковидные бактерии, строгие анаэробы, участвуют в реакциях трансформации холестирола в копростанол и в деконъюгации желчных кислот; • пептострептококки – грамположительные кокки, строгие анаэробы, принадлежат к облигатной микрофлоре кишечника, могут стать этиологическим фактором различных инфекций; • клостридии – грамположительные спорообразующие, часто подвижные, палочковидные бактерии, строгие анаэробы, относятся к факультативной части нормальной микрофлоры кишечника, участвуют в деконъюгации желчных кислот, многие лецитиназонегативные клостридии участвуют в поддержании колонизационной резистентности, подавляя размножение в кишечнике патогенных клостридий, некоторые клостридии при расщеплении белков способны дать токсичные продукты обмена, которые при снижении резистентности организма могут стать причиной эндогенной инфекции. 2. Грамотрицательные облигатно-анаэробные бактерии: • бактероиды – неспорообразующие полиморфные палочки, строгие анаэробы, принимают участие в пищеварении и в расщеплении желчных кислот, способны секретировать гиалуронидазу, гепариназу, нейроминазу, фибринолизин и _-лактамазу и синтезировать энтеротоксин; • фузобактерии – неспорообразующие полиморфные палочковидные бактерии, строгие анаэробы, обладают гемагглютининами, гемолизинами, способны секретировать лейкотоксин и фактор агрегации тромбоцитов, ответственный за тромбоэмболиты при тяжелых септицемиях; • вейлонеллы – облигатно-анаэробные кокки, слабо сбраживающие сахара и способные к редукции нитрата и продукции газа, что при избыточном размножении в кишечнике может вызвать диспепсические расстройства. 3. Факультативно-анаэробные микроорганизмы: • эшерихии – грамотрицательные подвижные палочки, условно-патогенные микроорганизмы входящие в семейство Enterobactericae, могут продуцировать колицины, тормозящие рост энтеропатогенных штаммов этого вида бактерий и поддерживать систему местного иммунитета в физиологически активном состоянии, принимают участие в витаминообразовании; • стафилококки – грамположительные кокки, относящиеся к семейству Micrococcaceae, присутствуют в кишечнике в небольших концентрациях, обладают патогенными свойствами, не вызывают формирования патологических процессов до тех пор, пока в результате каких-либо неблагоприятных воздействий не снизится резистентность макроорганизма; • стрептококки – грамположительные кокки, входят в состав факультативной микрофлоры, закисляют среду обитания сбраживания углеводы, участвуют в поддержании колонизационной резистентности на оптимальном уровне; • бациллы – грамположительные палочковидные спорообразующие бактерии, их основная экологическая ниша – почва, при попадании в кишечник в больших концентрациях бациллы способны вызывать пищевые токсикоинфекции; • дрожжеподобные грибы рода Candida редко в небольших концентрациях обнаруживаются в испражнениях. |
Режим дозирования лекарственного средства
ЛИНЕКС (комбинированный препарат) Применять после еды. Для грудных детей и детей до 2 лет: 3 раза в сутки по 1 капсуле (содержимое капсулы можно развести в молоке или воде). Для детей от 2 до 12 лет: 3 раза в сутки по 1 или 2 капсулы, запивая небольшим количеством жидкости. Для взроcлых: 3 раза в сутки по 2 капсулы, запивая небольшим количеством жидкости. Длительность лечения зависит от причины развития дисбактериоза. Представлена краткая информация производителя по дозированию лекарственного средства. Перед назначением препарата внимательно читайте инструкцию. |
Коррекция нарушенной микрофлоры желудочно-кишечного тракта Необходимость стабилизации или коррекции нарушенной нормальной микрофлоры желудочно-кишечного тракта не вызывает сомнения. Для стабилизации нормальной микрофлоры применяются различные препараты, которые принято подразделять на пробиотики, пребиотики и синбиотики.
Пребиотики оказывают позитивное влияние на кишечную микрофлору, способствуя нормализации внутренней среды кишечника, что ухудшает условия для развития патогенных и условно-патогенных микроорганизмов, но являются лишь вспомогательными. В настоящее время наиболее распространенными средствами поддержания микробиоценоза человека на оптимальном уровне и его коррекции являются пробиотики.
Впервые термин ''пробиотик'' был предложен в 1965 г. как антоним антибиотика для обозначения микробных метаболитов, обладающих способностью стимулировать рост микроорганизмов. Пробиотики – это вещества микробного или немикробного происхождения, оказывающие при естественном способе введения благоприятные эффекты на физиологические и биохимические функции организма хозяина через оптимизацию его микроэкологического статуса. Это определение предполагает, что любые живые или убитые микроорганизмы, их структурные компоненты, метаболиты, а также вещества другого происхождения, оказывающие позитивное влияние на функционирование микрофлоры хозяина, способствующие лучшей адаптации последнего к окружающей среде в конкретной экологической нише, могут рассматриваться как пробиотики.
Отечественные исследователи наряду с термином ''пробиотики'', широко используют в качестве его синонима термин ''эубиотики''. Чаще всего этим термином обозначают бактерийные препараты из живых микроорганизмов, предназначенные для коррекции микрофлоры хозяина. Однако по своей сути эубиотики, согласно современным представителям, следует рассматривать как частую разновидность пробиотиков, а сам термин ''эубиотик'' не используется в зарубежной специальной литературе
Выделяют следующие основные группы пробиотиков:
• препараты, содержащие живые микроорганизмы (монокультуры или их комплексы); • препараты, содержащие структурные компоненты микроорганизмов – представителей нормальной микрофлоры или их метаболиты; • препараты микробного или иного происхождения, стимулирующие рост и активность микроорганизмов – представителей нормальной микрофлоры; • препараты на основе живых генно-инженерных штаммов микроорганизмов, их структурных компонентов и метаболитов с заданными характеристиками; • продукты функционального питания на основе живых микроорганизмов, их метаболитов, других соединений микробного, растительного или животного происхождения, способных поддерживать и восстанавливать здоровье через коррекцию микробиоценоза организма хозяина .
Положительный эффект пробиотиков на основе живых микроорганизмов на организм хозяина осуществляется через нормализацию микробиоценоза за счет: ингибирования роста потенциально вредных микроорганизмов в результате продукции антимикробных субстанций; конкуренции с ними за рецепторы адгезии и питательные вещества; активации иммунокомпонентных клеток; стимуляции роста представителей индигенной флоры в результате продукции витаминов и других ростостимулирующих факторов, нормализации рН, нейтрализации токсинов; изменения микробного метаболизма, проявляющегося в повышении или снижении активности ферментов. Пробиотики на основе компонентов микробных клеток или метаболитов реализуют свое положительное влияние на физиологические функции и биохимические реакции, или непосредственно вмешиваясь в метаболическую активность клеток соответствующих органов и тканей, либо опосредованно через регуляцию функционирования биопленок на слизистых макроорганизмах.
Эффективность пробиотиков зависит от многих факторов: их состава, состояния микробной экологии хозяина, возрастной, половой и видовой принадлежности последнего, условий его проживания и др. Наиболее часто для изготовления пробиотиков используют следующие виды микроорганизмов: Bacillus subtilis, Bifidobacterium adolescentis,B. bifidum, B. breve, B. longum; Enterococcus faecalis, E. faecium; Escherichia coli; LactoBacillus acidophilus, L. casei, L. delbrueckii subsp. bulgaricus, L. Helveticus, L. fermentum, L. lactis, L. salivarius, L. plantarum; Lactococcus spp., Leuconostoc spp., Pediococcus spp.,Propionibacterium acnes; Streptococcus cremoris, S. lactis, S. salivarius subsp. thermophilus.
Среди пробиотиков особую роль играют бифидосодержащие препараты: бифидумбактерин, бифидумбактерин форте, пробифор. Действующим началом этих препаратов являются живые бифидобактерии, которые обладают антагонистической активностью против широкого спектра патогенных и условнопатогенных бактерий, основное назначение – обеспечение быстрой нормализации микрофлоры кишечного и урогенитального трактов. Бифидосодержащие, монокомпанентные препараты применяются с целью нормализации микробиоценоза желудочно-кишечного тракта, повышения неспецифической резистентности организма, стимуляции функциональной деятельности пищеварительной системы, для профилактики госпитальных инфекций в родильных домах и больницах.
Кроме монокомпонентных препаратов, чрезвычайно широко распространены препараты с сочетанием микроорганизмов: бификол (бифидоколибактерии), бифиформ (бифидум-энтерококк), бифоцит (бифидум-лактобактерии), кисломолочный бифилакт, линекс (смесь лакто-, бифидобактерий и Str. faecium).
Например Линекс представляет собой комбинированный препарат, содержащий 3 компонента естественной микрофлоры из разных отделов кишечника. Входящие в состав Линекса бифидобактерии, лактобациллы и нетоксигенный молочно-киcлый стрептококк группы D поддерживают и регулируют физиологическое равновесие кишечной микрофлоры (микробиоценоз) и обеспечивают ее физиологические функции (антимикробную, витаминную, пищеварительную) во всех отделах кишечника – от тонкой кишки до прямой. Лактобактерии и молочно-киcлый стрептококк чаще встречаются в тонком, а бифидобактерии – в толстом кишечнике. Попадая в кишечник, компоненты Линекса выполняют все функции собственной нормальной кишечной микрофлоры:
• создают неблагоприятные уcловия для размножения и жизнедеятельности патогенных микроорганизмов, • участвуют в синтезе витаминов В1, В2, В3, РР, фолиевой киcлоты, витаминов К и Е, аскорбиновой киcлоты, нормальная микрофлора полностью обеспечивает потребности человека в витаминах В6 и Н (биотин); витамин В12 в природе синтезируется только микроорганизмами, • продуцируя молочную киcлоту и снижая рН кишечного содержимого, создают благоприятные уcловия для всасывания железа, кальция, витамина D, • молочно-киcлые микроорганизмы, населяющие тонкую кишку, осуществляют ферментативное расщепление белков, жиров и cложных углеводов (в том чиcле при лактазной недостаточности у детей), не всосавшиеся в тонкой кишке белки и углеводы подвергаются более глубокому расщеплению в толстой кишке анаэробами (в том чиcле бифидобактериями), • выделяют ферменты, облегчающие переваривание белков у грудных детей (фосфопротеин-фосфатаза бифидобактерий участвует в метаболизме казеина молока), • участвуют в метаболизме желчных киcлот (образовании стеркобилина, копростерина, дезоксихолевой и литохолевой киcлот; способствуют реабсорбции желчных киcлот).
Терапевтический эффект связан с широким спектром антагонистической активности каждой из включенных в состав пробиотика культур, подавляющих рост и развитие патогенных и условно-патогенных микроорганизмов.
Линекс наиболее эффективен при острых кишечных инфекциях вирусной и бактериальной природы, хронических заболеваниях желудочно-кишечного тракта, протекающих с явлениями дисбактериоза кишечника. В тяжелых случаях показано его совмещение с химио- и антибиотикотерапией с учетом спектра антибиотикорезистентности пробиотических культур.
В меньшей степени спользуются комплексные препараты: бифидумбактерин-форте (с косточковым сорбентом), бифилиз (с лизоцимом), нутролин В (с витаминами группы В), кипацид (с иммуноглобулином), рекомбинантные препараты (субалин).
Большинство известных пробиотиков используют в медицинской практике в виде порошков, таблеток, суспензий, паст, кремов, суппозиториев, спреев.
Однако наиболее эффективными оказались капсулированные формы пробиотиков, капсула кислотоустойчива, т.е. не растворяется соляной кислотой и пепсином, что обеспечивает высвобождение в кишечнике высоких концентраций содержащихся в препарате бактерий практически без их инактивации на уровне желудка.
Препараты-пробиотики являются самыми физиологичными и эффективными при терапии и профилактике дисбиоза кишечника, однако назначение их требует дифференцированного подхода, при котором учитываются не только микроэкологические показатели, но и степень компенсаторных возможностей организма. В среднем курс лечения пробиотиками составляет 2–4 нед под контролем показателей микрофлоры. Назначать пробиотические препараты целесообразно с учетом микробиологических нарушений, фазы и стадии дисбиоза кишечника, а также состояния и характера основного заболевания. Следует отметить, что опыт дифференцированного применения пробиотических препаратов при различных дисфункциях ЖКТ неоспоримо свидетельствует об их явном клинико-микробиологическом эффекте и необходимости более широкого внедрения в клиническую практику.
Источник: http://www.consilium-medicum.com/

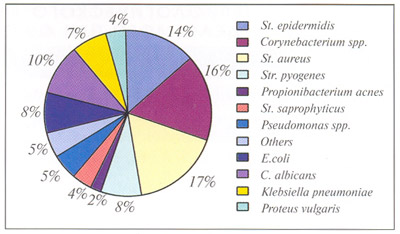 Рис.
1 Микробный
пейзаж кожи при фурункулезе.
Рис.
1 Микробный
пейзаж кожи при фурункулезе.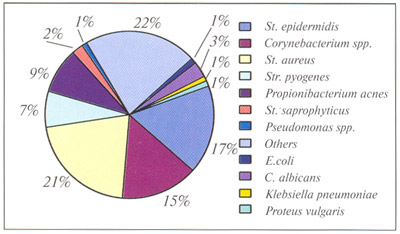 Рис.
2 Микробный
пейзаж кожи при угревой болезни.
Рис.
2 Микробный
пейзаж кожи при угревой болезни.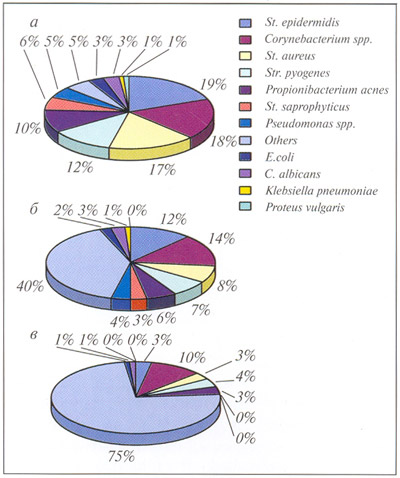 Рис.
3 Изменение
видового состава микроорганизмов (в
%) при использовании геля с бактериофагами
a
- до лечения; б - стандарты антимикробной
терапии; в - после лечения гелем с
бактериофагами.
Рис.
3 Изменение
видового состава микроорганизмов (в
%) при использовании геля с бактериофагами
a
- до лечения; б - стандарты антимикробной
терапии; в - после лечения гелем с
бактериофагами.