
- •Введение
- •1. Углеводы
- •1.1. Строение углеводов
- •1.2. Химические свойства углеводов
- •1.3. Производные углеводов
- •2. Нуклеиновые кислоты
- •2.1. Повреждения структуры днк
- •3. Липиды и клеточные мембраны
- •3.1. Эфиры жирных кислот и глицерина
- •3.2. Липидные компоненты клеточных мембран
- •3.3. Клеточные мембраны
- •4. Аминокислоты, пептиды и белки
- •4.1. Аминокислоты
- •4.2. Пептиды и белки
- •5. Ферменты
- •5.1. Индуцированное соответствие
- •5.2. Эффект сближения реагирующих групп
- •5.3. Дестабилизация связей
- •5.4. Согласованный кислотно-основный катализ
- •5.5. Ингибирование ферментов
- •6. Метаболизм
- •7. Катаболические превращения
- •7.1. Гликолиз
- •7.2. Окислительное декарбоксилирование пирувата
- •7.3. Цикл Кребса
- •7.4. Катаболизм жирных кислот
- •7.5. Катаболические превращения аминокислот
- •8. Окислительное фосфорилирование
- •Nad(p)h fmn убихинон cyt b cyt c1 cyt c cyt aa3 o2
- •9. Фотосинтез
- •10. Основные анаболические процессы
- •10.1. Глюконеогенез
- •10.2.Биосинтез жирных кислот
- •10.3. Биосинтез терпеноидов
- •10.4. Биосинтез аминокислот
- •10.5. Биосинтез пептидов и белков
- •10.6. Образование азотистых оснований и нуклеиновых кислот
- •11. Нейрогуморальная регуляция
- •12. Метаболизм ксенобиотиков
- •13. Клетки и активный кислород
- •Заключение
- •Оглавление
10.3. Биосинтез терпеноидов
Ещё один анаболический путь превращения ацетил-СоА представлен биосинтезом терпеноидов. Он начинается с образования ацетоацетил-СоА по схеме сложноэфирной конденсации, катализируемой тиолазой:
![]()
Затем другая молекула ацетил-СоА реагирует с ацетоацетил-СоА по схеме альдольной конденсации с образованием 3-гидрокси-3-метилглута-рил-СоА при катализе соответствующей синтазой:

Теперь гидроксиметилглутарил-СоА-редуктаза переводит этот тио-эфир дикарбоновой кислоты в дигидроксикарбоновую кислоту, называе-мую мевалоновой кислотой:

Соответствующие киназы переносят на гидроксильные группы этого вещества один фосфатный и один пирофосфатный фрагмент от трёх моле-кул АТФ:
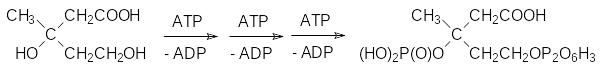
Эта фосфорилированная мевалоновая кислота отщепляет фосфат и декарбоксилируется с образованием изопентенилпирофосфата:

который по схеме гидрирования-дегидрирования может превращаться в диметилаллилпирофосфат. Затем идёт последовательное алкилирование изопентенилпирофосфата: сначала из изопентенилпирофосфата и диме-тилаллилпирофосфата образуется геранилпирофосфат, далее изопентенил-пирофосфат алкилируется геранилпирофосфатом с образованием фарне-зилпирофосфата:


При биосинтезе стероидов две молекулы фарнезилпирофосфата со-единяются по атомам углерода, несущим пирофосфатные остатки (проме-жуточным продуктом является прескваленпирофосфат с циклопропано-вым фрагментом), и образуется сквален:

Сквален окисляется скваленэпоксидазой с образованием 2,3-эпоксида, который в активном центре скваленоксидциклазы сворачивается в струк-туру, обеспечивающую образование тетрациклического ланостерина в ре-зультате протонирования, раскрытия эпоксидного цикла и следующих за этим атак карбокатионов по двойным связям:
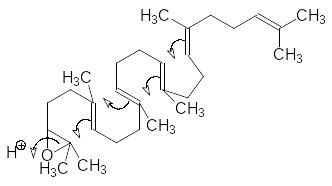
Образовавшийся в результате циклизации карбокатион стабилизиру-ется, отщепляя протон, и превращается в ланостерин с одновременной миграцией двух метильных групп:

Далее идут окислительные превращения с отщеплением метильных групп, с гидрированием двойных связей, дегидрированием с образованием двойных связей и другие реакции, приводящие к образованию холесте-рина, эргостерина и других стероидных липидов, витамина D, стероидных гормонов, желчных кислот.
Изопентенилпирофосфат и диметилаллилпирофосфат являются также исходными продуктами для образования изопреноидных заместителей в витаминах Е и К, в убихиноне; из него образуются витамин А, кароти-ноиды, каучук и другие полиизопрены, фитольная компонента хлорофилла и другие полипренольные остатки.
10.4. Биосинтез аминокислот
Растения и микроорганизмы синтезируют все белковые (протеиноген-ные) аминокислоты и большое число небелковых аминокислот, участвую-щих в биосинтезе самых разных биогенных соединений, включая, анти-биотики, токсины и другие защитные молекулы. При изучении метабо-лизма уже рассматривалось образование аминокислот из -кетокислот в результате действия трансаминаз. Так, например, биосинтез аланина из пирувата, глютаминовой кислоты, глютамина, аспарагиновой кислоты и аспарагина из кетоглутарата и, соответственно, оксалоацетата протекает по схеме, представленной на с. 150. Достаточно простая схема реализуется при образовании пролина из глютаминовой кислоты через её ‑полуаль-дегид с его циклизацией в карбоксизамещённый пирролин и с восстанов-лением С=N‑связи:

Так же легко прослеживается путь от глицеринового альдегида к серину, а глицин образуется из серина в результате отщепления концевой гидроксиметильной группы в виде формильного фрагмента под действием тетрагидрофолатзависимого фермента (см. стр. 106).
В растениях из серина образуется также цистеин в результате алкили-рования сероводорода О-ацетилсерином в присутствии цистеинсинтазы:

В свою очередь цистеин в растениях служит источником серы для образования метионина, а у животных источником серы служит уже эта незаменимая аминокислота. Для получения сбалансированных по амино-кислотному составу кормов метионин производят в промышленном мас-штабе по схеме:


Окислением пропилена кислородом воздуха на оксиде ванадия полу-чают акролеин, который присоединяет метилмеркаптан по олефиновой двойной связи с образованием -метилмеркаптопропионового альдегида. Этот альдегид вступает в реакцию Бухерера-Бергса и превращается в 5‑(2‑метилмеркаптоэтил)гидантоин, который гидролизуется в присутствии щёлочи при нагревании под давлением и превращается в D,L‑метионин. Рацемический метионин способом Гринштейна (ацетилирование по ами-ногруппе и ферментативный гидролиз ацетилазой) можно разделить на стереоизомеры, но для метионина эта операция не является обязательной, поскольку его D‑изомер нетоксичен.
Рассмотрение синтетических путей, ведущих ко всему разнообразию протеиногенных и небелковых аминокислот, можно ограничить схемати-ческим представлением образования в растениях фенилаланина и амино-кислот с алифатическими заместителями (валина, лейцина, изолейцина), поскольку на блокировке их биосинтеза основано гербицидное действие самых распространенных средств борьбы с сорной растительностью – глифосата и сульфонилгетерилмочевин.
Образование всех ароматических соединений в растениях начинается с шикимовой кислоты, образующейся в ряде последовательных реакций из D-эритрозо-4-фосфата и фосфоенолпирувата. 5-Фосфошикимовая кислота реагирует с фосфоенолпируватом при катализе 3-еноилпирувил-5-фосфо-шикиматсинтазой с образованием 3‑еноилпирувил-5-фосфошикимовой кислоты:

которая отщепляет фосфат и превращается в хоризмовую кислоту:

В результате внутримолекулярного алкилирования хоризмовая кис-лота превращается в префеновую кислоту, которая после декарбоксили-рования и дегидратации превращается в фенилпировиноградную кислоту:

Декарбоксилирование и дегидрирование префеновой кислоты приво-дит к 4-гидроксифенилпировиноградной кислоте. Теперь фенилпировино-градная кислота действием трансаминаз превращается в фенилаланин, а 4‑гидроксифенилпировиноградная кислота в тирозин. Из хоризмовой кислоты через стадию образования антраниловой кислоты в клетках растений образуется триптофан.
Взаимодействие фосфошикимовой кислоты с фосфоенолпируватом – одна из немногих биохимических реакций, где фосфоенолпируват реаги-рует в протонированном виде. Предполагалось, что используемый в качестве средства борьбы с сорной растительностью (гербицида) фосфоно-метилглицин (глифосат) является антиметаболитом протонированного фосфоенолпирувата:
-

и

Однако более детальные исследования показали, что сайты связыва-ния этих веществ различны, т.е. речь идёт о неконкурентном ингибиро-вании 3-еноилпирувил-5-фосфошикиматсинтазы фосфонометилглицином. Обработка растений этим веществом приводит к их гибели в течение нес-кольких часов из-за нарушения биосинтеза ароматических кислот.
Биосинтез валина основан на реакции алкилирования пирувата по карбонильному атому углерода гидроксиэтильным остатком, образую-щимся при декарбоксилировании другой молекулы пирувата на тиамин-пирофосфате (ТРР), в активном центре ацетолактатсинтазы:

Молекула ацетолактата претерпевает внутримолекулярную перегруп-пировку: после протонирования атома кислорода карбонильной группы происходит миграция метильной группы в виде карбаниона на карбониль-ный атом углерода, а протон отходит от гидроксильной группы. Продук-том этой реакции становится 2‑кето-3-гидроксиизовалериановая кислота:

Образовавшаяся гидроксикетокислота в результате восстановления NADPH-зависимым ферментом превращается в 2,3-дигидроксиизовалери-ановую кислоту, которая дегидратируется и превращается в -кето-изовалериановую кислоту. Трансаминаза переводит её в валин:


-Кетоизовалериановая кислота является также исходным продуктом для биосинтеза лейцина. По аналогии с образованием валина, но с -кето-бутиратом, образующимся из треонина, идёт биосинтез изолейцина.
Ключевой фермент в биосинтезе алифатических аминокислот – ацето-лактатсинтаза – блокируется сульфонилгетерилмочевинами, например хлорсульфуроном (гербицид Глин):

Это средство борьбы с сорной растительностью, относящееся к треть-ему поколению агрохимических препаратов, имеет нормы расхода около 5 г/га. Получено также большое число его структурных аналогов, которые более избирательны и более легко подвергаются метаболической дегра-дации в растениях и в почве.
