
Химия Нефти и Газа. Методичка по органической химии-1
.pdf
vk.com/club152685050 | vk.com/id446425943
–I-эффект проявляют заместители, которые содержат более электроотрицательные атомы, чем атом углерода:
-F, -Cl, -Br, -OH, -NH2, -NO2, >C=O, -COOH и др.
+I-эффект проявляют заместители, содержащие атомы с низкой электроотрицательностью: -Mg-, -Li; алифатические углеводородные радикалы (-CH3, -C2H5).
|
|
|
|
|
|
|
|
|
|
|
|
|
||
CH3 |
CH=CH2 |
RCH2 MgCl |
||
+I (положительный индуктивный эффект)
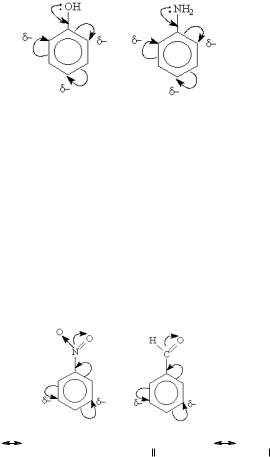
Мезомерный эффект (М) - смещение электронной плотности по цепи делокализованных (сопряженных) π-связей. Этот эффект проявляют заместители, связанные с sp2- или spгибридизованным атомом. Благодаря подвижности π- электронов, М-эффект передается по цепи сопряжения без затухания.
+М-эффектом обладают заместители, повышающие электронную плотность в сопряженной системе. К ним относятся группы, которые содержат атомы с неподеленной парой электронов, способные к передаче этой пары электронов в общую систему сопряжения. +М-эффект характерен для групп - OH и -NH2.
41
vk.com/club152685050 | vk.com/id446425943
р- - Сопряжение в молекуле фенола и анилина.
–М-эффект проявляют заместители с электроотрицательными атомами и смещающие электронную плотность на себя. –М-эффект характерен для групп -CH=O, - COOH, -NO2. Хотя эти группы имеют неподеленные электронные пары, пространственное расположение орбиталей с этими электронами не позволяет им вступать в систему сопряжения. Таким образом, в данном случае заместитель может лишь оттягивать электроны из общей системы сопряжения за счет своей более высокой электроотрицательности.
СH =CH - Cl |
- |
+ |
СH |
-C - CH=CH |
|
+ |
CH |
- CH=Cl |
CH -C= |
CH-CH |
|||
2 |
2 |
|
|
2 |
2 |
|
|
|
|
|
|
3 |
|
+M положительный мезомерный |
|
O |
O |
|
||
(резонансный) эффект |
|
|
|
|
- |
|
|
|
-M отрицательный мезомерный |
|
|||
|
|
|
|
|||
|
|
|
(резонансный) эффект |
|
|
|
ХИМИЧЕСКАЯ СВЯЗЬ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Химическая связь – взаимодействие между атомами, приводящее к образованию молекул или кристаллов.
42
vk.com/club152685050 | vk.com/id446425943
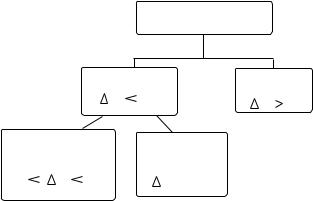
В органических соединениях существует два основных типа химической связи: ковалентная и ионная. Тип связи определяется разностью электроотрицательностей элементов, участвующих в ее образовании.
|
|
|
|
Хи м ическая связь |
|
|
|
|
Ко вален тн ая |
È î í í àÿ |
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
Ко вален тн ая |
|
Ко вален тн ая |
|
|
|
|
ï î ëÿðí àÿ |
|
|
í åï î ëÿðí àÿ |
|
|
0 |
|
|
|
= 0 |
|
|
Электроотрицательность ( ) –способность атома притягивать к себе общие электронные пары. Если разность электроотрицательностей больше чем 1,7 , то можно сказать, что связь ионная.
ИОННАЯ СВЯЗЬ
В органических соединениях ионные связи встречаются довольно редко, т.к. атом углерода не склонен ни терять, ни приобретать электроны с образованием ионов. Тем не менее, ионная связь присутствует в соединениях, где заряд локализован на гетероатомах (например, в органических солях RCOO–Na+, RO–K+, R4N+Cl– и основаниях R4N+OH–).
КОВАЛЕНТНАЯ СВЯЗЬ
Ковалентная связь является основной в органических соединениях. Такая связь образуется путем обобществления
пары электронов двух атомов.
43

vk.com/club152685050 | vk.com/id446425943
Например, образование молекулы водорода из атомов и образование молекулы этана из двух метильных радикалов можно изобразить следующим образом:
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
|
C |
C |
|
|
|
|
|
|
|
|
|
|
КЛАССИФИКАЦИЯ КОВАЛЕНТНЫХ СВЯЗЕЙ ПО ПОЛЯРНОСТИ
Как отмечалось выше, ковалентные связи могут быть полярными и неполярными.
В органических соединениях неполярные связи образуются между двумя идентичными фрагментами молекулы.
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
C |
|
C |
|
|
|
|
C |
|
C |
|
|
|
|
|
|||||||||||
|
|
|
|||||||||||
|
|
|
|||||||||||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
Ковалентная полярная связь. |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
C |
C |
|
|
C |
C |
Cl |
|
|
|
|
|
|
|
|
ПО СИММЕТРИИ ОРБИТАЛЕЙ
Рассмотрим электронный паспорт атома углерода в невозбуждённом (С) и в возбуждённом состоянии (С*):
+6 С 1s2 2s2 2p2 |
+6 С* 1s2 2s1 2p3 |
44

vk.com/club152685050 | vk.com/id446425943
Покажем его с помощью энергетических ячеек:
C C*
C*
ввозбужденном состоянии
|
|
|
2p |
|
|
|
|
|
|
|
|
|
|
|
|
|
2p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2s |
|
|
|
|
|
|
|
|
|
|
2s |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||||
1s |
|
|
|
|
|
|
|
|
|
|
1s |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
В невозбужденном состоянии атом углерода имеет два неспаренных электрона. Для того чтобы вступить во взаимодействие с другими атомами и образовать с ними химические связи углерод должен перейти в возбужденное состояние (C*).
У атома углерода в возбужденном состоянии имеет место энергетически выгодная промотация (перескок) электрона с s-уровня на р-подуровень и углерод в возбуждённом состоянии (С*) имеет четыре неспаренных электрона, следовательно проявляет валентность, равную четырём.
Эти четыре атомные орбитали (АО) имеют разную пространственную конфигурацию и такое состояние для атома углерода энергетически невыгодно.
s - AO p - AO
Более низкой энергии атома углерода соответствуют четыре одинаковые АО, симметрично расположенные в пространстве. Американский ученый Л. Полинг (1931г.) ввел
45
vk.com/club152685050 | vk.com/id446425943
понятие гибридизации, согласно которому углерод участвует в образовании простых σ-связей не s- и р-АО, а гибридными (усреднёнными) АО.
Следует помнить, что гибридизация – это не физическое явление, а чисто математическое. В зависимости от комбинации гибридных и негибридизованных орбиталей атом углерода может находиться в состоянии sp3-, sp2- или spгибридизации.
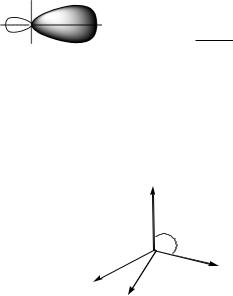
sp3-Гибридизация. I-ое валентное состояние атома углерода.
Этот тип гибридизации характерен для алканов и циклоалканов. В этих соединениях углерод образует простые σ- связи (сигма-связи) не s- и тремя р- АО, а гибридными sр3-АО.
s 3p |
sp |
3 |
АО |
|
|||
4 |
|
|
|
В пространстве 4sр3-АО удалены друг от друга на угол 109°28´ (валентный угол).
Электроотрицательность (Е) Сsр3 =2,5 (по шкале Полинга).
109028’
Углерод-углеродная σ-связь образуется в результате перекрывания двух sр3–атомных орбиталей (АО) соседних
46
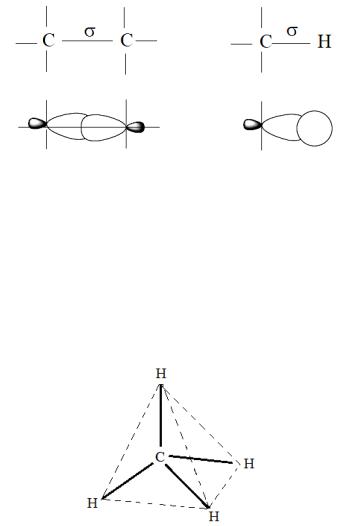
vk.com/club152685050 | vk.com/id446425943
атомов углерода, углерод-водородная σ-связь в результате перекрывания sр3-АО атома углерода и s-АО водорода.
σ-Связь имеет цилиндрическую симметрию относительно прямой линии, связывающей ядра атомов. Максимум перекрывания лежит на этой оси.σ-Связь допускает свободное вращение атомов вокруг нее. Молекула метана с четырьмя идентичными заместителями у атома углерода представляет собой идеальный тетраэдр, геометрия которого обеспечивает минимальное отталкивание между четырьмя σ- связями.
Молекула метана
47
vk.com/club152685050 | vk.com/id446425943
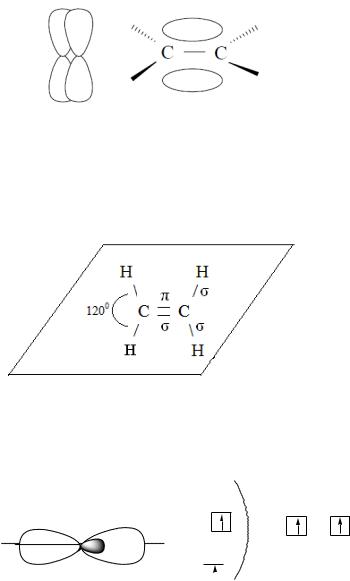
sp2- Гибридизация. II-ое валентное состояние углерода. Этот тип гибридизации характерен для алкенов, алкадиенов, аренов и соединений, содержащих двойную связь.
C*
2p 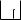
2s 
s 2p sp 2 АО 3
Одна s- и две р-АО атома углерода гибридизуются и образуют три гибридные sр2-АО, расположенные в одной плоскости под углом 120°. Гибридные sр2-АО могут образовывать три σ-связи.
р-АО, незатронутая гибридизацией, располагается перпендикулярно (под прямым углом) к плоскости, в которой лежат три sр2-АО и участвует в образовании π-связи.
π-Связь образуется при боковом перекрывании р-АО соседних атомов углерода и имеет максимальное перекрывание над и под плоскостью.
Электроотрицательность Е Сsр2 = 2.69 (по шкале Полинга).
48
vk.com/club152685050 | vk.com/id446425943
π-Связь
Так, в молекуле этилена три sр2-АО лежат в одной плоскости и участвуют в образовании трёх σ-связей, а р-АО двух атомов углерода образуют π-связь, располагающуюся перпендикулярно к плоскости молекулы.
Молекула этилена
sp - Гибридизация. III-е валентное состояние углерода. Этот тип гибридизации характерен для алкинов и
соединений, содержащих тройную связь.
C*
2p
2s 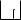
49
vk.com/club152685050 | vk.com/id446425943
s p |
sp |
АО |
|
2 |
|||
|
|
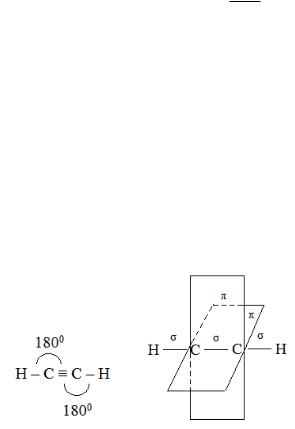
У атома углерода в sр-гибридизованном состоянии имеются две гтбридные sр-АО, расположенные на одной прямой в противоположных направлениях и образующие угол 180°. С их участием образуются две σ-связи. Две взаимно перпендикулярные негибридизованные р-АО участвуют в образовании двух π-связей.
Так в молекуле ацетилена две sр-АО образуют две простые σ-связи, а две р-АО каждого из атомов углерода попарно перекрываются с образованием двух π-связей, расположенных во взаимно перпендикулярных плоскостях.
Электроотрицательность Е Сsр = 2.74 (по шкале Полинга).
Молекула ацетилена
В зависимости от симметрии электронных облаков, в результате перекрывания которых образуется химическая связь, суммарное электронное облако будет иметь различную симметрию, в соответствии с которой они распадаются на три вида: σ-, π- и δ- связи.
50
