
Химия Нефти и Газа. Методичка по органической химии-1
.pdf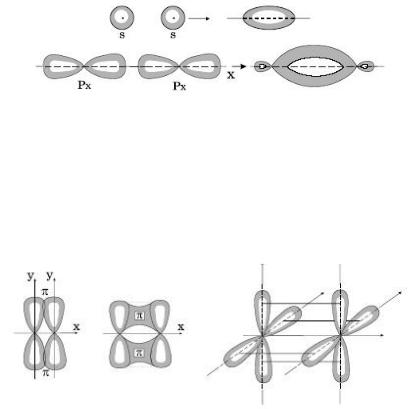
vk.com/club152685050 | vk.com/id446425943
σ-Связь осуществляется при перекрывании облаков вдоль линии, соединяющей центры атомов, при этом максимальная электронная плотность достигается в межъядерном пространстве и имеет цилиндрическую симметрию относительно линии, соединяющей центры атомов.
Некоторые примеры образования σ-связей
-связь – ковалентная связь, возникающая при боковом перекрывании негибридных p-орбиталей .При этом локализованные p-атомные орбитали делокализуются, образуя-орбитали.
-Cвязь образуется между атомами, уже соединенными-связью, при этом образуются кратные (двойные и тройные) связи.
Примеры π- и δ -связей
δ -Связь образуют только d-электроны за счет перекрывания всех четырех своих лепестков электронных облаков, расположенных в параллельных плоскостях.
51
vk.com/club152685050 | vk.com/id446425943
ПО СПОСОБУ ОБРАЗОВАНИЯ
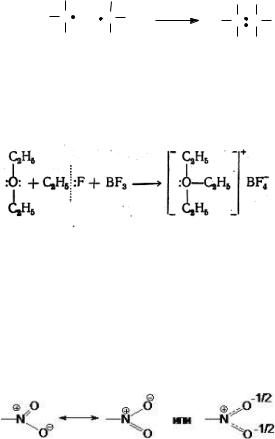
Обменный механизм. В образовании связи участвуют одноэлектронные атомные орбитали. Каждый атом предоставляет 1 электрон для образования общей пары:
|
|
|
|
|
|
|
|
|
|
C |
|
C |
|
|
C |
C |
|
|
|
|
|
|
|
|
|
|
Донорно - акцепторный механизм. Образование связи происходит за счет пары электронов донора и вакантной (свободной) орбитали акцептора. В ряде случаев по донорноакцепторному механизму образуется семиполярная связь.
Сeмипoлярная связь является разновидностью донорноакцепторной связи. Образование этой связи происходит при взаимодействии атома-донора пары электронов и атомаакцептора, не имеющих формальных зарядов. При этом на атоме-доноре возникает положительный заряд, а на атомеакцепторе, предоставившем вакантную орбиталь, – отрицательный. Такая связь наблюдается в случае N-оксидов и азоксисоединений:
52

vk.com/club152685050 | vk.com/id446425943
ХАРАКТЕРИСТИКИ КОВАЛЕНТНОЙ СВЯЗИ
Важными количественными характеристиками ковалентной связи являются энергия связи, ее длина и дипольный момент.
•Энергия связи - энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов. Энергия связи характеризует ее прочность.
•Длина связи - расстояние между центрами связанных атомов. Чем меньше длина, тем прочнее химическая связь.
Связь
С-С С=С
C |
C |
Энергия связи, |
Длина связи, |
кДж/моль* |
нм |
346 |
0.154 |
606 |
0.134 |
828 |
0.120 |
• Дипольный момент связи ( ) - векторная величина, характеризующая полярность связи. Полярность оценивается по дипольному моменту
= q·l
где q -заряд на атоме, l -расстояние между зарядами.В литературе дипольные моменты приводят в дебаях (Д или D); 1 Д = 3,34·10-30 Кл·м, например, (фтороводорода) = 1,75 Д,(воды) = 1,84 Д. Если молекула симметрична, то векторная сумма дипольных моментов равна нулю, например в случае метана, этилена или ацетилена.
Направленность – т. е. связь образуется в направлении максимального перекрытия электронных облаков. Химическая связь, образуемая с участием электронов гибридных
53
vk.com/club152685050 | vk.com/id446425943
орбиталей, более прочная, чем связь с участием электронов негибридных s- и р-орбиталей, так как происходит большее перекрывание.
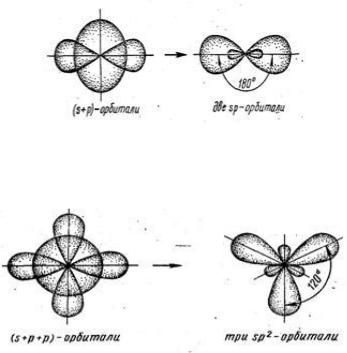
sp-гибридизация – одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°. Молекулы, в которых осуществляется sp-гибридизация, имеют линейную геометрию.
sp2-гибридизация – одна s-орбиталь и две p-орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°. Молекулы, в которых осуществляется sp2-гибридизация, имеют плоскую геометрию.
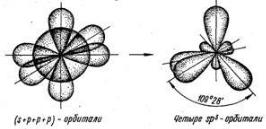
sp3-гибридизация – одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые «гибридные» орбитали, угол между осями которых равен 109°28'. Молекулы, в которых осуществляется sp3-гибридизация, имеют тетраэдрическую геометрию.
54
vk.com/club152685050 | vk.com/id446425943
Выводы
Свойства органических веществ определяются не только строением их молекул, но и числом и характером их взаимодействий с соседними молекулами, а также взаимным пространственным расположением.
Контрольные вопросы:
1.Классификация ковалентной связи.
2.Гибридизация. Виды гибридизации.
3.Длина и энергия С-С связи.
4.Что такое дипольный момент связи? 5.Что такое электроотрицательность?
6.Эффект сопряжения.
СВОЙСТВА АЛИФАТИЧЕСКИХ УГЛЕВОДОРОДОВ. АЛКАНЫ.
СТРОЕНИЕ АЛКАНОВ
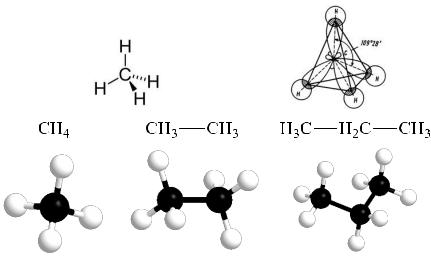
Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Молекулярная формула рассчитывается, используя общую формулу для гомологического ряда: СnH2n+2. Каждый атом углерода в молекулах алканов находится в состоянии sp3- гибридизации — все 4 гибридные орбитали атома С равны по
55
vk.com/club152685050 | vk.com/id446425943
форме и энергии, 4 электронных облака направлены в вершины тетраэдра под углами 109°28'. За счёт одинарных связей между атомами С возможно свободное вращение вокруг углеродной связи. Тип углеродной связи — σ-связи, связи малополярны и плохо поляризуемы. Длина углеродной связи — 0,154 нм. Их низкая реакционная способность лежит в основе второго их названия – парафины.
Метан |
Этан |
|
Пропан |
|
Формулы и названия ряда алканов |
|
|
Название |
Формула |
Название |
Формула |
CH4 |
Метан |
C9H20 |
Нонан |
C2H6 |
Этан |
C10H22 |
Декан |
C3H8 |
Пропан |
C11H24 |
Ундекан |
C4H10 |
Бутан |
C12H26 |
Додекан |
C5H12 |
Пентан |
C13H28 |
Тридекан |
C6H14 |
Гексан |
C14H30 |
Тетрадекан |
C7H16 |
Гептан |
C18H38 |
Октадекан |
C8H18 |
Октан |
C20H42 |
Эйкозан |
56
vk.com/club152685050 | vk.com/id446425943
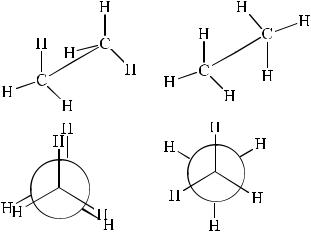
Фрагменты молекул могут свободно вращаться относительно друг друга вокруг С–С связей, а потому форма молекулы непрерывно меняется. Таким образом, для алканов характерно наличие конформеров (проекции Ньюмена). В бутане валентный угол С–С–С несколько больше обычного и составляет 112о, так как две метильные группы больше по размерам, чем атомы Н, и располагаются дальше друг от друга.
Свободное вращение атомов или групп атомов вокруг σ- связи создает возможность свободно менять расположение атомов в молекуле. Молекула представляет множественный набор возможных конформаций. Конформациями или поворотными изомерами являются наиболее устойчивые по энергии изомеры. Конформации изображают обычно в виде проекционных формул Ньюмена, которые ниже сопоставлены с козельными структурами.
CH3-CH3
этан
Формулы
Ньюмена
заслоненная |
заторможенная |
конформация |
конформация |
|
(более устойчивая) |
57
vk.com/club152685050 | vk.com/id446425943
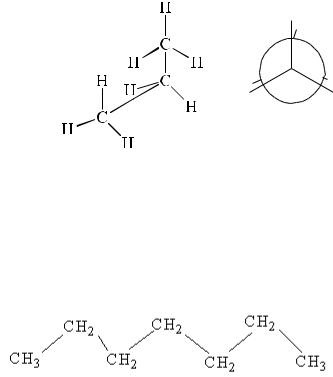
Промежуточные конформации называют скошенными.
CH3-CH2-CH3
пропан
|
H |
|
CH |
|
3 |
H |
H |
H |
H |
Наиболее устойчивая конформация «заторможенная», где СН3 группы максимально удалены друг от друга, и наибольшие по размеру группы расположены друг против друга. Конформация та предпочтительнее, где отталкивание минимально и максимально удалены друг от друга наибольшие по размеру группы. Поэтому для алканов предпочтительнее зигзагообразная форма.
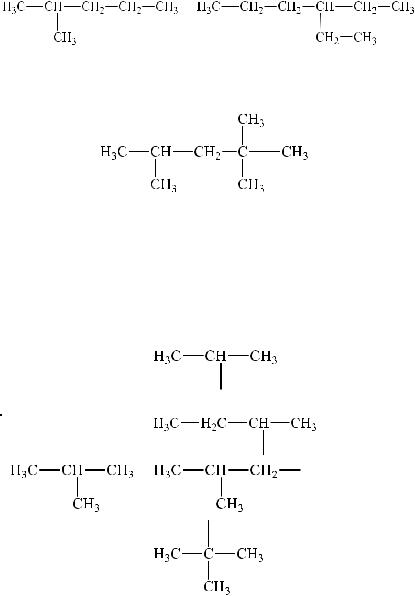
НОМЕНКЛАТУРА АЛКАНОВ.
ПРАВИЛА ПОСТРОЕНИЯ НАЗВАНИЙ АЛКАНОВ ПО НОМЕНКЛАТУРЕ ИЮПАК
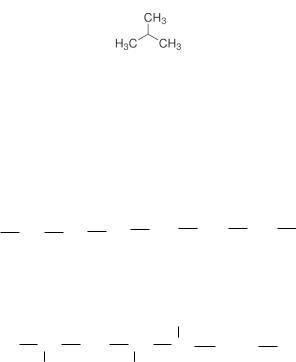
В основе названия алкана лежит самая длинная неразветвленная структура, при этом углеводород с разветвленной цепью рассматривается как продукт замещения атомов водорода на алкильные радикалы. Например, алкан,
58
vk.com/club152685050 | vk.com/id446425943
который обычно называется изобутаном, рассматривается как замещенный пропан, в котором атом водорода замещен на радикал – СН3(метил).
2-метилпропан
Чтобы назвать алкан, необходимо:
1.Найти самую длинную углеводородную цепь.
2.Пронумеровать цепь, начиная с того конца к которому ближе разветвление.
3.Назвать вещество, перечисляя заместители, указывая их количество и положение.
1 |
2 |
3 |
|
4 |
|
5 |
|
6 |
7 |
8 |
||||
|
|
|
CH |
CH |
CH |
|||||||||
CH |
CH |
CH |
|
CH |
CH |
|
||||||||
|
|
2 |
2 |
2 |
3 |
|||||||||
3 |
|
|
|
|
|
|
|
CH(CH ) |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
CH |
|
CH |
|
|
|
|
|
|
||||
|
3 |
3 |
|
|
|
|
|
3 2 |
|
|
|
|
||
|
|
2,3-диметил-4-изопропилоктан |
|
|||||||||||
|
|
2,3-диметилбутан-4-изопропилоктан |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|
|
1 |
2 |
3 |
|
|
|
|
4 |
5 |
3 |
|
|
|||
|
|
|
|
|
6,7,8 |
|
9 |
|||||||
СH |
|
CH |
|
CH |
|
|
|
CH |
|
CH |
|
|||
|
|
|
|
|
|
(CH ) |
CH |
|||||||
3 |
|
|
|
|
2 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
2 3 |
3 |
|
|
|
CH |
|
|
|
|
|
|
C H |
|
|
|
|
|
|
3 |
|
|
|
|
|
3 |
7 |
|
|
|
|
||
2,5-
диметил - 4 - пропилнонан 2,5-диметил-4-пропилнонан
Разветвленные алканы получают названия на основе наиболее длинной углеродной цепи с добавлением приставок, обозначающих радикалы боковых цепей (группы, не вошедшие в основную цепь) с цифрами, указывающими, к какому атому углерода цепи они относятся. Нумерацию цепи производят так, чтобы сумма цифр при радикалах была бы наименьшей.
59
vk.com/club152685050 | vk.com/id446425943
2-метилпентан |
3-этилгексан |
Если одна и та же алкильная группа встречается более одного раза, то перед ней ставят приставку ди-, три- и т.д.
2,2,4-триметилпентан
Названия, структурные формулы алканов и соответствующие им радикалы.
Структура и название |
Структура радикала |
Название |
углеводорода |
|
радикала |
СH4 метан |
СH3- |
метил |
|
|
|
CH3-CH3 этан |
CH3-CH2- |
этил |
|
|
|
CH3-CH2-CH3 пропан |
CH3-CH2-CH2- |
н-пропил |
|
|
|
|
|
изопропил |
|
|
|
CH3-(CH2)2-CH3 бутан |
CH3-CH2-CH2-CH2- |
н-бутил |
|
|
вторбутил |
|
|
|
|
|
изобутил |
изобутан |
|
|
|
третбутил |
|
|
|
|
60
