
Химия Нефти и Газа. Методичка по органической химии-1
.pdf
vk.com/club152685050 | vk.com/id446425943
Рис. 2 - Взаимное перекрывание 2р-орбиталей в молекуле бензола.
|
Н |
0,140 нм |
Н |
|
|
|
|
|
|
|
|
||
|
|
С |
С |
|
|
|
Н |
С |
0 |
|
С |
Н |
. |
|
|
120 |
|
0,109 нм |
||
|
|
|
|
|
||
|
|
С |
С |
|
|
|
|
Н |
|
|
Н |
|
|
В настоящее время нет единого способа графического изображения молекулы бензола с учётом его реальных свойств. Практически это и невозможно сделать. Но чтобы подчеркнуть выравненность π-электронной плотности в молекуле бензола, прибегают к помощи следующих формул:
.
Главной особенностью ароматических углеводородов является равномерное распределение π-электронной плотности в молекуле. Единая устойчивая замкнутая система π-электронов в циклической молекуле – основной признак ароматичности. Необходимым условием для такой делокализации π-электронов является строгая параллельность осей 2р-орбиталей, участвующих в образовании замкнутой π- электронной системы. Поэтому молекулы ароматических соединений обязательно имеют плоское строение. Если же это условие не выполняется, то круговое сопряжение π- электронов нарушается, как например, в молекуле циклооктатетраена. В результате это соединение не является ароматическим.
Для ароматических соединений характерно также
151

vk.com/club152685050 | vk.com/id446425943
определенное число π-электронов в молекуле. Немецкий химик-теоретик Э.Хюккель вывел правило (1931 г.): плоские циклические соединения, имеющие сопряженную систему π- электронов, могут быть ароматическими, если число этих электронов равно
4n + 2 (где п = 0, 1, 2, 3 и т.д.). Другими словами, в ароматических соединениях может содержаться 2, 6, 10, 14 π- электронов и т.д. Это правило строго выполняется только для моноциклических соединений.
НОМЕНКЛАТУРА И ИЗОМЕРИЯ АРЕНОВ
Монозамещённые бензолы
Простые производные бензола называют замещёнными бензола. В этом случае заместитель обозначается приставкой перед словом “бензол”. Так, бензол, в котором один из атомов водорода заменен на этильную группу, называется этилбензолом. Многие бензолы имеют тривиальные названия, которые широко распространены:
|
CH3 |
|
CH CH2 |
CH3 |
CH CH3 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
м етилбен зо л |
вин илбен зо л |
изо п ро п илбен зо л |
метилбензол |
винилбензол |
изопропилбензол |
(òî(толуолëóî ë)) |
(стиро(стиролл)) |
(êóì(кумолî ë)) |
Дизамещённые бензолы |
|
|
Три возможных изомера |
дизамещённых бензолов |
|
обозначаются приставками “орто-, мета-, пара-”:
152

vk.com/club152685050 | vk.com/id446425943
CH |
CH |
CH |
|
CH |
|
3 |
3 |
|
3 |
|
|
|
3 |
|
|
||
|
|
|
|
C H |
|
CH |
|
|
|
2 |
5 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
. |
|
CH |
|
|
|
|
о-диметилбензол |
3 |
CH |
о-этилтолуол |
|
|
м-диметилбензол |
|
||||
о-д |
м-ди етилбензол |
3 |
о- |
тилтолуол |
|
(о-кс л л) |
(м-ксило ) |
|
|
|
|
п-диметилбензол |
|
|
|||
(о-ксилол) |
(м-ксилол) |
п-диметилбензол |
|
|
|
|
|
(п-ксилол) |
|
|
|
|
|
(п-ксилол) |
|
|
|
Если заместители неодинаковы, то их перечисляют перед словом бензол в алфавитном порядке, например, о- пропилэтилбензол.
Если один из заместителей отвечает монозамещенному бензолу с тривиальным названием (например, толуол), то дизамещенный бензол в этом случае называют как производное этого соединения.
Если в одном кольце присутствуют два или более заместителей, их положение можно указать цифрами, учитывая, что номера атомов углерода, у которых расположены заместители, должны быть наименьшими:
CH3
CH |
|
|
|
CH |
|
3 |
CH |
3 |
|||
|
|
|
|
||
1-ì åòèë-4-èçî ï ðî - |
|||||
1-метил-4- |
|
|
|||
п илбен зо л |
|
|
|||
изопропилбензол |
|
||||
(öèì î ë) |
|
|
|
|
|
(цимол) |
|
|
|||
|
|
|
CH |
|
|
|||
CH |
|
|
3 |
|
CH |
|
||
|
|
|
||||||
3 |
|
|
|
|
|
3 |
||
|
|
|
|
|
||||
|
|
|
|
|
||||
|
|
|
|
|
||||
|
|
|
|
|
|
|
||
1,3,5-òðèì åòèë- |
|
|||||||
|
1,3,5- |
|
|
|
||||
áåí çî ë |
|
|
|
|
|
|||
триметилбензол |
|
|||||||
(м ети зилен ) |
|
|
||||||
(метизилен) |
|
|
||||||
CH3
CH3
CH3
1,2,4-
триметилбензол (псевдокумол)
При удалении атома водорода от одного из углеродных атомов бензола образуется фенильная группа С6H5–, а при удалении одного метильного водорода из молекулы толуола –
153

vk.com/club152685050 | vk.com/id446425943
бензильная группа C6H5–CH2–. Общие названия групп, производных от ароматических соединений, - арилы.
Полициклические арены
Углеводороды, в которых два или более бензольных кольца связаны простой связью, в соответствии с числом колец называют би-, тер - и т.д. фенилами, например:
.
бифенил |
n-терфенил |
Ди- и полиарилалканы называются как арилзамещенные алканы:
CH |
CH |
|
2 |
|
|
дифенилметан |
трифенилметан |
. |
|
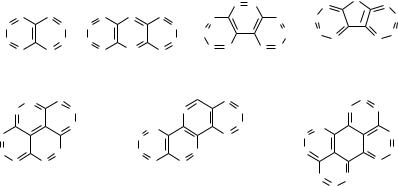
Для многих конденсированных аренов употребляются тривиальные названия:
154
vk.com/club152685050 | vk.com/id446425943
|
|
|
|
|
|
|
|
9 |
10 |
|
|
8 |
9 |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
8 |
1 |
2 |
8 |
9 |
1 |
2 |
8 |
|
|
1 |
7 |
|
|
|
2 |
7 |
|
7 |
|
|
7 |
|
|
2 |
|
|
|
|
|
||
6 |
|
3 |
6 |
|
|
3 |
|
|
6 |
5 |
|
4 |
3 |
||
|
|
|
6 |
5 |
4 |
3 |
|
|
|
||||||
|
|
|
|
|
|
|
|
||||||||
5 |
4 |
|
5 |
10 |
4 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|||||
нафталин |
|
|
антрацен |
|
|
|
фенантрен |
|
|
|
флуорен |
|
|
||
|
|
|
|
|
|
|
. |
10 |
1 |
|
|
1 |
|
2 |
|
9 |
2 |
|
11 |
2 |
|
1 |
3 |
|
3 |
10 |
|
3 |
12 |
|
|
8 |
|
9 |
|
4 |
11 |
|
4 |
7 |
4 |
8 |
|
5 |
10 |
|
5 |
6 |
5 |
7 |
6 |
|
|
|
6 |
пирен |
|
|
хризен |
|
9 |
7 |
|
|
|
|
|
|
|
8 |
|
|
|
|
|
|
|
перилен |
|
Номера, которыми обозначены атомы, используют при необходимости для указания положения заместителей.
ФИЗИЧЕСКИЕ СВОЙСТВА АРЕНОВ
Физические свойства аренов связаны с числом атомов углерода, наличием заместителей и расположением их в молекуле. Арены имеют более высокие температуры кипения, чем соответствующие циклоалканы. Это объясняется плотной упаковкой их молекул, (плоское кольцо), а также более сильным физикохимическим взаимодействием между молекулами вследствие наличия π-электронов.
Гомологи с рядом расположенными алкильными заместителями кипят при более высоких температурах, чем n- изомеры.
Температуры плавления аренов тем выше, чем симметричнее расположены алкильные заместители. Это объясняется тем, что асимметрия затрудняет упорядочение вещества в твёрдом состоянии.
155

vk.com/club152685050 | vk.com/id446425943
Увеличение числа циклов сопровождается повышением температуры плавления. Появление боковых цепей снижает температуру плавления, а удлинение цепи приводит к её повышению.
ХИМИЧЕСКИЕ СВОЙСТВА АРЕНОВ
Реакции присоединения. Арены вступают в реакции присоединения с большим трудом. Для этого требуются высокие температуры, ультрафиолетовое облучение и катализаторы. К ним относятся:
Галогенирование:
|
|
|
Cl |
|
ÓÔ |
Cl |
Cl |
3Cl |
|
|
|
|
0 |
|
|
2 |
40-60 |
|
|
|
|
|
|
|
|
Cl |
Cl |
|
|
|
Cl |
Гексахлоран используется в качестве инсектицида.
Гидрирование:
3H |
Ni |
|
0 |
||
2 |
||
|
200-230 |
Реакции замещения наиболее характерны для аренов. Они протекают в сравнительно мягких условиях. Особенно легко вступают в реакции замещения гомологи бензола.
Галоидирование. В зависимости от условий галоидирования можно получить продукты различной степени замещения:
156

vk.com/club152685050 | vk.com/id446425943
|
0 |
|
|
|
40-60 |
Cl |
хлорбензол |
|
Fe |
||
Cl |
|
|
|
|
|
|
|
2 |
|
|
|
|
0 |
|
|
|
40-60 |
|
|
|
AlCl |
Cl |
|
|
|
|
|
|
3 |
|
о-дихлорбензол |
|
|
|
|
|
|
Cl |
|
H |
|
|
HO SO H |
SO H |
H O |
3 |
2 |
|
3 |
|
|
|
бензолсульфокислота |
|
Сульфирование. Концентрированная серная кислота легко замещает водород на остаток серной кислоты с образованием сульфокислоты.
C H SO H |
2NaOH |
OH |
|||
|
|
|
|||
6 |
5 |
3 |
NA SO |
|
|
|
|
|
|
||
|
|
|
2 |
3 |
|
C H |
Cl |
NaOH |
|
|
|||
6 |
5 |
|
|
Из бензолсульфокислоты и хлорбензола сплавлением их со щёлочью получают фенол.
Основная область применения фенола - производство фенолформальдегидных смол.
Нитрование. При действии на бензол смесью концентрированных азотной и серной кислот получается нитробензол:
H |
|
|
|
|
NO2 |
HO NO2 |
H2SO4 |
H2O H2SO4 |
|
|
Восстановлением нитробензола получают анилин:
157
vk.com/club152685050 | vk.com/id446425943
NO2 |
NH |
|
2 |
3H |
2H O |
2 |
|
|
2 |
Большая часть анилина используется для производства полиуретановых пенопластов.
При полном нитровании толуола получают взрывчатое вещество тротил (2,4,6-тринитротолуол):
CH3 |
|
|
|
NO |
|
|
|
|
2 |
HNO |
|
|
|
|
3 |
NO |
|
CH |
|
|
|
2 |
||
H SO |
|
|
3 |
|
4 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
NO |
|
|
|
|
2 |
Алкилирование. В присутствии таких катализаторов как АlCl3, HF, H2SO4, HCl, BF3 арены вступают в реакцию алкилирования с алкенами, спиртами, галоидзамещёнными алканами. Таким способом в промышленности получают этилбензол и изопропилбензол:
CH2 CH2 |
AlCl3,HCl |
CH2 |
CH3 |
0 |
|
|
|
|
90-100 |
|
|
Каталитическим |
дегидрированием |
из |
этилбензола |
получают стирол, а из изопропилбензола - -метилстирол - ценные мономеры, используемые в производстве каучуков и пластмасс:
CH |
CH |
|
|
|
|
||
2 |
|
|
3 |
|
|
|
|
|
|
|
|
|
0 |
|
|
|
600-630 |
CH |
CH |
||||
|
|
|
|
|
|
||
Fe O |
+ |
Cr O |
|
+ |
|
2 |
|
3 |
3 |
Na OH |
|
|
|||
2 |
|
2 |
|
|
|
||
|
|
|
|
|
158 |
|
|
vk.com/club152685050 | vk.com/id446425943
Алкилированием бензола хлоралканами и дальнейшим сульфированием и нейтрализацией образующихся продуктов получают алкиларилсульфонаты - синтетические поверхностноактивные вещества. Эти вещества с некоторыми добавками называют сульфонолами:
C H |
|
RCl |
RC H |
H SO |
|
RC H SO OH NaOH |
|
|
|||
6 |
5 |
2 |
4 |
RC H |
SO ONa |
||||||
6 |
HCl |
6 |
H O |
|
6 4 |
2 |
H2O |
||||
|
|
|
|
|
6 4 |
2 |
|||||
|
|
|
|
|
2 |
|
|
|
|
|
|
Деалкилирование и гидродеалкилирование. В связи с тем,
что наибольшее значение имеет бензол, его в настоящее время
получают деалкилированием |
или |
|
гидродеалкилированием |
|||||||||
толуола: |
|
|
|
|
|
|
|
|
|
|
|
|
C H CH |
|
|
Ni |
|
|
|
C6H6 |
CO 2H |
|
|||
3 |
|
|
|
|
|
2 |
||||||
6 |
5 |
375 |
0 |
H |
O |
|
|
|
|
|||
|
|
|
, |
|
|
|
|
|
||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
C H CH |
|
Mo, Co, Cr |
C |
H |
|
CH |
|
|||||
3 |
|
|
0 |
|
6 |
|
||||||
6 |
5 |
|
600 |
|
6 |
|
4 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
||
Окисление. Арены (кроме бензола, нафталина и других голоядерных гомологов) легко вступают в реакции окисления. В ряду алкилпроизводных аренов устойчивость к окислению падает с увеличением длины и степени разветвления боковой цепи. При этом образуются кислые соединения. Эти свойства аренов широко используются в промышленности для получения кислородсодержащих производных:
159

vk.com/club152685050 | vk.com/id446425943
CH3 |
COOH |
|
|
|
|
O2 |
|
|
|
кат-р |
|
|
||
CH3 |
COOH |
|
|
|
п-ксилол |
терефталевая кислота |
|||
CH |
|
C |
O |
|
3 |
Î |
|||
|
|
|
||
|
2 |
O |
||
êàò-ð |
||||
C |
O |
|||
CH |
|
|||
3 |
|
|
|
|
о -ксило л |
ф талевы й ан гидрид |
|||
O |
|
|
|
|
2 |
CH |
C |
CH |
|
0 |
3 |
|
3 |
|
120 ,Cu |
|
O |
|
|
|
|
|
||
|
ацетон |
|||
CH(CH ) |
OH |
|
|
|
3 2 |
фенол |
|
|
|
|
|
|
||
С целью получения терефталевой кислоты разработаны также различные процессы окисления толуола. Наиболее устойчивыми к окислению кислородом воздуха являются бензол и нафталин. Однако и они в очень жёстких условиях (высокая температура, катализатор) окисляются с разрывом бензольного кольца:
O2 |
|
C O |
|
|
O |
|
|
V2O5,400-4500 |
|
||
C |
|
||
|
|
O |
|
|
малеиновый ангидрид |
|
|
|
|
O |
|
O |
|
C |
|
|
|
|
|
2 |
O |
. |
|
|
|
||
V O |
5 |
C |
|
2 |
|
||
|
|
O |
|
|
фталевый ангидрид |
|
|
160
