
- •Прикладная химия, 1 курс. Лечебное дело. Педиатрия Занятие № 7. Кислотно-основные свойства органических соединений.
- •1. Тюкавкина н.А., Бауков ю.И. Биоорганическая химия. – м., 1991. – с. 100 – 115.
- •Правила техники безопасности при работе в химической лаборатории.
- •Опыт № 3. Доказательство кислотного характера фенола.
- •Опыт № 4. Цветные реакции фенолов с хлоридом железа (III).
Прикладная химия, 1 курс. Лечебное дело. Педиатрия
Занятие № 6.
Классификация и номенклатура органических соединений.
Биологически важные классы низкомолекулярных соединений.
План изучения теоретического материала
Классификация органических соединений по характеру углеродного скелета.
Классификация органических соединений по характеру функциональных групп. Классы органических соединений.
Виды структурной изомерии.
Основные понятия номенклатуры IUPAC: органические радикалы и их названия; родоначальная структура; характеристические группы; заместители.
Основные принципы заместительной номенклатуры.
Последовательность действий при составлении названия:
Определение старшей характеристической группы;
Выбор родоначальной структуры;
Нумерация атомов родоначальной структуры;
Схема названия соединения по заместительной номенклатуре. Примеры.
Радикально – функциональная номенклатура.
Электронное строение и основные характеристики ковалентных связей.
Правила техники безопасности при работе в кабинете химии.
Литература
Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. – М., 1991. – С.16 – 29.
Конспекты лекций.
Задания для самоподготовки.
1. Выделите родоначальные структуры и назовите по заместительной номенклатуре следующие соединения:
CH3CH2CH2COOH, CH3CH=O, CH3COCH2CH3, CH3CH2CH(OH)-CH2CH2OH,
CH3 (CH2)4SH, CH3CH2CH2NH2, CHCl3, HOOC-CHOH-CHOH-COOH,
NH2CH2CH2SO3H, CH3-CO-CH2COOH, CH2OH-CO-CH2OH, Cl3C-CH=O,
NH2CH2CH2CH2NH2
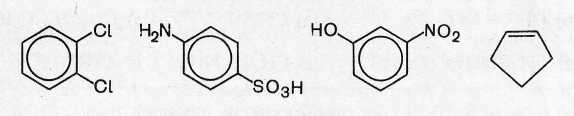
3. Напишите структурные формулы следующих соединений: а) 3-метил-3-этилгексан; б) бутадиен-1,3; в) 1-бромо-2,2,2-трифторо-1-хлороэтан (фторотан); г) 4-этоксианилин (фенетидин); д) нафталин-2-сульфоновая кислота; е) бутендиовая кислота; ж) 3,7-диметилоктадиен-2,6-аль (цитраль); з) 2-метил-4-меркаптопентановая кислота; и) 2-оксопропановая кислота (ПВК).
Прикладная химия, 1 курс. Лечебное дело. Педиатрия Занятие № 7. Кислотно-основные свойства органических соединений.
План изучения теоретического материала
Понятие о кислотных и основных свойствах органических соединений.
Понятия «кислоты» и «основания» по Брёнстеду – Лоури. Общая схема кислотно-основного взаимодействия. Понятия «сопряженная кислота» и «сопряженное основание».
Количественные характеристики кислотности и основности.
Типы органических кислот по виду кислотного центра. Факторы, определяющие стабильность аниона.
Типы органических оснований. Классы органических соединений, проявляющих основные свойства. Факторы, определяющие основность органических соединений.
Водородная связь (межмолекулярная и внутримолекулярная).
Литература для самоподготовки.
1. Тюкавкина н.А., Бауков ю.И. Биоорганическая химия. – м., 1991. – с. 100 – 115.
2. Конспекты лекций.
Задания для самоподготовки.
Расположите в ряд по изменению кислотности следующие соединения: этиловый спирт, фенол, этилмеркаптан. Для наиболее сильной кислоты напишите реакцию солеобразования.
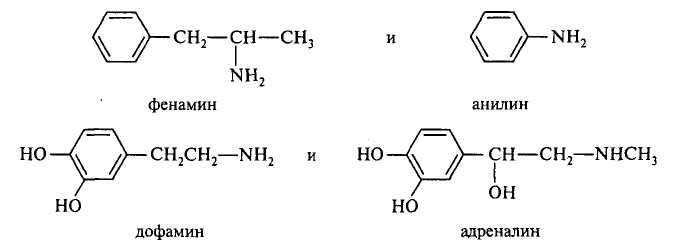
Сравните основность атомов азота в следующих парах соединений:
Укажите в молекуле п-аминосалициловой кислоты кислотные центры и определите порядок уменьшения их кислотности.
Как межмолекулярная водородная связь влияет на физические свойства соединений (на примере этилового эфира и уксусной кислоты)?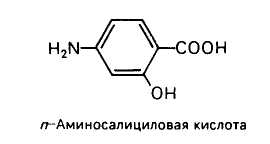
Правила техники безопасности при работе в химической лаборатории.
Прежде чем приступить к практической работе, необходимо изучить имеющиеся в каждой лаборатории инструкции по технике безопасности. Кроме того, следует изучить правила противопожарной безопасности и меры оказания первой помощи при несчастных случаях (ожогах, отравлениях, травмах и т. п.). Необходимо ознакомиться с имеющимися в лаборатории средствами пожаротушения и правилами пользования ими.
Общие положения.
1. Любые работы в химической лаборатории следует выполнять точно, аккуратно, без спешки.
2. Нельзя оставлять без присмотра работающие приборы, электронагревательные устройства, газовые горелки. Нельзя работать в лаборатории одному.
3. На всех емкостях с реактивами должны иметься четко написанные этикетки. Запрещается исправлять надписи на этикетках, наклеивать на старые этикетки новые. Запрещается пользоваться неизвестными реактивами.
4. Нельзя пробовать на вкус какие- бы то ни было вещества. Нюхать вещества следует с осторожностью. Запрещается принимать пищу в лаборатории.
Нельзя проводить какие-либо опыты в загрязненной посуде. Посуду нужно мыть сразу после проведения эксперимента.
Меры оказания первой помощи при несчастных случаях. 1. При порезах рук стеклом следует прежде всего удалить осколки стекла пинцетом или сильной струей воды, затем остановить кровотечение 3% раствором пероксида водорода, смазать рану 5% раствором иода и наложить повязку.
При термических ожогах нужно сразу же смочить обожженное место 5% раствором танина в 40% спирте. Лучше наложить компресс из ваты или марли, смоченных этим раствором.
При ожогах концентрированными кислотами нужно промыть обожженное место водой, а затем 1% раствором гидрокарбоната натрия (соды). При попадании кислоты в глаза их следует промыть 1% раствором гидрокарбоната натрия.
При ожогах концентрированными щелочами пораженное место промывается большим количеством воды, а затем 1% раствором уксусной кислоты. При попадании щелочи в глаза, их следует промывать 2% раствором борной кислоты.
При ожогах бромом следует смыть его спиртом и смазать пораженное место мазью от ожогов. При отравлении парами брома пострадавшему нужно дать понюхать ватку, смоченную спиртом, и вывести его на свежий воздух.
При ожогах жидким фенолом следует растирать побелевший участок кожи глицерином до восстановления нормального цвета кожи.
ЛАБОРАТОРНАЯ РАБОТА № 4.
Кислотно-основные свойства органических соединений.
Качественные реакции на спирты и фенолы.
Опыт № 1. Влияние радикала и количества гидроксильных групп
на растворимость спиртов.
В разные пробирки внесите по 2 – 3 капли этилового спирта, изоамилового спирта, глицерина, маннита. В каждую пробирку добавьте по 4 – 5 капель воды, взболтайте. Запишите в тетрадь формулы соединений и результаты опыта (учтите, что манит – твердое вещество и растворяется медленнее жидкостей).
Опыт №2. Образование хелатных комплексов.
В пробирку поместите 5 капель 2% раствора сульфата меди (II) и 5 капель 10% раствора гидроксида натрия. Образуется голубой студенистый осадок гидроксида меди (II). Содержимое пробирки разделите пополам в две пробирки, в 1-ю из них добавьте 1 каплю глицерина, а во 2-ю – 1 каплю этиленгликоля. Встряхните содержимое обеих пробирок, осадок в них переходит в раствор, который приобретает интенсивный синий цвет.
Эти реакции используются для обнаружения органических соединений, содержащих диольный фрагмент, т.е. гидроксильные группы у двух соседних атомов углерода.
Напишите схемы реакций, лежащих в основе растворения осадка гидроксида меди (II).
Можно ли использовать эту реакцию в случае необходимости различить растворы глицерина и этанола?
