
НЕФТЕГАЗОПРОМЫСЛОВАЯ-1
.pdfvk.com/club152685050 | vk.com/id446425943
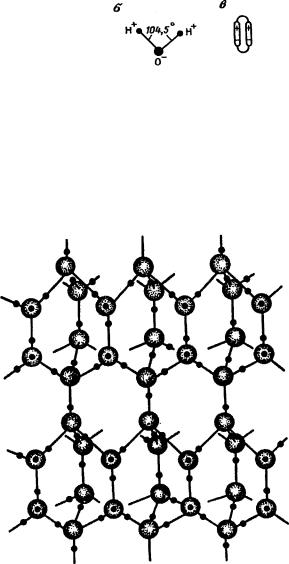
рядов воды. Электроны, располагающиеся на двух других орбитах, представляющих неподеленные пары, создают два полюса отрицательных зарядов той же молекулы. Существование неподеленных электронных пар приводит к образованию двух водородных связей. Две другие водородные связи возникают за счет двух водородных атомов. Поэтому каждая молекула воды в состоянии образовать четыре водородные связи (рис. 40).
Суть водородной связи сводится к тому, что ион водорода, связанный с каким-то ионом другого элемента, способен электростатически притягивать к себе ион того же элемента из другой молекулы. В силу этого молекулу воды можно уподобить тетраэдру, два угла которого заряжены положительно, а два отрицательно.
Таким образом, молекула воды представляет собой электрический диполь. Угол связи в молекуле воды, образованный двумя атомами водорода (Н-О-Н), равен 104,5°.
Разноименные полюса диполей притягиваются друг к другу, чем обусловливается образование более сложных агрегатов, таких как дигидроль (НзО);?, тригидроль (Н20)з и т.д. С ростом температуры и переходом воды в парообразное состояние сложные агрегаты распадаются на более простые, а те в свою очередь на одиночные молекулы. Жидкая вода состоит из более или менее упорядоченных молекул, приближающихся по своему строению к кристаллической решетке. Для льда наиболее устойчивой структурой является тетраэдры, построенные из гидролей. Эти тетраэдры объединены в гексагональную решетку (рис.41), рыхлую и ажурную, поэтому плотность льда меньше плотности жидкой воды.
В силу особенностей строения молекул воды и наличия водородных связей вода обладает целым рядом аномальных свойств:
высокой диэлектрической постоянной (87,74 при 0°С), расширением при замерзании, сильными растворяющими свойствами, высокой скрытой теплотой испарения и плавления и т.д. На структуру воды влияет также магнитное поле, меняя ее свойства. "Омагниченная" вода используется для снижения накипи в котлах, для закачивания в пласты при разработке нефтяных месторождений. При ее закачке в пласт снижается солеобразование в трубах, улучшаются нефтевымывающие свойства вод и т.д. После-прекращения действия магнитного поля некоторое время эти свойства сохраняются. Это объясняется особенностями внутренней структуры воды.
Молекулы воды состоят из водорода, представленного тремя изотопами (протий + 1]-!; дейтерий SH, или Д; тритий SH, или Т), и кислорода, имеющего семь изотопов (^О-^О). Преобладают в
- 188 -
vk.com/club152685050 | vk.com/id446425943
Рис.40. Модель молекулы воды:
а - схема тетраэдрического характера водородной связи в воде; б - угол связи в молекуле воды; в - образование диполями воды ассоциированных молекул (дигидроля, тригидроля)
Рис.41. Гексагональная структура льда воде ^Н и ЧбО. Дейтерий и тритий содержатся в обычной воде в
незначительных количествах. Подавляющее количество изотопов кислорода представлено изотопами ^О, меньше изотопов ^О и ничтожно мало изотопов ^О. Кроме тяжелой воды ДзО известна и сверхтяжелая вода Т^О.
- 189 -
vk.com/club152685050 | vk.com/id446425943
Вода - хороший растворитель различных солей, газов и коллоидов. В настоящее время в подземных водах обнаружено более 86 элементов периодической системы. Такое разнообразие химического состава подземных вод обусловлено их геологической историей и постоянным взаимодействием с веществом земли. В физикохимическом отношении природные воды - это растворы солей, газов и коллоидов. Соли как правило, являясь электролитами, при растворении в воде распадаются на ионы: отрицательно заряженные - анионы, положительно заряженные - катионы. Растворы солей - электролиты проводят электрический ток. Вещества - неэлектролиты при растворении в воде распадаются на нейтральные молекулы, давая истинные растворы, или на агрегаты молекул, образуя коллоидные растворы. В природных водах содержание коллоидов невелико по сравнению с содержанием растворенного ионносолевого комплекса.
В наибольших количествах в подземных водах встречаются шесть главных ионов: анионы Cl-, S042', НСОз" и катионы Na"1",
Са2"*", Mg2"1". Эти вещества, определяющие химический тип воды, относятся к макрокомпонентам, или макроэлементам.
В значительно меньших концентрациях распространены СОз2",
S2-, К."1", Fe2"1", и Fe3"1". Элементы, встреченные в незначительных количествах, называются микроэлементами, или микрокомпонентами. Из их числа наибольший практический интерес представляют ионы и I-, Br , Li4", Sr2"*" и др.
Суммарное содержание в воде растворенных ионов, солей и коллоидов характеризует степень минерализации воды. Минерализация обычно выражается в граммах на 1 кг раствора или на 1 л раствора.
По ГОСТу воды с минерализацией до 1 г/кг относятся к пресным, от 1 до 25 г/кг к солоноватым, от 25 до 50 г/кг к соленым и при минерализации более 50 г/кг к рассолам. Минерализация природных вод колеблется в широких пределах - от долей грамма на 1 кг до сотен граммов на 1 кг.
Растворенные газы находятся во всех подземных водах. Наиболее распространены такие газы, как азот N2, диоксид углерода (углекислый газ) СОз, метан СН4. Кроме этих основных газов в подземных водах растворены такие газы, как кислород 0^, сероводород H^S, аргон Аг, гелий Не, этан С^Н^, пропан СзН@, бутан С4Ню. Этан, пропан, бутан, т.е. углеводородные газы, обычно связаны с нефтегазоносными отложениями. Газы находятся в водах в виде молекулярных растворов. Такие газы,
- 190
vk.com/club152685050 | vk.com/id446425943
как диоксид углерода СОз и сероводород HzS, образуют с ионносолевыми компонентами равновесные системы.
Объем газа (измеренный в нормальных условиях - при давлении 760 мм рт. ст. и температуре 20°С), растворенного в единицах объема воды, называют газонасыщенностью воды. Она представляет собой сумму объемов всех растворенных газов и выражается в смЗ/л,
смЗ/см3 или м3/м3. |
|
|
Давлением |
насыщения |
(упругостью) растворенного газа |
называется то давление, при котором весь газ находится в растворенном состоянии. Упругость растворенного газа равна объему растворенного газа, деленному на коэффициент его растворимости. Эта зависимость, отвечающая закону Генри, имеет применение лишь при упругости менее 5 МПа, так как растворимость газов с ростом давления увеличивается не прямо пропорционально. При сложном составе растворенных газов и высоких давлениях насыщения существует более сложная зависимость.
Коэффициент растворимости газа зависит от минерализации воды в соответствии с уравнением Сеченова:
снижается по мере увеличения минерализации. При росте температур примерно до 100°С растворимость газов уменьшается, при более высоких температурах увеличивается.
Схем классификаций растворенных в подземных водах газов много. Они предложены разными исследователями. (И.С. Старобинцем, В.И. Ермаковым, В.И. Старосельским и др.). Л.М. Зорькин (1973) в классификации растворенных в пластовых водах газов по их составу выделяет четыре класса:
1)углеводородный (метановый), в случае, если С„Н„, >50 %;
2)азотный, когда азота > 50 %;
3)углекислый, когда СОз + Из8 = 50 %!
4)углекисло-азотно-метановый.
Вкаждом классе выделяется тип газа по содержанию компонентов.
Вприродных водах литосферы встречаются разнообразные органические вещества. Они находятся в растворе в ионной, молекулярной, коллоидной формах, а также в виде микроэмульсии. Из органических соединений в водах земной коры встречаются: жирные кислоты, нафтеновые кислоты, фенолы, бензол, толуол, азотосодержащие и фосфорсодержащие вещества, аминокислоты и некоторые другие. Для нефтегазовой гидрогеологии наибольший интерес представляют углеводороды (УВ) и жирные кислоты. Из жидких УВ наиболее распространены ароматические - бензол и его гомологи (толуол, ксилолы),
-191 -
vk.com/club152685050 | vk.com/id446425943
имеющие поисковое значение. Общее содержание органических веществ может быть охарактеризовано величиной Сорг. По данным В.М. Швеца (1982), среднее
содержание Сдрг (мг/л): в грунтовых водах - 25, в пластовых водах продуктивных горизонтов нефтяных месторождений - 110, в приконтурных водах нефтяных месторождений - 370, в приконтурных водах газоконденсатных месторождений - 800.
Из химических свойств воды к наиболее значимым относятся щелочно-кислотные свойства и жесткость.
Щелочно-кислотные свойства воды определяются содержанием в воде водородных (Н*) и гидроксильных (ОН-) ионов. Кислотные свойства водного раствора определяются действием водородных ионов, а щелочные - гидроксильных. Поэтому количественно степень кислотности водной среды может быть охарактеризована концентрацией или активностью иона Н\ а степень его щелочности - концентрацией или активностью ионов ОН". Общие кислотнощелочные состояния водного раствора условно характеризуются концентрацией или активностью водородных ионов, выраженной величиной рН, которая равна -lg(H"1"). При рН = 7 реакция нейтральная. В кислотной среде рН < 7, в щелочной рН > 7. рН подземных вод изменяется в пределах от 6 до 8,5.
Жесткость воды зависит от содержания растворенных солей кальция и магния. Выделяют общую, устранимую и постоянную жесткость. Общая жесткость определяется суммарным содержанием хлоридов, сульфатов и гидрокарбонатов Са2* и Mg2"*". Устранимая жесткость соответствует содержанию Са(НСОз)2 и Mg(HC03)2 , которые при кипячении выделяют осадок (СаСОз и MgC03). Постоянная жесткость представляет собой содержание хлоридов и сульфатов кальция и магния.
В настоящее время жесткость определяют и выражают по содержанию в воде кальция и магния в ммоль/г или мг-экв/г.
Из физических свойств природных вод основными являются плотность, вязкость, сжимаемость, электропроводность, радиоактивность, температура.
Плотность - отношение массы вещества к его объему. Плотность химически чистой воды при температуре 4°С равна 0,999973 г/см3. Но обычно ее принимают равной 1 г/см3.
Под относительной плотностью(р420) понимается отношение плотности вещества при температуре 20°С к плотности
-192
vk.com/club152685050 | vk.com/id446425943
дистиллированной воды при температуре 4°С. Плотность природных вод возрастает с увеличением степени минерализации. Обычно плотность природных вод колеблется в пределах 1-1,4 г/см3. Плотность воды зависит от температуры. Эта зависимость определяется коэффициентом объемного теплового расширения а , показывающим, какую часть первоначального объема тела при 0°С составляет изменение объема при изменении температуры на 1°С .
При увеличении температуры от 0 до 4°С вода уменьшается в объеме, а при дальнейшем ее росте неравномерно увеличивается. Коэффициент объемного расширения воды составляет, 1/град: в интервале 4-10 °С - 6,5-Ю-5, в интервале 10-20°С - 15-Ю-5, в интервале 65-70°С - 58-10-5. Кроме того, с повышением давления вода несколько сжимается.
Вязкость - свойство природных вод, обусловливающее при движении возникновение силы трения. Вязкость воды зависит от температуры и минерализации: она возрастает с ростом минерализации и уменьшается с повышением температуры..
Сжимаемость вод определяется как изменение ее объема под действием давления. Коэффициент сжимаемости /?
показывает, насколько уменьшается объем воды при увеличении давления на одну единицу. Коэффициент сжимаемости зависит от температуры, содержания водорастворенных газов и химического состава воды.
Сжимаемость воды с растворенным газом приближенно вычисляется по формуле:
/^-/? (1+0,05(7),
где G - газонасыщенность.
В недрах под действием давления объем жидкостей уменьшается. Для оценки суммарного воздействия этих факторов используется
объемный коэффициент пластовой воды b -отношение удельного объема жидкости Рдл в пластовых условиях к удельному объему V^ той же жидкости при давлении 100 кПа и температуре 20°С : b = V^IV^. Природные воды характеризуются объемными коэффициентами порядка 1-1,2.
Электропроводность подземных вод имеет важное значения для геофизических исследований. Электропроводность и электрическое сопротивление зависят от химического состава подземных вод и минерализации. О величине электропроводности
13 |
- 193 |
Каналин |
|
vk.com/club152685050 | vk.com/id446425943
можно судить по удельному электрическому сопротивлению, т.е. сопротивлению в омах такого проводника электрического тока, длина в сечение которого равны единице. При геофизических исследованиях за единицу удельного сопротивления берут 1 Ом-м. Подземные воды характеризуются величинами удельных сопротивлений от 0,02 до 1 Ом-м. С увеличением температуры и минерализации удельное сопротивление уменьшается.
Радиоактивность природных вод определяется наличием в них радиоактивных элементов - радия, радона, урана. К радиоактивным относятся воды, содержащие радия более 1- Ю-14 г/л, урана более 3- 10-5 г/л, радона более 1,5 10-20 БК. В водах нефтеносных пластов нередки случаи повышенной радиоактивности.
Для изучения ионно-солевого состава подземных вод используются различные виды химических анализов.
Общий анализ позволяет судить о химизме воды. Он включает определение шести основных ионов: Cl-, S042-, НСОз', Ca2"1",
Mg2-*-, Na"1". Натрий обычно определяется по разности в содержании трех анионов и двух катионов: кальция и магния. Анализ, включающий определение этих шести ионов, плотности и рН воды, называют стандартным анализом.
В нефтегазовой гидрогеологии к стандартному комплексу добавляется определение йода, брома, аммония, бария, стронция, железа, алюминия, органических кислот и их солей и некоторых других.
Из специальных анализов подземных вод следует отметить: санитарный, бактериологический, бальнеологический, различные технические анализы. Санитарный анализ производится для оценки пригодности воды для питьевых целей, технические анализы - для определения пригодности воды, например, для закачки ее в пласт при заводнении, для использования воды в различных парокотельных установках, бактериологический - для установления видов бактерий и их количества. Наиболее полным является бальнеологический анализ, предназначенный для оценки лечебных свойств воды. К комплексу стандартного анализа в нем добавляется изучение газовых и радиоактивных компонентов, микрокомпонентов и т.д.
Анализы вод производятся как в полевых, так и в стационарных условиях в гидрохимических лабораториях. Результаты анализа вод принято изображать в трех формах: масс-ионной, ионноэквивалентной и процент-эквивалентной.
Масс-ионная форма - выражение состава воды в единицах массы отдельных ионов. Масс-ионную форму пересчитывают в
194
vk.com/club152685050 | vk.com/id446425943
Ионы |
нт 35,476 |
|
сг |
||
|
||
so^~ |
(35,5) |
|
НСОз |
||
|
||
Na' |
48,03 (48) |
|
C 2+ |
|
|
ионно-эквивалентную путем деления величин содержания ионов, |
||
выраженных в граммах или миллиграммах, на величину эквивалента |
||
иона. Эквивалентом иона называется частное от деления ионной массы на валентность.
Ниже приведены величины эквивалентов основных ионов:
|
Эквивале |
a2+Mg- |
61,00 |
|
|
|
30,00 |
|
22,997 |
|
(23) |
|
20,035 |
|
(20) |
|
12,16(12) |
Наличие перед химическим символом буквы г означает, что содержание данного элемента выражено в ионно-эквивалентной форме. Если анионы и катионы даны в ионно-эквивалентной форме, то по принципу электронейтральности 2/к = Z^a Используя это равенство и имея данные о содержании в воде пяти ионов, можно найти содержание шестого иона. Так определяется содержание натрия:
г Na = 2>а - (г Ca24' +rMg2+ )
Процент-эквивалентная форма показывает относительную долю каждого иона в общей сумме растворенных ионов. Общая сумма всех ионов, взятых в эквивалентной форме, приравнивается к 100 %, а сумма катионов, равная сумме анионов, составляет 50 %.
Процент-эквивалентная форма позволяет применять различные способы изображения химического состава воды. К числу таких способов принадлежит формула, предложенная гидрогеологом М.Г. Курловым. Она представляет собой псевдодробь, в числителе которой указывают содержание в процент-эквивалентах анионов, а в знаменателе - катионов. Ионы записывают по убывающим величинам.
vk.com/club152685050 | vk.com/id446425943
Ионы, содержащиеся в количестве менее 1 %,не указывают. Перед дробью перечисляют основные компоненты состава растворенных газов и величину
13* |
- 195 - |

vk.com/club152685050 | vk.com/id446425943
а
Рис.42. Способы изображения результатов химического и газового состава вод:
а - формула Курлова; б - график-круг Толстихина; в - график-круг газового состава вод
минерализации в граммах на литр, за дробью проставляют температуру, содержание микрокомпонентов в мг/л и т.д. (рис. 42, а).
Из графиков, характеризующих ионно-солевой и газовый составы вод, наибольшим распространением пользуются круговые диаграммы. Примером может служить график - круг Толстихина (рис. 42, б). Минерализация воды обычно соответствует радиусу круга, взятому в определенном масштабе.
Принимая эквивалентное содержание суммы анионов и катионов соответственно за 100 %, можно найти процентное содержание каждого иона. Такие графики удобны для нанесения анализов вод на карты и профильные разрезы. При помощи графиков-кругов можно изображать и газовый состав вод (рис. 42, в). Радиус круга в определенном масштабе будет изображать общую газонасыщенность, а секторы - процентное содержание каждого газа.
Большое разнообразие химического состава природных вод вызвало необходимость систематизации многочисленных данных и создания химической классификации. За основу классификации исследователи принимали различные признаки и показатели состава вод, поэтому универсальной классификации пока не существует. Среди наиболее известных - классификации Ч. Пальмера, Ч. Кларка, В.И. Вернадского, С.А. Щукарева, О.А. Алекина, В.А. Сулина, Н.И. Толстихина, Л.С. Балашова, М.Г. Валяшко и др.
196
