
- •Тема 6. Процеси виробництв базових технологій хімічної промисловості. Екологічні проблеми
- •6.1. Стан та перспективи розвитку галузі
- •Основні результати реалізації заходів (в млн доларів сша)
- •Технологічні процеси хімічної промисловості Значення хіміко-технологічних процесів
- •Виробництво хімічної продукції
- •Техніко-економічні показники процесів хімічної технології
- •Основні закономірності перебігу хіміко-технологічних процесів
- •Швидкість перебігу хімічних процесів
- •Рівновага в хіміко-технологічних процесах
- •5 .4. Каталітичні процеси
- •Виробничі процеси отримання сірчаної кислоти
- •В иробництво азотної кислоти
- •5 .7. Типові технологічні процеси у виробництві мінеральних добрив
- •Отримання калійних добрив
- •Отримання азотних добрив
- •Отримання фосфорних та комплексних добрив
- •Е лектрохімічні процеси
- •6.3. Термінологічний словник
- •6.4. Навчальні завдання
- •6.4.1. Приклади розв’язання задач
- •Знайдемо, в якій масі аміачної селітри буде міститися обрахована нами маса азоту (aN):
- •Матеріальний баланс отримання карбаміду з 10 t аміаку
- •Після збільшення концентрації водню швидкість прямої реакції змінюється:
- •6.4.2. Задачі для самостійного розв’язання
- •6.5. Завдання для перевірки знань
- •6.5.1. Питання для вивчення теми
Отримання азотних добрив
Азотні добрива поділяють на аміачні, що містять азот у вигляді катіону NH4+, нітратні, що містять азот у вигляді аніону NO3–, аміачно-нітратні та амідні, в яких азот знаходиться у формі NH2–групи. У таблиці 5.7 наведено характеристики азотних добрив.
Усі азотні добрива водорозчинні, добре засвоюються рослинами, проте швидко вимиваються з рясними дощами або при зрошенні з рівня кореневої системи рослин глибше в ґрунт.
На частку карбаміду та нітрату амонію припадає більше 60 % від загального виробництва азотних добрив, тому їх розглянуто детальніше.
Властивості нітрату амонію та карбаміду впливають на технологічний процес їх отримання та економіку використання.
Нітрат амонію (аміачна селітра) — кристалічна речовина, добре розчинна у воді, а також гігроскопічна, тобто легко поглинає вологу з атмосферного повітря, а залежно від температури може існувати в п’яти кристалічних модифікаціях, що розрізняються структурою кристалів. Унаслідок високої розчинності у воді, гігроскопічності та через поліморфні модифікації, що супроводжуються виділенням тепла, добриво легко злежується, що призводить до ускладнень під час використання. Щоб запобігти вказаним недолікам, нітрат амонію слід зберігати за температури, нижчої 32С, випускати в гранульованому вигляді з обробкою гранул речовинами, що утворюють гідрофобну плівку, а також вводити добавки, які перешкоджають поліморфним перетворенням.
У разі швидкого нагрівання до 400—500С або ініціювання (наприклад, удару) речовина розкладається з вибухом:
NH4NO3 = N2 + 2H2O + 0,5O2.
На цьому засновано використання нітрату амонію як компонента різних вибухових речовин — амонітів (суміші з органічними речовинами), амотолів (суміші з іншими вибуховими речовинами) та амоналів (суміші, що містять алюміній).
Порівняно з нітратом амонію карбамід має більший вміст азоту (46,6 %, а в нітраті амонію 34,8 %), не злежується, в сумішах з органічними речовинами не вибухає та значно повільніше вимивається з ґрунтів.
Проте водні розчини карбаміду стійкі тільки до 80С, а за вищої температури розкладаються, що виключає можливість випаровувати такі розчини за атмосферного тиску.
Основою системи технології виробництва аміачної селітри є нейтралізація азотної кислоти газоподібним аміаком
NH3 + HNO3 = NH4NO3 + 149 kJ,
з наступним упарюванням отриманого розчину та грануляцією нітрату амонію.
Процес нейтралізації азотної кислоти аміаком є незворотним, гетерогенним, екзотермічним, хемосорбційним процесом, що відбувається в дифузійній області, і швидкість його обмежується дифузією аміаку з газу до поверхні рідини.
Сумарний тепловий ефект процесу QΣ складається з теплового ефекту реакції нейтралізації Q1 та теплот розведення азотної кислоти Q2 і розчинення нітрату амонію в воді Q3:
QΣ = Q1 – (Q2 + Q3).
Тепловий ефект процесу залежить від концентрації азотної кислоти (діаграма на рис. 5.10).
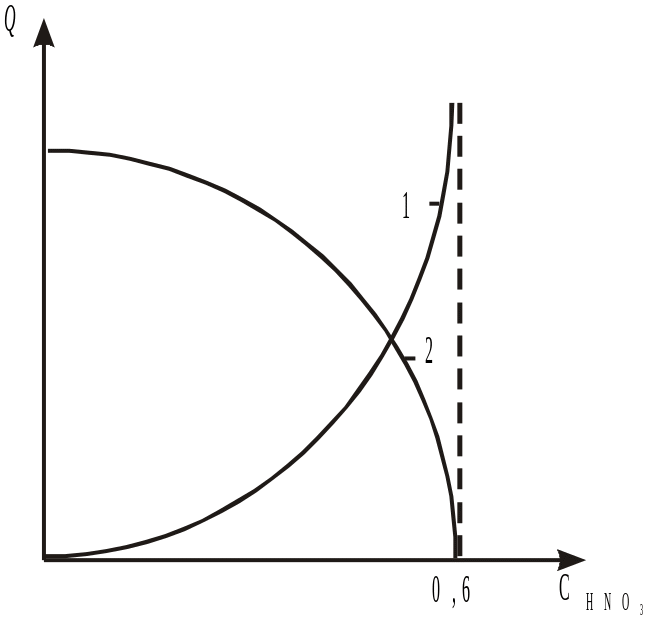
Рис. 5.10. Діаграма залежності теплових ефектів від концентрації азотної кислоти:
1 — тепловий ефект реакції нейтралізації з урахуванням теплоти розведення кислоти, 2 — теплота розчинення нітрату амонію
Як видно з діаграми, зі збільшенням концентрації азотної кислоти збільшується концентрація утворюваного нітрату амонію та кількість виділюваної сокової пари (крива 1).
Дослідженнями показано, що за використання азотної кислоти концентрації 60—65 % та температури процесу близько 70С можливо випарити основну масу води, що вводять з азотною кислотою, й отримати сплав нітрату амонію за рахунок виділюваного в процесі нейтралізації тепла.
Відповідно до принципу використання тепла є кілька варіантів технологічних схем отримання нітрату амонію:
1. Без випаровування розчину, в якому концентрування здійснюється виключно за рахунок теплоти нейтралізації 65 % HNO3. При цьому утворюється 96 % сплаву NH4NO3 і немає необхідності підведення тепла ззовні.
2. З випаровуванням розчину, коли концентрування здійснюється як за рахунок використання тепла нейтралізації, так і тепла, що підводиться ззовні (коли використовують кислоту концентрації 50—58 %).
Схема методу без випаровування наведена на рис. 5.11. Вона проста і лаконічна: в нагрівачах 1 та 2, що обігріваються парою з сепаратора емульсії 4, азотну кислоту та аміак нагрівають і спрямовують у нейтралізатор 3, де внаслідок реакції утворюється емульсія з водного розчину нітрату амонію та водяної пари. Емульсію розділяють у сепараторі 4, причому сплав NH4NO3 надходить в кристалізатор 5, де відбувається процес кристалізації з утворенням на поверхні барабана шару твердого нітрату амонію завтовшки 1 мм, який зрізають ножем 6, і надходить у барабанну сушарку 7.

Рис. 5.11. Технологічна схема отримання аміачної селітри без випаровування води:
1 — підігрівач азотної кислоти, 2 — підігрівач аміаку, 3 — реактор (нейтралізатор), 4 — сепаратор емульсії, 5 — барабанний кристалізатор, 6 — ніж, 7 — барабанна сушарка
Синтез карбаміду відбувається в дві стадії. На першій стадії утворюється карбамат амонію:
2NH3 + CO2 = CO(NH2)(ONH4) + 159 kJ. (1)
На другій стадії карбамат дегідратується з утворенням власне карбаміду:
CO(NH2)(ONH4) = CO(NH2)2 +H2O – 285 kJ. (2)
Процес описують таким сумарним рівнянням:
2NH3 + CO2 = CO(NH2)2 + H2O – 126 kJ.
Отримання карбаміду — це гетерогенний процес у системі Г – Р, що відбувається в кінетичній області. Швидкість його обмежується найбільш повільною стадією дегідратації карбаміду (2). На рівновагу і швидкість реакції впливають тиск, температура та склад системи. Зі збільшенням тиску вихід карбаміду зростає. Вихід його можна збільшити при застосуванні надлишку аміаку порівняно зі стехіометричним. Надлишок NH3 запобігає утворенню побічних продуктів гідролізу карбамату і зміщує рівновагу реакції (2) у бік утворення карбаміду. Цим умовам відповідають такі параметри процесу: температура 180—200С, тиск 20 МPа, надлишок аміаку, причому мольне співвідношення NH3 : CO2 = = 4:1.
Технологічний процес отримання карбаміду складається з чотирьох стадій:
1. Взаємодія оксиду вуглецю та аміаку з утворенням карбаміду.
2. Дистиляція продуктів синтезу з виділенням аміаку та ді- оксиду вуглецю, що не вступили в реакцію синтезу, а також солей амонію.
3. Випаровування розчину карбаміду.
4. Грануляція сплаву карбаміду.
Залежно від способу використання речовин, що відокремлені під час процесу дистиляції, розрізняють дві технологічні схеми виробництва карбаміду: без повернення продуктів дистиляції в цикл (розімкнена схема без рециклу) та з поверненням продуктів дистиляції в цикл.
У першому випадку виділений після дистиляції аміак поглинається азотною кислотою, тобто виробництво карбаміду комбінують з виробництвом аміачної селітри.
У другому випадку продукти дистиляції частково або повністю повертають у цикл на синтез карбаміду, причому існує кілька варіантів: газовий рецикл, коли продукти дистиляції повертаються в газоподібному вигляді, та рідинний рецикл, коли вони повертаються у вигляді розчину солей амонію. Найбільш економічною є схема з повним рідинним рециклом, бо в ній не потрібно стискати аміак та CO2, що повертаються, оскільки це може викликати забруднення трубопроводів унаслідок утворення твердого карбаміду та викликати їх корозію.
Технологічна схема процесу отримання карбаміду, де використовується тиск для розкладу карбамату амонію в плаві, близький до того, що використовується в колоні синтезу, наведено на рис. 5.12. Ця схема має назву стріпінг-процес, і він є найбільш економним з існуючих сьогодні.

Рис. 5.12. Технологічна схема отримання карбаміду:
1 — конденсатор високого тиску, 2 — колона синтезу, 3 — колона, що продувається діоксидом вуглецю, 4 — інжектор, 5 — скрубер, 6 — редуктор, 7 — ректифікаційна колона, 8 — редуктор, 9 — збирач розчину, 10 — холодильник-конденсатор, 11 — випарний апарат, 12 — гранулятор, 13 — транспортер
З конденсатора високого тиску в нижню частину колони синтезу 2 надходить водний розчин карбамату амонію, амонійних солей, аміак та діоксид вуглецю. Утворений сплав надходить у колону 3, яка обігрівається парою, сюди ж протитоком під тиском 15 МРа надходить діоксид вуглецю. З колони 3 суміш, що містить свіжі порції вуглекислого газу, надходить у конденсатор високого тиску 1, куди через інжектор 4 вводять рідкий аміак. У конденсаторі утворюється карбамат, тепловий ефект від цієї реакції використовують для отримання пари. Гази, що не прореагували в колоні синтезу, та пари води надходять у скрубер високого тиску 5, де відбувається їх конденсація, і через інжектор 4 надходять у конденсатор високого тиску 1. Водний розчин карбаміду після колони 3 містить до 5 % карбамату амонію. Щоб його розкласти в редукторі, тиск зменшують до 0,3—0,5 МРа і направляють у верхню частину ректифікаційної колони 7. Рідка фаза (це 70 %-ний розчин карбаміду) стікає вниз і збирається у збирачі розчинів 9. Водяну пару з колони 7 конденсують у холодильнику 10, а розчинений аміак та вуглекислий газ потрапляє в скрубер 2. Розчин карбаміду зі збирача 9 надходить у випарний апарат 11, після упарювання потрапляє в грануляційну башту 12, далі транспортером 13 — на склад.
У таблиці 5.10 наведені витратні коефіцієнти виробництв нітрату амонію та карбаміду.
Таблиця 5.10
ВИТРАТНІ КОЕФІЦІЄНТИ У ВИРОБНИЦТВІ АЗОТНИХ ДОБРИВ
Сировина та енергія на 1 тонну продукту |
Виробництво нітрату амонію |
Виробництво карбаміду |
Аміак, t |
0,214 |
0,576 |
Діоксид вуглецю, t |
— |
0,75 |
Азотна кислота, t |
0,786 |
— |
Вода, m3 |
0,5 |
87 |
Електроенегія, kWh |
25,1 |
120 |
Пара, t |
0,214 |
1,05 |
Удосконалення виробництва карбаміду полягає в об’єднанні виробництв аміаку, нітрату амонію та карбаміду, підвищенні одиничної потужності установок, використанні досягнень наукового прогресу.
