
Посттрансляционные модификации белков
Полипептиды, являющиеся продуктом трансляции, не всегда функционально активны и требуют дополнительных посттрансляционных преобразований.
Фолдинг молекул. Так, еще в процессе синтеза полипептидных цепей на рибосоме при участии шаперонов происходит образование вторичной третичной структуры белков и формирование более выгодной пространственной конформации.
Образование дисульфидных связей – между остатками цистепина имеет важное значение для формирования нативной структуры белков (инсулина, иммуноглобулинов и рибонуклеазы).
Частичный протеолиз сопровождает синтез всех белков на экспорт, равно как и некоторых внутриклеточных белков, в результате молекулы укорачиваются и меняют конформацию.
Присоединение простетической группы происходит при образовании сложных белков
Сборка протомеров в олигомерные белки обеспечивает формирование четвертичной структуры
Модификация аминокислотных остатков свойственна многим белкам.
1. Фосфорилирование гидроксильных групп в остатках серина, треонина и тирозина изменяет функциональную активность многих регуляторных белков.
2. Гидроксилирование остатков пролина и лизина в молекуле коллагена необходимо для формирования фибрилл.
3. Карбоксилирование глутамина в факторах свертывания крови и белках костной ткани.
4. Метилирование аргигина и лизина в молекулах гистонов
5. Йодирование тирозина в белке щитовидной железы.
Ингибиторы матричных биосинтезов
Остановка любого из матричных синтезов опасна для клеток и может вызвать их гибель. В настоящее время описана довольно большая группа разных по структуре соединений, которые являются ингибиторами этих процессов.

Интерфероны – небольшие белки – гликопротеины, которые секретируются клетками макрофагов, В и Т-лимфоцитов в ответ на вирусную инфекцию. Эти белки, связываясь с рецепторами на плазматической мембране зараженных клеток, индуцируют синтез белков и ферментов, способных разрушать мРНК вирусов и прекращать синтез белков на рибосомах. В результате синтез всех белков в инфицированных клетках прекращается. Клетки погибают, но при этом останавливается размножение вирусов и наступает выздоровление.
Регуляция биосинтеза белков у эукариот
В организме человека имеется более 200 различных типов клеток, существенно различающихся по структуре и функциям, хотя количество и структура ДНК в них практически одинаковы. Разный набор и количество белков в дифференцированных клетках разных типов возникает благодаря существованию:
1. механизмов, которые сохраняют стабильную репрессию транскрипции одних генов и прочтение (экспрессию) других на протяжении всей жизни клетки и даже многих ее регенераций, причем в разных тканях стабильной репрессии подвергаются разные гены
2. адаптивной регуляции, обеспечивающей приспособление организма к меняющимся условиям внутренней и внешней среды
На определенных стадиях дифференцировки от гамет до взрослого состояния все гены молекулы ДНК в разные периоды времени и в определенной последовательности экспрессируются. Однако в ядрах дифференцированных клеток хроматин приобретает такую укладку, что остается небольшое число генов способных транскрибироваться. Различают гетерохроматин, в котором ДНК не доступна для транскрипции и эухроматин, имеющий более рыхлую укладку и способный связывать РНК-полимеразу. В области эухроматина на ДНК расположены транскрибируемые гены.
В эукариотических клетках набор и количество белков могут регулироваться на разных уровнях реализации генетической информации в фенотипическую.
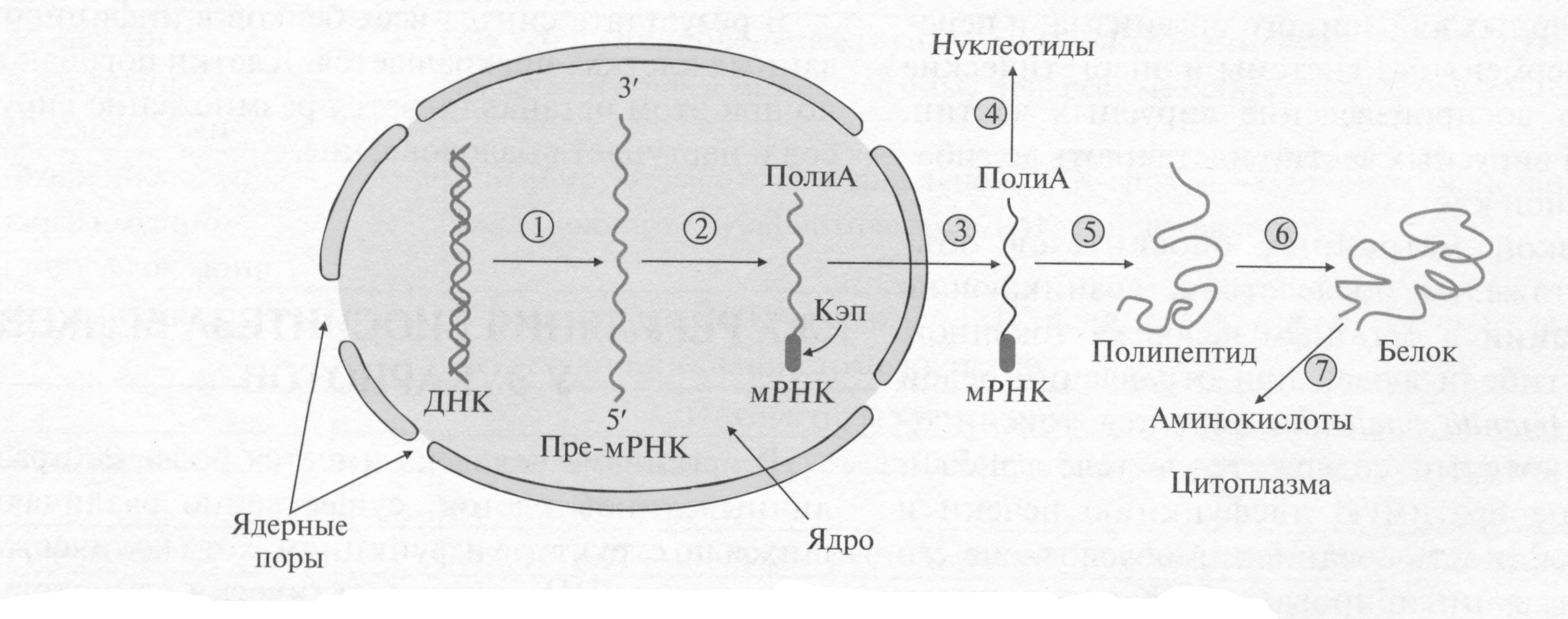
Процесс реализации генетической информации регулируется на этапах:
1. транскрипции
2. посттранскрипционных модификаций
3. транспорта мРНК из ядра в цитоплазму
4. продолжительности жизни мРНК
5. трансляции
6. посттрансляционных превращений полипептидных цепей
7. продолжительности жизни белка
Важнейшим этапом, определяющим набор и количество белков в клетке, является транскрипция. У эукариот большинство транскрибируемых генов кодируют белки, которые обеспечивают жизнеспособность клеток. Гены, которые участвуют в биологическом окислении, синтезе АТФ, построении мембран и нуклеиновых кислот. На ДНК имеются короткие специфические последовательности, которые обеспечивают регуляцию экспрессии генов, именно к ним и присоединяются регуляторные белки.
Если присоединение белков к регуляторному участку ДНК увеличивает скорость транскрипции, то этот участок называют энхансером, а если замедляет транскрипцию, то его называют сайленсером.
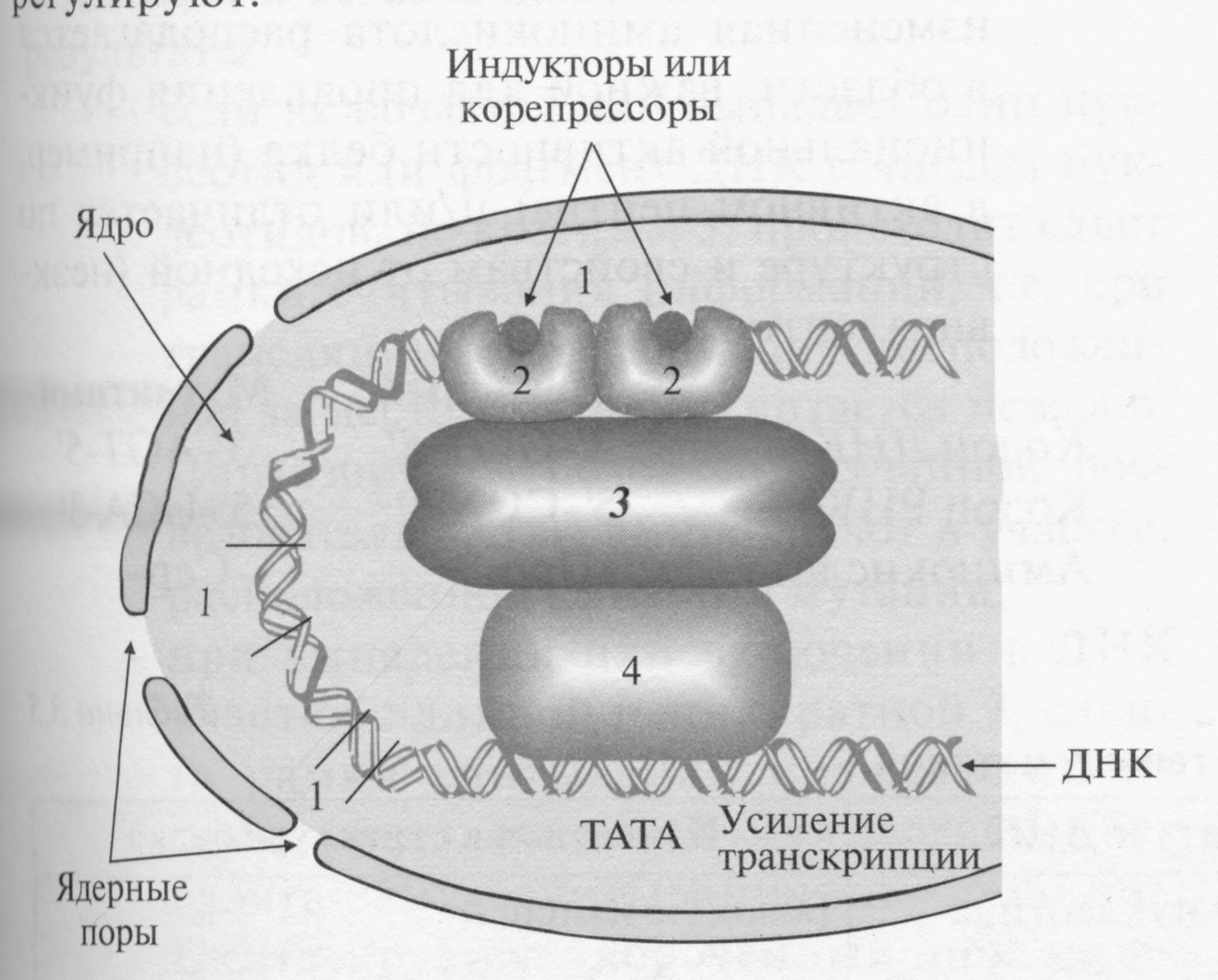
регуляторные участки ДНК
регуляторныек белки
белки-коактиваторы
РНК-полимеразный комплекс
Индукторами или корепрессорами, стимулирующими присоединение регуляторных белков к ДНК, могут быть гормоны, ионы металлов, субстраты или продукты метаболических путей.
У белков-регуляторов имеется 3 важнейших участка:
Участок, по которому белки взаимодействуют с энхансерами или сайленсерами
Участок, к которому присоединяются индукторы или корепрессоры
Участок, взаимодействующий с белками-посредниками или транскрипционными факторами и изменяющий сродство промотора к РНК-полимеразе
Пример: стероидные гормоны кортизол, альдостерон легко проходят плазматическую мембрану и в цитозоле клеток-мишеней присоединяются к белку-рецептору. Образуется комплекс, который проходит ядерную мембрану и связывается с регуляторным участком определенного гена. При присоединении к к энхансеру, изменение конформаци ДНК вызывает индукцию транскрипции.
