
- •Vі. Загальні вказівки про порядок виконання лабораторних робіт
- •§1. Підготовка та виконання
- •§2. Вимоги до звіту і захисту
- •§3. Основні правила техніки безпеки під час роботи в лабораторії
- •Правила безпечної роботи з радіоактивними речовинами та джерелами випромінювання
- •Основні правила техніки безпеки при роботі з приладами, які живляться від електричної мережі
- •Після закінчення роботи
- •Вивчення спектрів випромінювання та поглинання
- •Теоретичні відомості
- •Правила техніки безпеки
- •Завдання до лабораторної роботи
- •Хід роботи
- •Перелік рисунків, таблиць, схем звіту
- •Контрольні запитання
- •Література
- •Визначення постійної Планка за спектром атома водню
- •Теоретичні відомості
- •Правила техніки безпеки
- •Завдання до лабораторної роботи
- •Хід роботи
- •Перелік рисунків, таблиць, схем звіту
- •Контрольні запитання
- •Правила техніки безпеки
- •Завдання до лабораторної роботи
- •Хід роботи
- •Перелік рисунків і таблиць звіту по роботі
- •Контрольні запитання
- •Література
- •Вивчення будови, принципу дії та використання лазерів
- •Теоретичні відомості
- •Правила техніки безпеки
- •Хід роботи
- •Перелік рисунків і таблиць звіту по роботі
- •Контрольні запитання
- •Література
- •Вивчення поглинання іонізуючого випромінювання речовини за допомогою лічильника Гейгера–Мюллера
- •Теоретичні відомості
- •Правила техніки безпеки
- •Завдання до лабораторної роботи
- •Хід роботи
- •Перелік рисунків і таблиць звіту з даної роботи
- •Контрольні запитання
- •Література
- •Розподіл Пуассона
- •Теоретичні відомості
- •Правила техніки безпеки
- •Завдання до лабораторної роботи
- •Хід роботи
- •Перелік рисунків і таблиць в роботі
- •Контрольні запитання
- •Література
- •Лабораторна робота №7 Вивчення теплового випромінювання
- •Теоретичні відомості
- •Правила техніки безпеки
- •Завдання до лабораторної роботи
- •Хід роботи
- •Перелік рисунків, таблиць, схем звіту з даної лабораторної роботи
- •Контрольні запитання
- •Література
- •Лабораторна робота №8 Визначення сталої Планка методом затримуючого потенціалу
- •Теоретичні відомості
- •Правила техніки безпеки
- •Завдання до лабораторної роботи
- •Хід роботи
- •Перелік рисунків, таблиць, схем звіту з даної лабораторної роботи
- •Контрольні запитання
- •Література
- •Хвильові властивості частинок
- •Теоретичні відомості
- •Правила техніки безпеки
- •Завдання до лабораторної роботи
- •Хід роботи
- •Перелік рисунків, таблиць, схем звіту з даної лабораторної роботи
- •Контрольні запитання
- •Література
- •Лабораторна робота №10 Вивчення природної радіоактивності
- •Теоретичні відомості
- •Правила техніки безпеки
- •Завдання до лабораторної роботи
- •Хід роботи
- •Перелік рисунків, таблиць, схем звіту з даної лабораторної роботи
- •Контрольні запитання
- •Література
- •Лабораторна робота №11 Бета-розпад ізотопів атмосферного повітря
- •Теоретичні відомості
- •Правила техніки безпеки
- •Завдання до лабораторної роботи
- •Хід роботи
- •Перелік рисунків, таблиць, схем звіту з даної лабораторної роботи
- •Контрольні запитання
- •Література
- •Лабораторна робота №12 Космічне випромінювання та його властивості
- •Теоретичні відомості
- •Правила техніки безпеки
- •Завдання до лабораторної роботи
- •Хід роботи
- •Перелік рисунків, таблиць, схем звіту з даної лабораторної роботи
- •Контрольні запитання
- •Лабораторна робота №13
- •Підготовка до виконання лабораторної роботи
- •Хід роботи
- •Контрольні запитання
- •Література
Правила техніки безпеки
Під час виконання роботи необхідно виконувати основні правила електробезпеки:
1. Споживачі струму підключати до випрямляча ВС-24М лише в тому випадку, коли він відключений від мережі змінного струму;
2. Пам’ятати, що високовольтне джерело живлення газорозрядних трубок “Спектр-1” і лампа розжарення потребують низької напруги 8 В. При більш високій напрузі прилади можуть зіпсуватися.
Крім того, в даній роботі слід додержуватися правил роботи з ультрафіолетовим випромінюванням ртутно-кварцової лампи ПРК-2.
Підключати ПРК-2 в мережу необхідно тільки через регулятор, напруги РНШ. Спочатку встановити напругу близько 200 В і натисканням кнопки запалити лампу. Після хвилинного прогріву слід знизити напругу до 100 В і виконувати роботу в такому режимі. Для знаходження слабкої червоної лінії спектра ртуті дозволяється короткочасне підвищення напруги ПРК-2 до 150-290 В.
Намагатися зменшити час спостереження спектра ртуті. При появі запаху озону лампу вимкнути з мережі.
Завдання до лабораторної роботи
Завдання 1. Проградуювати спектроскоп по лініях випромінювання ртутно-кварцової лампи ПРК-2 і побудувати градуювальний графік.
Завдання 2. Вивчити неперервний спектр лампи розжарення. Визначити межі видимої частини спектра і довжини хвиль усіх кольорів спектра.
Завдання 3. На основі вивчення спектра атому водню обчислити постійну Рідберга (за формулою (3)).
Завдання 4. Визначити довжини хвиль лінійчатого спектр неону (або гелію).
Завдання 5. Спостерігаючи спектр поглинання розчину марганцевокислого калію, визначить довжини хвиль ліній, які поглинаються.
Хід роботи
1. Використовуючи схему спектроскопа, а також сам прилад, вивчити його будову і принцип дії. Вивчити призначення та будову всіх приладів, які використовується в роботі.
2. Ввімкнути ртутно-кварцову лампу та встановити приймальну щілину спектрометра перед її вікном. Змінюючи положення спектрометра (обертаючі його навколо осі), а також обертаючи його окуляр (регулюючи чіткість зображення), одержати чітке зображення спектру.
3. Проградуювати спектрометр, тобто поставити у відповідність поділкам його барабану довжини хвиль з таблиці 1.
4. Провести розрахунок похибок, вимірювань довжини хвилі за допомогою спектрометра.
Таблиця 1
Спектральні лінії ртуті |
|
Довжина хвилі |
||||
Поділки |
||||||
Кольори |
Яскравість |
І дослід |
ІІ дослід |
ІІІ дослід |
Середнє значення |
|
Червона |
Дуже слабка |
6907 |
|
|
|
|
Жовта |
Дуже яскрава |
5780 |
|
|
|
|
Зелена |
Дуже яскрава |
5461 |
|
|
|
|
Блакитна |
Слабка |
4916 |
|
|
|
|
Синьо-фіолетова |
Яскрава |
4358 |
|
|
|
|
Фіолетова |
Слабка |
4047 |
|
|
|
|
5. Побудувати на міліметровому папері градуювальний графік (рис.9).
6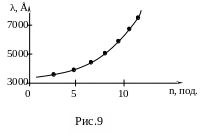 . Після
перевірки градуювальної
кривої викладачем
приступити до вивчення різних спектрів
за завданнями 2–5.
. Після
перевірки градуювальної
кривої викладачем
приступити до вивчення різних спектрів
за завданнями 2–5.
7. Підключити лампу розжарення до випрямляча ВС-24М і обертаючи ручку його реостату, досягнути задовільного свічення. Поставити приймальну щілину спектрометра перед віконцем лампи і згідно п.2 одержати чітке зображення неперервного спектра. Спостерігати його, користуючись градуювальним графіком, визначити межі видимого спектра (червоний і фіолетовий кольори), а також довжини хвиль усіх кольорів спектра.
В останньому випадку встановлювати показник спектрометра на середину ділянки відповідного кольору в спектрі. Дані занести до таблиці 2.
Таблиця 2
Кольори неперервного спектра |
Довжина хвилі , Å |
Межі видимої частини спектра:
|
|
червоний оранжевий жовтий зелений блакитний синій фіолетовий |
|
8. Аналогічно провести вивчення спектрів водню і неону (або гелію). Для цього помістити щілину спектрометра перед віконцем-щілиною високовольтного джерела живлення “Спектр-1”, подаючи на нього від випрямляча постійну напругу 8 В.
При заміні водневої трубки на іншу легким натиском на пластмасовий корпус приладу “Спектр-1” відкрити і відкинути назад кришку тримача трубок. Для установки трубки необхідно брати її за нижній кінець з легким натиском на нижню пружинячу закріплюючу пластину.
9. Результати дослідження спектрів водню і неону (або гелію) занести до таблиць 3 і 4. Таблицю для неону (гелію) скласти наступним чином.
Таблиця 3
Кольори ліній |
Довжина хвилі λ, Å |
|
експериментальні значення |
табличні значення |
|
червоний |
|
|
… |
|
|
фіолетовий |
|
|
Провести порівняльний аналіз експериментальних і табличних значень довжин хвиль спектрів неону (гелію) і водню.
10. На основі результатів вивчення спектра водню за допомогою формули (3) обчислити постійну Рідберга. Обчислення провести з декількома довжинами хвиль .
Провести оцінку похибок обчислень постійної Рідберга. Привести в звіті декілька прикладів розрахунку цих похибок.
11. У спектрі водню поряд з лініями атомарного спектра може спостерігатися молекулярний (смугастий) спектр водню. Це обумовлено тим, що для деяких атомів Н виникає можливість утворення між ними ковалентного зв’язку тобто утворення молекул Н2. Утворення молекули згідно квантової теорії можливо лише при наближенні атомів з антипаралельними спінами. Молекулярний спектр Н2 розташовується між червоною і синьо-блакитною лініями лінійчатого (атомарного) спектра у вигляді порівняно слабких смуг червоно-жовтого і зеленого кольору.
12. Для вивчення спектра поглинання закріпити на віконці лампи розжарення кювету з розчином перманганату калію. За допомогою спектрометра і градуювального графіка визначити середнє значення довжин хвиль темних смуг поглинання.
