
Тема 1 Законы идеальных газов
.pdf
vk.com/club152685050 | vk.com/id446425943
4.4 Закон Рауля-Дальтона
4.4.1 Определение константы фазового равновесия
При низких давлениях для нефтяных фракций иногдаиспользуетсяформулаАшворта ввиде:
f(T ) |
|
1250 |
|
1 |
|
|
|
||
|
||||
|
|
T 108000 307,6 |
||
(4.15)
(4.16)
где P - давление насыщенного пара, ата;
T – температура, К ;
TO – температура кипения при атмосферном давлении, К.

vk.com/club152685050 | vk.com/id446425943
4.4 Закон Рауля-Дальтона
4.4.1 Определение константы фазового равновесия
При повышенных давлениях реальный газ отличается от идеального в место давления подставляется фугитивность:
Ki =fi /p, |
(4.17) |
где fi - фугитивность или летучесть, ата.
Имея ввиду, что =fi /Рi , называется коэффициентом активности, для любого газа можно определить как функция приведенных давления и температурыпо графику
π = p/p кр – приведенное давление, это отношение давления к критическому давлению.
= Т/Ткр – приведенная температура, это отношение температуры к критической температуре.

vk.com/club152685050 | vk.com/id446425943
К определению
Приведенное давление
vk.com/club152685050 | vk.com/id446425943
4.4Закон Рауля-Дальтона
4.4.1Определение константы
фазового равновесия |
Давление |
||
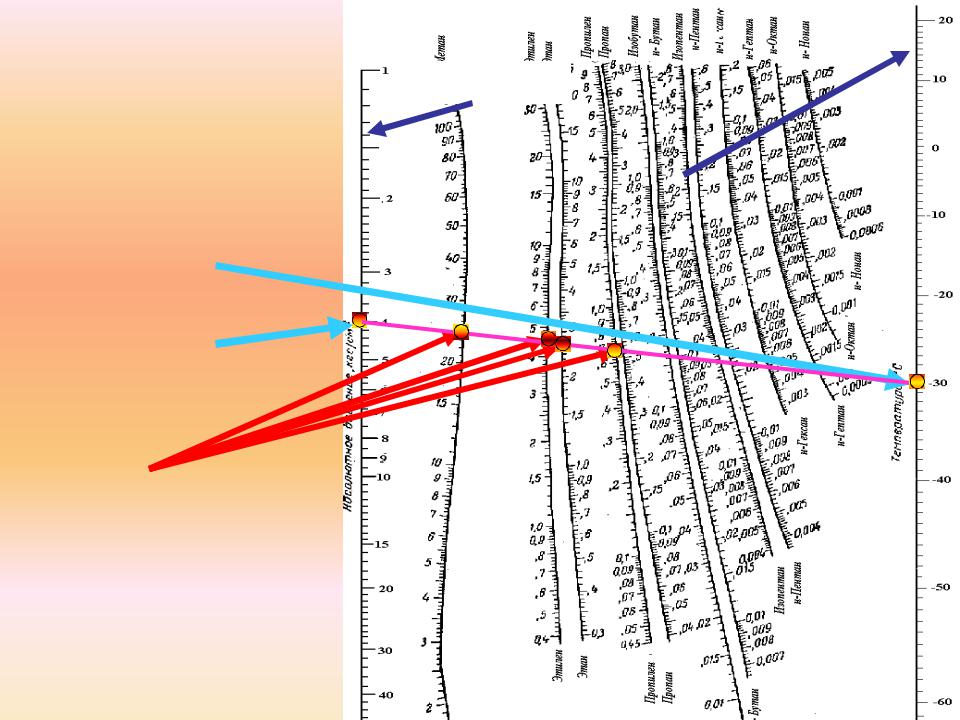
Диаграмма Де-Пристера |
|
Компоненты |
|
|
|
|
|
|
Температура |
||
При заданной |
|
||
температуре t, |
|
|
|
например, -30 ОС |
|
|
|
и давлении P, |
|
|
|
например 4 ата |
|
|
|
На пересечении полученной прямой с кривой соответствующей компоненту находим значения константы фазового равновесия
