
переработка нефти-1
.pdf
vk.com/club152685050 | vk.com/id446425943
Очевидно, что при термолизе углеводородного сырья будут разрываться в первую очередь наиболее слабые связи и образовываться продукты преимущественно с меньшей свободной энергией образования. Таким образом, термодинамический анализ позволяет прогнозировать компонентный состав и подсчитать равновесные концентрации компонентов в продуктах реакций в зависимости от условий проведения термических, а также каталитических процессов. Однако компонентныйсоставиконцентрациипродуктовхимическихреакцийвреальных промышленных процессах не всегда совпадают с результатами термодинамических расчетов.
При проектировании, математическом моделировании, оптимизации, научных исследованиях и решении проблем интенсификации химико-технологических процессов принято пользоваться кинетическими закономерностями химических реакций.
Неследуетпротивопоставлятьхимическуюкинетикуихимическую термодинамику. На основе термодинамических закономерностей проектировщик,инженерилиисследовательустанавливаетвцеломнаиболее благоприятную, с точки зрения выхода целевого продукта, область протекания химических реакций. Химическая же кинетика позволяет в термодинамически разрешенной области рассчитать концентрации (не равновесные, а кинетические) продуктов реакций, материальный баланс, геометрические размеры реакционных аппаратов и оптимизировать технологические параметры процессов.
5.2.2.Основные положения механизма термических реакций нефтяного сырья
Наоснованиимногочисленныхисследований,проведенныхвнашей стране и за рубежом почти за столетний период, в настоящее время общепризнано, что:
—в основе процессов термолиза нефтяного сырья лежат реакции крекинга (распада) и поликонденсации (синтеза), протекающие через ряд промежуточных стадий по радикально-цепному механизму;
—в реакциях крекинга ведущими являются короткоживущие радикалы алкильного типа, а поликонденсации — долгоживущие бензильные или фенильные радикалы.
Свойства и реакции радикалов. Радикалы, имеющие неспаренные (свободные)электроны,образуютсяпригомолитическомраспадеугле- водородовпреимущественнопутемразрываменеепрочнойС–С-связи:
C2H6  2CH3 , а также С–Н-связи: C2H6
2CH3 , а также С–Н-связи: C2H6 H
H + C2H5.
+ C2H5.
564

vk.com/club152685050 | vk.com/id446425943
Гомолитический распад молекул энергетически значительно выгоднее, чем гетеролитический с образованием заряженных ионов.
Радикалы, являясь химически ненасыщенными частицами, обладают исключительно высокой реакционной способностью и мгновенно вступают в различные реакции.
Радикалывысокоймолекулярноймассытермическималостабильны ираспадаютсясобразованиемнизкомолекулярногоболееустойчивого радикала, в том числе водородного:
 C4H8 + CH3
C4H8 + CH3
C5H11
 C5H10 + H
C5H10 + H
При термолизе протекают следующие типы реакций радикалов.
Мономолекулярные реакции распада могут быть двух типов с об-
разованием:
1) монорадикала и молекулы с двойной связью
R•  A + R•' ;
A + R•' ;
2) бирадикала:
R•  •R•'' .
•R•'' .
Из двух типов реакций энергетически более выгоден распад 1-го типа.Бирадикалыпридальнейшемраспадеобразуюттолькомолекулы с двойной связью и далее не участвуют в цепных реакциях термолиза.
Распад радикалов с образованием водородного радикала энергетически менее выгоден, чем образование алкильного радикала.
Если распад радикала возможен по двум путям с образованием
вобоих случаях олефина и алкильного радикала, то энергетически более выгоден распад с образованием большего радикала. С перемещениемсвободнойвалентностиближекцентрурадикалавозрастаетэнергия, необходимая для его распада.
Наиболеевероятныенаправлениярадикалов–требующиенаимень- шей энергии активации. Легче всего происходит распад С–С-связи
вβ-положении к углероду, имеющему неспаренный электрон.
При распаде алкильных радикалов энергетически значительно выгоднее образование алкадиенов и водородного радикала
CH2  CHCH2
CHCH2  CH2
CH2  C
C CH2 + H
CH2 + H , чем образование бира-
, чем образование бира-
дикала CH2 CH CH2 |
CH2 + CH2 CH . |
565
vk.com/club152685050 | vk.com/id446425943
Распад нафтенового радикала с наибольшей скоростью проходит с раскрытием кольца, а не с отрывом водорода с кольца.
Бензильные радикалы малоактивны в реакциях распада, они склонны главным образом к реакциям рекомбинации и поликонденсации.
Реакции изомеризации. В процессах термолиза углеводородов могут происходить, кроме распада, и реакции структурной и скелетной изомеризации радикалов:
CH3 CH CH2 |
CH2 CH CH3 |
CH3 CH CH3 |
|
CH |
|
CH |
CH2 |
3 |
|
3 |
|
|
CH |
|
CH |
HC |
CH |
HC |
CH |
HC |
CH2 |
H2C |
CH2 |
Реакции замещения представляют собой по существу обмен атомом водорода между радикалом ( H , CH3 и С2H5) (присоединяет) и молекулой углеводорода (отдает):
, CH3 и С2H5) (присоединяет) и молекулой углеводорода (отдает):
R• + R'H  RH + R•'.
RH + R•'.
Реакцииприсоединенияимеютместопривзаимодействиирадикала с молекулой, имеющей двойную (т.е. π) связь:
R• + CH2 = CH–R'  R–CH2–CH–R'
R–CH2–CH–R'
(например, C2H5 + C2H4  C4H9 ).
C4H9 ).
Реакция рекомбинации обратна реакции мономолекулярного распада молекулы на радикалы:
R• + R•'  RR' (например, CH3 + C2H5
RR' (например, CH3 + C2H5  CH8 ).
CH8 ).
Реакция диспропорционирования радикалов является обратной
(обратимой)поотношениюкреакциибимолекулярногоихобразования:
CH3 + C2H5 |
|
CH4 + C2H4 , или 2C2H5 + C2H4 |
|
C2H6 . |
|
|
Цепные реакции. Первичной реакцией термолиза нефтяного сырья является образование первичного радикала в результате мономолекулярного распада или бимолекулярного взаимодействия молекул углеводородов.
566

vk.com/club152685050 | vk.com/id446425943
Концентрация радикалов в реакционной системе обычно невелика,
ивероятностьихстолкновениямеждусобойничтожномала.Притермолизеболеезначительнопреобладаютвзаимодействиямеждурадикалом
имолекулами исходного сырья. Поскольку радикал имеет свободный неспаренныйэлектрон,тоегореакциясмолекулами,всеэлектроныкоторых спарены, должна в силу принципа неуничтожимости свободной валентностипривестикобразованиюновоговторичногорадикала.Если последний не является малоактивным, то он, в свою очередь, вступит в реакцию с новой молекулой сырья и т.д.
Так как число радикалов, могущих образоваться при термолизе, велико, на некоторой стадии образуется радикал, принимавший участие в одной из предыдущих стадий, и возникает регулярное чередование двух или более последовательно параллельных элементарных реакций с образованием конечных продуктов. Этот процесс продолжится до тех пор, пока радикал не «погибнет» в результате реакций рекомбинации или диспропорционирования. Реакции такого типа называются
цепными.
Первичная элементарная реакция с образованием первичного радикала из молекул сырья называется реакцией инициирования цепи. Реакции превращения одних радикалов в другие, при которых расходуется сырье, называются реакциями продолжения цепи. Реакции, при которых радикалы гибнут, превращаясь в стабильные молекулы врезультатерекомбинации,диспропорционированияилиобразования малоактивного радикала, называются реакциями обрыва цепи.
Обрыв цепи может произойти также при добавлении или в присутствии в сырье веществ — ингибиторов, которые приводят к замене активных радикалов на малоактивные, не способные к продолжению цепи.
Совокупность элементарных реакций продолжения цепи, повторение которых дает цепной процесс, называют звеном цепи. В результате реакций обрыва цепи на каждый радикал, инициирующий цепной процесс, приходится некоторое конечное число звеньев, называемое
длиной цепи.
Рассмотрим в качестве иллюстрации термический распад нормального пентана.
Инициирование цепи:
 C2H5 + C3H7
C2H5 + C3H7
C5H12  CH3 + C4H9
CH3 + C4H9
 H + C5H11
H + C5H11
567
vk.com/club152685050 | vk.com/id446425943
Распад высокомолекулярных алкильных радикалов:
 C2H4 + C3H7 C5H11
C2H4 + C3H7 C5H11  C3H6 + C2H5
C3H6 + C2H5

 C4H8 + CH3
C4H8 + CH3
 C2H4 + C2H5
C2H4 + C2H5
C4H9  C3H6 + CH3
C3H6 + CH3
 C4H8 + H
C4H8 + H
 C2H4 + CH3
C2H4 + CH3
C3H7
 C3H6 + H
C3H6 + H
Продолжение цепи:
 H
H
 H2 + C5H11
H2 + C5H11
C H |
12 |
+ |
CH |
3 |
CH4 + C5H11 |
5 |
|
|
|
 C2H5
C2H5  C2H6 + C5H11
C2H6 + C5H11
Обрыв цепи:
H + H |
H2 |
H + CH3 |
CH4 |
H + C2H5 |
C2H6 |
CH3 + CH3 |
C2H6 |
CH3 + C2H5 |
C3H8 |
C2H5 + C2H5 |
C4H10 |
В процессе термолиза пентана протекают также реакции изомеризации, циклизации и далее поликонденсации с образованием высокомолекулярных ароматизированных продуктов.
Разветвленные цепные реакции — разновидность цепных реакций, в которых превращение активных промежуточных продуктов приводит к увеличению числа свободных радикалов. Например, одной из элементарных стадий окисления водорода является реакция
H + O2
+ O2 OH +
OH +  O
O
В этой реакции вместо одной свободной валентности у атома водорода образуются три новые свободные валентности — одна у гидроксила и две (т.е. бирадикал) у атома кислорода. Последующая реакция
568

vk.com/club152685050 | vk.com/id446425943
бирадикала кислорода с молекулой водорода приводит к образованию двух новых свободных монорадикалов:
 O
O + H2
+ H2 OH + H
OH + H
Таким образом, одна цепь как бы разветвляется на три, откуда ипроисходиттермин«разветвление».Примеромтакогомеханизмаразветвленияцепейявляютсякромегоренияводородареакциисучастием перекисей углеводородов, например детонационное горение автобензинов.
5.2.3. Химизм газофазного термолиза нефтяного сырья
Термолиз алканов приводит преимущественно к образованию более термостойких низкомолекулярных алкенов и алканов. Из алканов наибольшей термостабильностью обладает метан. Его термическая деструкция термодинамически возможна при температуре выше 560°С. С заметной скоростью распад метана протекает при температуре выше 1000°С. Высокая термостабильность метана объясняется тем, что в его молекуле отсутствуют связи С–С, энергия разрыва которых меньше, чемдлясвязейС–Н.Привысокотемпературномпиролиземетанакроме водорода (и пироуглерода) образуются этилен, этан, ацетилен и арены. Синтез этих продуктов можно выразить следующей схемой:
2CH4 H2 + 2CH3
H2 + 2CH3  2H2 + CH2
2H2 + CH2  3H2 + 2CH
3H2 + 2CH 4H2 + 2C
4H2 + 2C
|
|
|
C2H4 |
C2H2 |
|
C H |
|||||
2 |
6 |
|
|
||
Ароматические углеводороды образуются в результате вторичных реакций синтеза из ацетилена и этилена.
Этанменееустойчив,чемметан:егодеструкцияначинаетсяпритемпературе –500°С. При пиролизе этана образуются преимущественно этилен и водород, а также метан и жидкие продукты, богатые аренами и алкенами.
Пропан и бутан термически менее устойчивы, чем этан. Пропан начинает разлагаться при 460°С, а н-бутан и изобутан — около 435°С.
Основные направления пиролиза пропана:
 C3H6 + H2 C3H8
C3H6 + H2 C3H8  C2H4 + CH4
C2H4 + CH4
 1/2CH4 + 1/2C2H6 + 1/2C3H6
1/2CH4 + 1/2C2H6 + 1/2C3H6
569

vk.com/club152685050 | vk.com/id446425943
Все другие продукты пиролиза пропана (бутадиен, ацетилен, ароматические углеводороды и др.) являются, несомненно, продуктами вторичного происхождения.
Начинаясбутана,притермолизеалкановпреобладающимстановится распадпосвязиС–С.Относительнаяскоростьихтермолизавозрастает с увеличением молекулярной массы, что обусловливается уменьшением энергии разрыва С–С-связей по мере приближения к середине цепи
иувеличения степени разветвленности молекул.
Впроцессе пиролиза н-бутана преобладают следующие две реакции его распада:
 C2H4 + C2H6
C2H4 + C2H6
C4H10
 C3H6 + CH4
C3H6 + CH4
Характерно, что чем выше температура пиролиза бутана, тем больше отодвигается место его распада по С–С-связи к краю молекулы. На это указываетнепрерывноевозрастаниесодержанияметанавгазообразных продуктах реакции вплоть до 900°С. Аналогичные реакции распада характерны для термолиза более высокомолекулярных алканов. Для них приумеренныхтемпературах(400…500°С)наблюдаетсясимметричный разрыв молекулы с образованием олефина и парафина приблизительно одинаковой молекулярной массы. При более высоких температурах
впродуктахихтермолизаобнаруживаютсянизшиеалканыивысокомолекулярныеалкеныиарены,вероятно,какрезультатвторичныхреакций.
Алкеныхарактеризуютсяввидуналичиядвойнойсвязивысокойреакционной способностью в реакциях присоединения, но повышенной, по сравнению с алканами, термостойкостью в отношении реакций распада. Этилен из алкенов наиболее устойчивый. Он всегда содержится
впродуктах термолиза нефтяного сырья как первичный и вторичный продукт их превращений. По термической стабильности он занимает промежуточноеположениемеждуметаномиэтаном.Термическийраспадэтиленазаметноначинаетсяпритемпературе660°С.При400…600°С
восновном протекает его полимеризация:
2C2H4  C4H8
C4H8
Втехжеусловияхвпродуктахпиролизаэтиленасодержатсявысокомолекулярные олефины — продукт сополимеризации бутиленов с этиленом. При температурах 600°С и выше в продуктах термолиза этилена появляются бутадиен и водород в результате дегидрирования бутена-1.
570

vk.com/club152685050 | vk.com/id446425943
Оптимальнаятемператураобразованиядиеновприпиролизеэтилена — 750°С. При температурах выше 900°С бутадиен в продуктах пиролиза исчезает, вероятно, превращаясь по диеновому синтезу в арены:
C
C |
C |
+ |
|
C |
+ 2H2 |
C |
C
Пропилен по термической стабильности уступает этилену и при термолизе образует метан и этилен:
CH3 |
|
CH |
|
CH2 |
|
CH3 + CH2 |
|
CH |
+ H2 |
CH4 |
+ CH2 |
|
CH2 |
|
|
|
|
|
|
||||||||
|
|
|
|||||||||||
|
|
|
|
|
Термолиз бутиленов приводит к образованию метана, пропилена и бутадиена по реакциям:
C H |
8 |
|
CH |
2 |
|
CH |
|
CH |
|
CH2 + H2 ; |
|
|
|
||||||||
4 |
|
|
|
|
|
|
|
|
C4H8 + H2 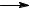 CH4 + C3H6
CH4 + C3H6
При этом одновременно начинается интенсивное образование ароматизированных жидких продуктов.
Впроцессетермолизавысшихалкеновприумеренныхтемпературах основнойреакциейявляетсяполимеризация.Приповышениитемпера- турыразвиваетсяреакцияраспадапоС–С-связи(т.е.обратнаяреакции полимеризации). С малой скоростью происходит также изомеризация алкенов с образованием более стабильных симметричных олефинов.
Сувеличениеммолярноймассыалкеноввозрастаеттенденциякразрыву С–С-связи. Для высокомолекулярных алкенов наличие двойной связи практически не влияет на термостойкость алкенов, и по устойчивости они становятся близкими алканам с тем же углеродным атомом.
Нафтены при термолизе более стабильны, чем соответствующие алканы. Наиболее устойчивыми среди нафтенов являются циклопентан и циклогексан. Реакции термолиза незамещенных циклоалканов протекают по нецепному механизму посредством разрыва одной из С–С-связей и образования бирадикала, который далее распадается на стабильные молекулы:
|
3C2H4 |
CH2 (CH2)4 CH2 |
C2H4 + C4H8 |
|
2C3H6 |
571

vk.com/club152685050 | vk.com/id446425943
Дегидрированиенезамещенныхциклановпоцепномумеханизмуне происходит,таккакпосравнениюснимраспадсобразованиембирадикалапротекаетсозначительнобольшей(нанесколькопорядков)скоростью.Алкилнафтеныпритермолизеведутсебя,какалканы:преимущественно распадаются боковые цепи по радикально-цепному механизму.
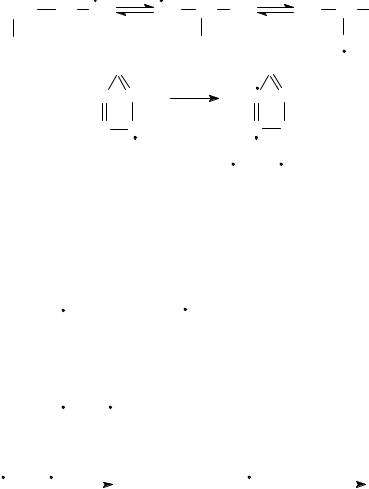
Бициклические нафтены при 600°С и выше подвергаются дециклизации, деалкилированию и дегидрированию:
CH3
+ C2H4 + 2H2
CH3
CH3
+ C3H6 + 2H2
Термолиз ароматических углеводородов. Термостойкость аренов зависит от наличия алкильных цепей в их молекуле. Арены, имеющие С–С-связь, сопряженную с кольцом, распадаются легче алканов преимущественно по 3-му правилу. Основным направлением их превращения является крекинг алкильных цепей и деалкилирование по ради- кально-цепному механизму с участием алкильных радикалов.
Незамещенные (голоядерные) и метилзамещенные арены значительно более термоустойчивы, чем алканы. При термолизе они преимущественно подвергаются дегидроконденсации.
Бензолконденсируетсяпоцепномумеханизмупоследующейсхеме:
C6H6 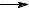 C6H5 + H
C6H5 + H
C6H5 + C6H6 |
|
C6H5 |
|
C6H6 |
|
||||
|
|
C6H5 C6H6 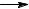 C6H5 C6H5 + H
C6H5 C6H5 + H
H + C6H6
+ C6H6 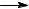 H2 + C6H5
H2 + C6H5
2C6H6  C12H10 + H2
C12H10 + H2
Аналогично происходит дегидроконденсация нафталина:
2C10H8 |
|
C10H7 |
|
C10H7 + H2 |
|
|
572
vk.com/club152685050 | vk.com/id446425943
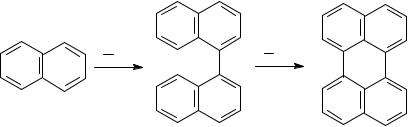
В результате конденсации бензола и нафталина образуются дифенил, динафтил, а также более высококонденсированные арены:
H2 |
H2 |
Нафталин |
Динафтил |
Перилен |
Ароматические углеводороды накапливаются в жидких продуктах термолизатемвбольшихколичествах,чемвышетемпературапроцесса. Припиролизеониявляютсяглавнойсоставнойчастьютакназываемой смолы пиролиза.
Термолизсмесиуглеводородов. Цепные реакции, протекающие при термолизе углеводородов, всегда взаимозаменяемы. Инициирование в радикально-цепных процессах термолиза является самой энергоемкой и, следовательно, лимитирующей стадией. Дальнейшие превращения радикалов происходят со значительно меньшими энергиями активации. Термолиз смеси углеводородов, по сравнению с индивидуальными углеводородами, во многих случаях протекает с большей скоростьювследствиеувеличенияскоростиинициированияактивнымирадикалами, которые не всегда могут образоваться при распаде отдельных классов углеводородов. Отдельные углеводороды, например нафтены, распадающиесявчистомвидепонецепномупутииз-замалойскорости инициирования, в смесях могут превращаться по цепному механизму. В качестве инициаторов цепных реакций могут участвовать и отдельные продукты, образующиеся при термолизе углеводородных смесей.
Основные выводы по химизму газофазного термолиза различных классов углеводородов сводятся к следующему.
1.Алканыподвергаютсяреакциямраспаданапредельныеинепредельные углеводороды. Молярная масса полученных углеводородов постоянно снижается за счет последовательного крекинга.
2.Алкены полимеризуются и вступают в реакцию деструктивной полимеризации. В меньшей степени выражена реакция деполимеризации. Возможна также реакция циклизации.
573
