
переработка нефти-1
.pdfvk.com/club152685050 | vk.com/id446425943
кул, а именно – от способности их поляризоваться. Индуцированный дипольный момент µипропорционален напряженности поляЕ, то есть µи = aЕ, где aхарактеризует степень поляризуемости индуцированной молекулы.
Сила индукционного взаимодействия, как и у ориентационного, обратнопропорциональнаr6,поэтомуонотакжекороткодействующее.Посколькутемператураневлияетнаполяризуемость,индукционноевзаимодействие, в отличие от ориентационного, не зависит от температуры.
Дисперсионное взаимодействие. Молекулы не могут находиться
всостоянии покоя даже при температуре абсолютного нуля, поэтому
впроцессе движения электронов в отдельные моменты времени распределение зарядов может стать несимметричным, то есть может образоваться такая конфигурация, в результате которой молекула приобретает мгновенный дипольный момент. Эти быстро меняющиеся (виртуальные) диполи создают вокруг молекулы электрическое поле, которое индуцирует в соседних молекулах дипольные моменты. Это приводит, в свою очередь, к появлению постоянно возобновляющихся сил притяжения, что обусловливает взаимную ориентацию неполярныхмолекул.Следовательно,природадисперсионноговзаимодействия тоже дипольная и поэтому сила этого взаимодействия обратно пропорциональна r6. Энергия дисперсионного взаимодействия также не зависит от температуры.
Дисперсионное взаимодействие проявляется при взаимодействии не только неполярных, но и полярных молекул и является наиболее универсальнымпосравнениюсостальнымисиламимежмолекулярного взаимодействия.
На дисперсионное взаимодействие приходится главная часть сил притяжения многих полярных молекул. Так, вычисленная энергия когезии метилэтилкетона при 40°С состоит на 8% из энергии ориентационного, на 14% — индукционного и на 78% — дисперсионного взаимодействия. Следовательно, на растворение любых компонентов нефтяногосырьяврастворителяхлюбойприродыпреобладающеевлияние оказывает дисперсионное взаимодействие.
Водороднаясвязь.Атомводородавсоединенияхскислородом,азотом, фтором, хлором, иногда серой и фосфором обладает способностью связывать не один, а два атома этих элементов. С одним из них водород связывается прочной химической (ковалентной) связью, а с другим — менее прочной, так называемой водородной связью. Возможность образования такой Н-связи обусловливается тем, что атом водорода содержит всего один электрон; отдав свой единственный электрон для
474
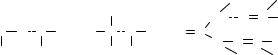
vk.com/club152685050 | vk.com/id446425943
образования прочной химической связи, ядро водорода с диаметром в тысячи раз меньше диаметров остальных атомов приобретает способность подойти исключительно близко к другим атомам молекул, не вызывая при этом сил отталкивания, и вступать во взаимодействие с их электронами. Прочность Н-связи зависит от свойств тех атомов, между которыми находится атом водорода, и обычно составляет 8–40 кДж/моль против 8–12 кДж/моль обычной Ван-дер-Ваальсовой связи (но на порядок слабее ковалентной связи).
|
|
H |
H |
NH2 |
|
|
|
NH O |
C NH2 |
||
O H O H , H N O H , O C |
|||||
N O C NH2 |
|||||
R |
R |
H H |
H |
NH2 |
|
|
|
|
|||
ВысокаяассоциациямолекулспиртовR–ОН,образованиегидратов аммиака, кристаллическое состояние карбамида обусловливаются образованием водородной связи:
Водородная связь объясняет аномально высокие температуры кипения и плавления ряда веществ, аномальную диэлектрическую проницаемость и не соответствующую строению молекул растворимость. Различают два вида водородной связи: межмолекулярную и внутримолекулярную. В первом случае атом водорода связывает два атома, принадлежащих разным молекулам (например, растворителям и масляному сырью), во втором случае оба атома принадлежат одной и той же молекуле. Образование водородной связи наиболее вероятно при пониженных температурах; с повышением температуры водородные связи ослабляются или рвутся вследствие усиления теплового движения молекул.
4.2.2. Классификация растворителей
По способности растворять групповые химические компоненты нефтяного сырья органические и некоторые неорганические растворители можно классифицировать на две группы.
Кпервойгруппеотносятсянеполярныерастворители,необладающиедипольныммоментом,межмолекулярноевзаимодействиекоторых
срастворяемым осуществляется за счет дисперсионных сил. Неполярными (или слабополярными) растворителями являются низкомолекулярные жидкие или сжиженные алканы, бензол, а также соединения
соченьнебольшимдипольныммоментом—толуол,четыреххлористый углерод, этиловый эфир, хлороформ и т.д.
475
476 |
Таблица 4.1 — |
Физико-химические свойства избирательных растворителей |
|
|
|
||||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Температура,°С |
|
|
Энталь- |
|
|
|
|
|
|
|
|
(при атмосфер- |
Критические |
пия ис- |
|
||
|
|
|
Молеку- |
Диполь– |
Плотность, |
ном давлении) |
|
|
парения |
Вязкость |
|
|
Растворитель |
Формула |
лярная |
ный мо- |
|
|
|
|
при тем- |
кинемати- |
|
|
|
|
|
|
|||||||
|
|
|
масса |
мент, D |
г/см3 |
кипе- |
плавле- |
темпера- |
давление, |
пературе |
ческая, сСт |
|
|
|
|
|
|
ния |
ния |
тура,°С |
МПа |
кипения, |
|
|
|
|
|
|
|
|
|
|
|
кДж/кг |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пропан |
С3Н8 |
44 |
0 |
0,582 (–42) |
–42,07 |
– 187,6 |
96,85 |
4,21 |
420,68 |
0,35 (–40) |
|
н-Бутан |
С4Н10 |
58 |
0 |
0,579 (20) |
–0,5 |
–138,3 |
152 |
3,87 |
385,6 |
0,345 (0) |
|
|
|
|
|
|
|
|
|
|
|
|
|
н-Пентан |
С5Н12 |
72 |
0 |
0,626 (20) |
36,1 |
–129,7 |
196,9 |
3,35 |
358 |
0,382 (20) |
|
|
|
|
|
|
|
|
|
|
|
|
|
Бензол |
С6Н6 |
78 |
0 |
0,879 (20) |
80,1 |
5,53 |
289,4 |
4,93 |
395,45 |
0,74 (20) |
|
Толуол |
С6Н5СН3 |
92 |
0,37 |
0,867 (20) |
110,6 |
–94,99 |
320,4 |
4,23 |
362,64 |
0,68 (20) |
|
Ацетон |
(СН3)2СО |
58 |
2,85 |
0,791 (20) |
56,2 |
–95,5 |
235,6 |
4,75 |
521,61 |
0,735 (20) |
|
Метилэтилкетон |
СН3СОС2H5 |
72 |
2,8 |
0,805 (20) |
79,6 |
–86,4 |
– |
– |
443,93 |
0,52 (20) |
|
Фурфурол |
С5Н4О2 |
96 |
3,57 |
1,159 (20) |
161,7 |
–38,7 |
396 |
5,43 |
450,55 |
0,907 (38) |
|
Фенол |
С6Н5ОН |
94 |
1,7 |
1,071 (25) |
181,2 |
40,97 |
419 |
6,05 |
446,23 |
3,8 (45) |
|
|
|
|
|
|
|
|
|
|
|
|
|
N-метил– |
|
|
|
|
|
|
|
|
|
|
|
пирролидон |
С4Н9CОН |
99 |
4,09 |
1,033 (20) |
204 |
–24 |
451 |
4,78 |
493,1 |
_ |
|
|
|
|
|
|
|
|
|
|
|
|
com/id446425943.vk | com/club152685050.vk
vk.com/club152685050 | vk.com/id446425943
Ко второй группе относятся полярные растворители с высоким дипольным моментом. Взаимодействие полярных растворителей с растворяемым веществом носит смешанный характер и складывается из дисперсионного эффекта и ориентационного, причем последний часто является преобладающим. Полярными растворителями, широко применяемыми при очистке масел, являются фенол, фурфурол, крезолы, N-метилпирролидон, ацетон, метилэтилкетон и другие.
Некоторыефизико-химическиесвойстварастворителей,применяе- мых в процессах очистки масел, приведены в табл. 4.1.
4.2.3. Растворяющие и избирательные свойства растворителей
Различный механизм межмолекулярного взаимодействия в экстракционных системах обусловливает различающиеся между собой растворяющие и избирательные способности у неполярных и полярных растворителей.
Классификациярастворителейпопризнакуполярностиихмолекул не случайна. Именно полярность растворителей и, следовательно, со- отношениесоставляющихВан-дер-Ваальсовыхсил,обусловливающих межмолекулярныевзаимодействиявэкстракционныхсистемах,предопределяет растворяющие и избирательные свойства экстрагентов.
Основная составляющая Ван-дер-Ваальсовых сил в неполярных растворителях — дисперсионная. Дисперсионное взаимодействие — наиболее универсальный тип межмолекулярных взаимодействий, который проявляется вне зависимости от полярности молекул и потому преимущественно отражает растворяющие свойства растворителей. Электростатическая же составляющая (ориентационная + индукционная) Ван-дер-Ваальсовых сил предопределяет преимущественно избирательные свойства полярных растворителей. Следовательно, растворяющая и избирательная способности полярных растворителей будут обусловливаться соотношением электростатических и дисперсионных составляющих межмолекулярных взаимодействий.
Неполярные и слабополярные растворители характеризуются тем, что притяжения между молекулами растворителя и экстрагируемого вещества (компонента) происходят за счет дисперсионных сил. Поскольку дисперсионное взаимодействие зависит не от полярности, а главным образом от поляризуемости молекул, и оно оказывает преобладающее влияние по сравнению с другими составляющими межмолекулярного взаимодействия, неполярные растворители яв-
ляются более универсальными по растворяющей способности, но относительно менее селективными. Причем избирательность
477
vk.com/club152685050 | vk.com/id446425943
неполярных растворителей проявляется в первую очередь по молекулярной массе углеводородов и только затем по групповому химическому составу.
При обычных температурах неполярные и слабополярные растворители, например низкомолекулярные алканы, бензол и толуол, смешиваются с жидкими углеводородами масляных фракций в любых соотношениях по закономерностям идеальных растворов независимо от их химического строения. Избирательное же действие неполярных растворителейпроявляетсяглавнымобразомприэкстракции(кристаллизацией) твердых углеводородов (высокомолекулярных парафинов
ицерезинов) при низких температурах, а также в отношении смол
иасфальтеновпритемпературах,близкихккритическимтемпературам растворителей (не путайте с КТР экстракции).
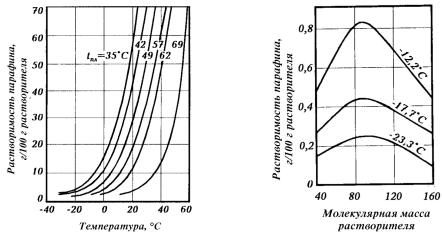
Утвердыхуглеводородовмасляныхфракцийрастворимостьвнеполярных растворителях ограниченная, и она зависит от молекулярной массы как углеводородов, так и растворителя, а также от температуры растворения(экстракции).Сповышениеммолекулярноймассырастворяемыхтвердыхуглеводородов(следовательно,итемпературыплавления)онападает,асповышениемтемпературыэкстракциирастет,ипри температуреплавлениярастворяемыхуглеводородовонисмешиваются с растворителем неограниченно, подобно прочим жидким углеводородам (рис. 4.2). Растворимость твердых углеводородов в низкомолекулярныхалканахзависитотмолекулярноймассыпоследних,причемэта зависимость экстремальна (рис. 4.3). Поэтому при растворении масляных фракций, содержащих углеводороды с высокой температурой плавления, образование истинных растворов возможно не при всяких температурахисоответственнонепривсякихсоотношенияхснеполярным растворителем любой молекулярной массы. В тех случаях, когда температура растворения ниже температуры плавления твердых углеводородов, последние независимо от их химического строения будут выделяться из растворителя в виде кристаллов и тем интенсивнее, чем выше их концентрация и молекулярная масса и чем ниже температура кипения растворителя.
Следовательно, неполярные растворители при низких температурах растворяют углеводороды масляных фракций избирательно в зависимости от их температуры плавления. Эта закономерность углеводородов обусловливает возможность использования неполярных растворителей для целей депарафинизации кристаллизацией масляных рафинатов, выделения нафталина, разделения ксилолов и т.д. Следует отметить, что для этих целей могут применяться и некоторые поляр-
478
vk.com/club152685050 | vk.com/id446425943
Рис. 4.2. Зависимость растворимости пара- |
Рис.4.3.Изменениерастворимостипарафи- |
финов с различной температурой плавления |
нов(tпл =50°C)вуглеводородныхрастворите- |
в сжиженном пропане от температуры |
лях различной молекулярной массы |
ные растворители, например ацетон, метилэтилкетон или их смеси
снеполярными растворителями, в среде которых проявляется аналогичная избирательность растворимости твердых углеводородов.
Низкаярастворимостьтвердыхуглеводородовобъясняетсятем,что они, имея трехмерную упорядоченную структуру, обладают высоким уровнем энергиисвязимеждумолекулами. Введениевсистемурастворителя, хотя и ослабляет межмолекулярное взаимодействие, но оно, особенно при низких температурах, может оказаться недостаточным для полного разрушения кристаллической структуры и перевода твердых углеводородов в раствор.
Установлено, что при экстракции неполярными экстрагентами при
температурах вблизи критического состояния растворителей
также проявляется избирательная растворимость высокомолекулярных углеводородов масляных фракций. Обусловливается это тем, что
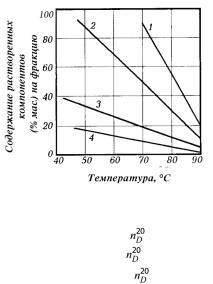
сприближением температуры экстракции к критической происходит резкое снижение плотности растворителя и соответственное ослаблениепрочностисвязеймеждумолекуламирастворителяирастворенных в нем углеводородов. В то же время силы дисперсионного взаимодействия между молекулами самих углеводородов при этом практически не изменяются. В результате при определенных температурах внутримолекулярные силы углеводородов могут превысить межмолекулярные силы взаимодействия между растворителем и углеводородами и последние выделяются в виде дисперсной фазы. При этом, поскольку энергия дисперсионного взаимодействия является функцией от
479
vk.com/club152685050 | vk.com/id446425943
|
|
молекулярной массы молекулы, |
|
|
|
в первую очередь из раствора вы- |
|
|
|
деляются наиболее высокомолеку- |
|
|
|
лярные смолисто-асфальтеновые |
|
|
|
соединения, затем по мере повыше- |
|
|
|
ния температуры — углеводороды |
|
|
|
с меньшей молекулярной массой. |
|
|
|
При температурах, превышающих |
|
|
|
критическую, из раствора выделя- |
|
|
|
ются все растворенные в нем сое- |
|
|
|
динения независимо от молекуляр- |
|
Рис. 4.4. Зависимость растворимости смол |
ноймассыихимическойструктуры |
||
углеводородов (рис. 4.4). Наблюда- |
|||
и углеводородов различного строения |
|||
в пропане от температуры: |
ющаяся при этом избирательность |
||
1 — нафтено-парафиновые ( |
= 1,49); |
||
2 — легкие ароматические ( |
= 1,49…1,53; |
разделения по химическому строе- |
|
3 — тяжелые ароматические ( |
> 1,53); |
нию молекул является следствием |
|
различия сил межмолекулярного |
|||
|
|
||
4 — cмолы |
взаимодействия углеводородов |
|
сырья. Так, силы взаимного притяжения молекул парафиновых
инафтеновых углеводородов значительно слабее, чем ароматических
исмол. Поэтому при одинаковых молекулярных массах парафинонафтеновые углеводороды легче переходят в слой неполярного растворителя, чем ароматические и смолы или асфальтены, тем самым достигается определенная избирательность разделения и по химическому строению молекул.
Из табл. 4.1 видно, что критическая температура у алканов повышается при переходе от пропана к бутану и далее пентану. У метана и этана критическиетемпературызначительнониже,однакоунихслишкомнизкиетемпературыкипения,чтообусловливаетнеобходимостьпроведения жидкофазногопроцессаэкстракциипривысокихдавлениях.Вэтойсвязи дляцелойдеасфальтизациинефтяныхостатковвкачестверастворителя преобладающее применение получил сжиженный пропан.
Такимобразом,неполярныерастворителипритемпературахвблизи критическойизбирательнорастворяютвысокомолекулярныеуглеводородымасляныхфракцийиразделяютихпреждевсегопомолекулярной их массе, только затем по их химическому строению.
Следует отметить, что в процессах деасфальтизации пропан выступаетнетолькокакизбирательныйрастворитель,ноиодновременнокак коагулятор смолисто-асфальтеновых веществ. Известно, что асфальтенывнефтяныхостаткахприсутствуюттольковколлоидномсостоянии.
480

vk.com/club152685050 | vk.com/id446425943
Приэтомдисперсионнойфазойявляютсяасфальтены,адисперсионной средой — масла, в т. ч. полициклические ароматические углеводороды исмолысырья.Вразбавленныхрастворах,вкоторыхрастворитель,как, например, пропан, не обладает способностью растворять асфальтены, имеет место коагуляция последних. С точки зрения коагулирующей способности, алканы с молекулярной массой меньше, чем у пропана (этан, метан), превосходят пропан. Однако они требуют, как было указано выше, проведения процесса деасфальтизации при чрезмерно высоких давлениях.
Растворяющие и избирательные свойства полярных раство-
рителей обусловливаются, как указывалось ранее, энергией и соотношением дисперсионных и электростатических составляющих Ван- дер-Ваальсовых сил.
Как известно, полярность у органических веществ обусловливается наличиемвихмолекулахфункциональныхгрупп,такихкакалкильные
(–СnH2n+1),гидроксильные(–ОН),карбонильные(>С=О),карбоксиль- ные (–СООН), эфирные (–О–), аминные (–NH2), иминные (>NH),
нитрильные (>N–), нитрогруппы (–NО2) и др.
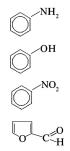
Нарастворяющуюспособностьполярныхрастворителейсущественное влияние оказывают тип, количество и место расположения функциональных групп, способность их образовывать водородные связи, а также молекулярная масса и химическая структура (ациклическое или циклическое строение, изомерия, симметричность и др.) основной(ядерной)части ихмолекул.Так,бензол,имеющийсимметричную молекулярную структуру, не обладает дипольным моментом, в то время как толуол и ксилолы, содержащие метильные группы, относятся ктипу полярных(слабополярных) растворителей. Вмолекулахполярных растворителей, таких как фенол, анилин и нитробензол, имеются соответственно гидроксильная, аминная и нитрогруппы.
По результатам многочисленных исследований, установлены следующиеосновныезакономерностиповлияниюхимическойструктуры молекул полярных растворителей на их растворяющую способность
(PC) (табл. 4.2):
1)у растворителей с моноциклической молекулярной структурой с одной функциональной группой PC растет симбатно их дипольным моментам;
2)у растворителей с ациклической структурой с одной и той же функциональной группой PC повышается с увеличением длины алкильной цепи независимо от значений их дипольных моментов (за счет увеличения доли дисперсионных сил);
481
vk.com/club152685050 | vk.com/id446425943
3)наличие в молекуле растворителя второй и более функциональных групп снижает его PC (как у фурфурола и N-метилпирролидона);
4)наличие в молекуле полярного растворителя функциональных групп, способных образовывать водородные связи, всегда приводит к снижению их PC.
Таблица 4.2 – |
Влияниехимическойструктурымолекулполярных |
||||
|
растворителей на их растворяющую способность |
||||
|
|
|
|
|
|
|
|
|
Диполь- |
|
Выход раство- |
Растворитель |
|
Формула |
ный мо- |
КТР,°С |
ренного компо- |
|
|
|
мент, D |
|
нента,% мас. |
|
|
|
|
|
|
Анилин |
|
|
1,51 |
96,2 |
|
Фенол |
|
|
1,70 |
79,4 |
|
Нитробензол |
|
|
4,23 |
66,6 |
|
Фурфурол |
|
|
3,57 |
42,0 |
|
|
|
|
|
|
|
Диметилкетон |
|
(СН3)2СО |
2,85 |
54,4 |
|
Диэтилкетон |
|
(С2Н5)2СО |
2,72 |
–42,0 |
|
Метилбутилкетон |
|
СН3(СО)С4Н9 |
2,16 |
–53,0 |
|
Этанол |
|
С2Н5ОН |
|
|
0 |
н-Бутанол |
|
С4Н9ОН |
|
|
71 |
н-Гексанол |
|
С6Н13ОН |
|
|
89 |
н-Октанол |
|
С8Н17ОН |
|
|
100 |
|
|
|
|
|
|
На избирательную способность полярных растворителей также влияютвеличинадипольногомоментаиособенностиихмолекулярной структуры. Исследования показали, что у органических соединений одногоитогожекласса,различающихсятолькофункциональнойгруппой, избирательная способность увеличивается с ростом дипольного момента их молекул. Такая закономерность характерна как для ароматических, так и для алифатических растворителей. Функциональные группы по их влиянию на избирательную способность растворителя располагаются в следующей последовательности:
482
vk.com/club152685050 | vk.com/id446425943
NO2 > CN > СО > СООН > ОН > NH2
Введение в состав алифатического растворителя второй функциональной группы (в отличие от растворяющей способности) повышает избирательность, причем группа, не способная образовывать водородную связь, – более эффективно, по сравнению с группой с водородной связью (например, –ОН и –NH2 группы).
Постепенивлиянияхимическойструктурыосновнойцепимолекул на избирательную способность растворителей с одинаковой функциональной группой установлена следующая последовательность: тиофеновое кольцо > бензольное кольцо > фурановое кольцо > алифатическая цепь.
Растворимость углеводородных компонентов масляных фрак-
ций в полярных растворителях зависит как от растворяющей способностипоследних, так иот химическогосостава,преждевсегоспособностимолекулсырьяполяризоватьсяподдействиемэлектрическогополя молекул растворителя. При идентичных условиях в полярных растворителяхлучшевсехрастворяютсяполярныекомпонентысырья,тоесть смолы и другие неуглеводородные компоненты; в этом случае наряду с ориентационными проявляются и дисперсионные силы межмолекулярноговзаимодействия.Углеводородныекомпонентысырьяявляются преимущественно неполярными или слабополярными соединениями ирастворяютсявполярныхрастворителяхврезультатевзаимодействия постоянных диполей молекул растворителя с индуцированными диполями молекул углеводородов.
Наибольшимзначениемсреднеймолекулярнойполяризациихарак- теризуютсяароматическиеуглеводороды,наименьшим–парафиновые, а нафтеновые занимают промежуточное положение. Вследствие этого ароматические углеводороды имеют самые низкие значения КТР в полярных растворителях, а парафиновые — самые высокие. По растворимости углеводородных компонентов масляных фракций в полярных растворителях установлены следующие закономерности:
1)самую высокую растворимость имеют ароматические углеводороды;
2)сростомчислаколецвмолекулеуглеводородасырьярастворимость резко возрастает;
3)с увеличением длины алкильных цепей растворимость снижается;
4)приодинаковомчислеатомовуглеродавкольцахнафтеновыхиароматических углеводородов растворимость последних значительно выше;
5)самуюнизкуюрастворимостьимеютнормальныепарафиновыеуглеводороды;
483
