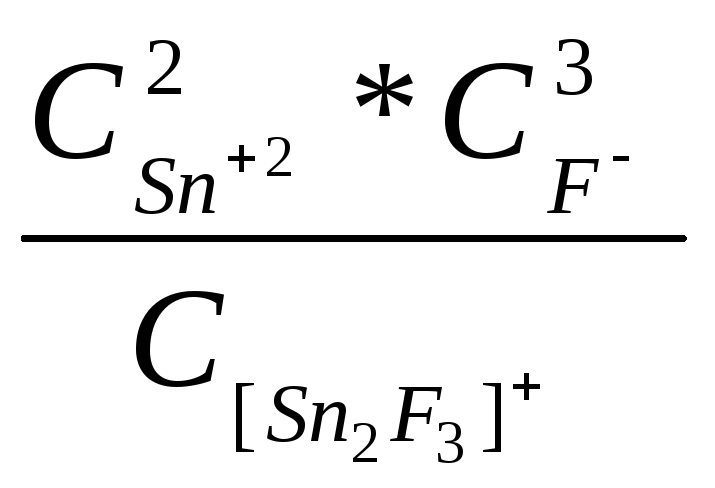2.Свойства соединений олова.
2.1. +50Sn…5S25P2
Sn
![]() Sn*
Sn*
|
|
|
|
| |||||||
|---|---|---|---|---|---|---|---|---|---|---|
|
|
|
| ||||||||
|
|
|
|
|
| ||||||
|
|
| |||||||||
|
|
|
|
| |
|---|---|---|---|---|
|
|
| |||
Определим свойства
оксидов олова. а) Олово в соединениях
проявляет две степени окисления: +2 и
+4. Олово имеет промежуточную степень
окисления +4, поэтому его соединения
носят амфотерный характер. б)
ΔЭОокс.Sn=1.96(по
Полингу)~2, следовательно, оксиды носят
амфотерный характер. в) Олово находится
вблизи диагонали бор – астат, значит,
может быть как окислителем, так и
восстановителем. Химические свойства
ряда оксидов в периоде изменяются так:
основные оксиды![]() амфотерные
оксиды
амфотерные
оксиды![]() кислотные
оксиды. Так как олово может быть и
окислителем, и восстановителем, то
образует амфотерные оксиды.
кислотные
оксиды. Так как олово может быть и
окислителем, и восстановителем, то
образует амфотерные оксиды.
2.2. Оксиду олова(IV)+4SnO2соответствуют кислотыH4SnO4(орто-форма) иH2SnO3(мета-форма) и основанияSn(OH)4иSnO(OH)2 . Оксиду олова(II)+2SnOсоответствует кислотаH2SnO2и основаниеSn(OH)2.
Взаимодействуя с сильными кислотами, амфотерные гидроксиды и оксиды проявляют основные свойства:
1. а) Sn(OH)4+4HСl=SnCl4+4H2O
Sn(OH)4+4H+=Sn+4+4H2O
б) SnO2+4HCl=SnCl4+2H2O
2. а) Sn(OH)2+H2SO4=SnSO4+2H2O
Sn(OH)2+2H+=Sn+2+2H2O
б) SnO+H2SO4=SnSO4+H2O
Взаимодействуя со щелочами – сильными основаниями, амфотерные гидроксиды и оксиды проявляют кислотные свойства:
а) SnO(OH)2+2NaOH=Na2[SnO(OH)4]
SnO(OH)2+2OH- =[SnO(OH)4]-2
б) SnO2+2NaOH+H2O=Na2[SnO(OH)4]
а) Sn(OH)2+2KOH=K2[Sn(OH)4]
Sn(OH)2+2OH- =[Sn(OH)4]-2
б) SnO+2KOH+H2O=K2[Sn(OH)4]
Пространственная структура системы “олово-фтор”:
|
|
|
|
|
|
Sn |
|
|
|
|
|
5S 5P 5S 5P
S


 P3
P3![]() q4-гибридизация
q4-гибридизация












 +
+
![]()
![]()



 S
S
3P 4SP3



2.SnF2. Двухвалентное олово. Дифторид олова впервые был получен в 1856г. Известны три его полиморфные модификации: полиморфная α - фаза, орторомбическая β - фаза и тетрагональная γ - фаза.
{1) Моноклинная α - фаза содержит четырехчленные кольца из октаэдров состава Sn4F8. Эта группа представляет собой вытянутое вдоль оси кольцо из чередующихся 4-х атомовSnи 4-х атомовFс присоединенным к каждому из атомовSnеще по одному атомуF. АтомыSnв тетрамере характеризуются двумя типами координации: тетраэдрической из трех атомовFи одной свободной пары электронов и октаэдрической из пяти атомовFи одной свободной пары электронов. Каждый тетраметр связан еще с 10-ю тетраметрами более слабыми взаимодействиями.
2) Орторомбическая β – фаза имеет следующую структуру: атомы Snнаходятся в октаэдрическом окружении из пяти атомовFи неподеленной пары электронов. Октаэдры соединяются вершинами в трехмерный каркас.
3) Тетрагональная γ – фаза: атомы Snрасполагаются в центрах бипирамид из 4-х атомовFи неподеленной пары электронов. Бипирамиды соединяются вершинами в шестичленные кольца составаSn6F6.}
Комплексные соединения олова.
Олово входит в состав комплексных солей в качестве составляющей аниона или катиона.
а) Snв составе аниона.
NaF+2SnF2=+Na[2+Sn2F5-]-фторостаннат натрия
донор – фтор F
акцептор – олово Sn
комплексообразователь (К) – олово Sn
лиганды (Л) – фтор F
координационное число nравно 5
Na[Sn2F5]+aq![]() +Na*aq+[Sn2F5]2-*aq
+Na*aq+[Sn2F5]2-*aq
[2+Sn2F5-]2-+aq![]() 2Sn2+*aq+5F-*aq
2Sn2+*aq+5F-*aq
Кн=
б) Snв составе катиона.
При взаимодействии с соединениями, являющимися сильными акцепторами фтора, SnF2может образовывать комплексные фториды, входя в состав катиона. В качестве противоиона здесь выступает, как правило, однозарядный анион. По данным рентгеноструктурных исследований катионные фторидные частицы являются полимерными. Подобные соединения образуются сBF3,ZrF4,AsF5,SbF3,SbF5. величина изомерного сдвига свидетельствует, что они содержат катионы (SnF)nn+или (SnnF2n-1)+:
BF3+2SnF2=+[+2Sn2F3-][BF4]-
донор – фтор F
акцептор – олово Sn
комплексообразователь(К) – олово Sn
лиганды(Л) – фтор F
координационное число nравно 3
[Sn2F3][BF4]+aq![]() [Sn2F3]+
*aq+[BF4]-*aq
[Sn2F3]+
*aq+[BF4]-*aq
[2+Sn2F3-]++aq![]() 2Sn+2*aq+3F-*aq
2Sn+2*aq+3F-*aq
Кн=