
- •Курс лекций по биохимии
- •Список сокращений
- •Глава 1 введение в биохимию
- •История развития биохимии
- •Развитие медицинской биохимии в Беларуси
- •Содержание предмета биохимии
- •Разделы и направления биохимии
- •Объекты биохимических исследований
- •Методы биохимии
- •Глава 2 строение и функции белков
- •История изучения белков
- •Аминокислоты и их роль в организме
- •Модифицированные аминокислоты, присутствующие в белках
- •В молекуле коллагена присутствуют:
- •Аминокислоты как лекарственные препараты
- •Пептиды
- •Методы разделения пептидов
- •Автоматический синтез пептидов
- •Биологические функции белков
- •Физико-химические свойства белков
- •Уровни структурной организации белков
- •Предварительные исследования перед определением первичной структуры белка
- •Стадии определения первичной структуры белков и полипептидов
- •Методы определения n-концевых аминокислот
- •Методы определения с-концевых аминокислот
- •Общие закономерности, касающиеся аминокислотной последовательности белков
- •Классификация шаперонов (ш)
- •Роль шаперонов в фолдинге белков
- •Роль шаперонов в защите белков клеток от денатурирующих стрессовых воздействий
- •Болезни, связанные с нарушением фолдинга белков
- •Функционирование белков
- •Активный центр белков и избирательность связывания его с лигандом
- •Характеристика активного центра
- •Глава 3 фермЕнТы. Механизм действия ферментов
- •Отличия ферментов от неорганических катализаторов
- •Структура молекулы ферментов
- •Кофакторы – ионы металлов
- •Роль металлов в ферментативном катализе
- •Активный центр фермента
- •Механизм действия ферментов
- •Энергетические изменения при химических реакциях
- •Роль активного центра в ферментативном катализе
- •Молекулярные механизмы ферментативного катализа
- •Кислотно-основной катализ
- •Ковалентный катализ
- •Специфичность действия ферментов
- •Специфичность по отношению к реакции
- •Глава 4 регуляция активности ферментов. Медицинская энзимология Способы регуляции активности ферментов:
- •Регуляция количества ферментов
- •Влияние активаторов и ингибиторов на активность ферментов
- •Необратимое ингибирование
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Лекарственные препараты как конкурентные ингибиторы
- •Антиметаболиты как лекарственные препараты
- •Неконкурентное ингибирование
- •Аллостерическая регуляция
- •Ферменты плазмы крови
- •Энзимопатии
- •Применение ферментов в медицине
- •Энзимодиагностика
- •Применение ферментов в качестве лекарственных средств
- •Глава 5 структура и функции нуклеиновых кислот
- •Структура и функции днк
- •Организация генома человека
- •Виды и особенности структурной организации рнк
- •Гибридизация нуклеиновых кислот
- •Методы изучения структуры нуклеиновых кислот
- •Глава 6 биосинтез нуклеиновых кислот
- •Биосинтез днк
- •Репарация днк
- •Биосинтез рнк
- •Регуляция транскрипции
- •Процессинг рнк
- •Обратная транскрипция
- •Глава 7 биосинтез белка
- •Активация аминокислот
- •Синтез белка у эукариот
- •Посттрансляционные изменения белков
- •Регуляция синтеза белка
- •Ингибиторы матричных биосинтезов
- •Использование днк-технологий в медицине
- •Глава 8 введение в метаболизм
- •Специфические и общие пути катаболизма
- •Метаболиты в норме и при патологии
- •Уровни изучения обмена веществ
- •Глава 9 биологические мембраны
- •Механизмы мембранного транспорта веществ
- •Глава 10 энергетический обмен. Биологическое окисление
- •Структурная организация цепи тканевого дыхания
- •Окислительное фосфорилирование атф
- •Хемиоосмотическая гипотеза Питера Митчелла (1961г.)
- •Строение атф-синтазы
- •Нарушения энергетического обмена
- •Глава 11 типы окисления. Антиоксидантные системы
- •Оксидазный тип окисления
- •Пероксидазный тип окисления
- •Диоксигеназный тип окисления
- •Монооксигеназный тип окисления
- •Активные формы кислорода
- •Перекисное окисление липидов (пол)
- •Антиоксидантные системы организма
- •Глава 12 гормоны – общая характеристика и механизмы действия
- •Классификация гормонов
- •Классификация по месту образования
- •Классификация по механизму действия
- •Основные свойства и особенности действия гормонов
- •Рецепторы гормонов
- •Механизм передачи гормональных сигналов через мембранные рецепторы
- •Аденилатциклазная система.
- •Гуанилатциклазная система.
- •3. Оксид азота (II).
- •Инозитолтрифосфатная система.
- •Механизм передачи гормонального сигнала через внутриклеточные рецепторы
- •Передача сигналов через рецепторы, сопряженные с ионными каналами
- •Глава 13 особенности действия гормонов Гормоны гипоталамуса и гипофиза
- •Гормоны гипоталамуса и гипофиза
- •Гормоны гипофиза
- •Гормоны щитовидной железы
- •Гиперфункция щитовидной железы
- •Гипофункция щитовидной железы
- •Гормоны поджелудочной железы
- •Инсулин Биологическое действие
- •Гипофункция поджелудочной железы
- •Гиперфункция поджелудочной железы
- •Глюкагон
- •Регуляция обмена ионов кальция и фосфатов
- •Гиперфункция паращитовидной железы (гиперпаратиреоз)
- •Гипофункция паращитовидных желез (гипопаратиреоз)
- •Гормоны надпочечников Гормоны мозгового вещества надпочечников
- •Биологическое действие
- •Гиперфункция мозгового вещества надпочечников
- •Гормоны коры надпочечников (кортикостероиды)
- •Глюкокортикоиды
- •Биологическое действие
- •Минералокортикоиды
- •Биологическое действие
- •Гиперфункция коры надпочечников
- •Гипофункция коры надпочечников
- •Гормоны половых желёз Мужские половые гормоны
- •Биологическое действие
- •Анаболические стероиды
- •Нарушение андрогенной функции
- •Женские половые гомоны
- •Биологическое действие на половые органы
- •Действие на неполовые органы
- •Нарушения гормональных функций яичников
- •Эйкозаноиды
- •Синтез эйкозаноидов
- •Номенклатура эйкозаноидов
- •Применение гормонов в медицине
- •Глава 14 биохимия питания
- •Общая характеристика основных компонентов пищи Белки
- •Углеводы
- •Глава 15 Основы витаминологии
- •Биологические функции витаминов
- •Классификация витаминов
- •Основные характеристики водорастворимых витаминов
- •Основные характеристики жирорастворимых витаминов
- •Обмен витаминов
- •Обеспеченность организма витаминами
- •Гиповитаминозы
- •Гипервитаминозы
- •Методы оценки обеспеченности организма человека витаминами
- •Применение витаминов в клинической практике
- •Поливитаминные препараты
- •Антивитамины
- •Антивитамины
- •Глава 16 Общая характеристика углеводов
- •Переваривание углеводов
- •Всасывание моносахаридов в кишечнике
- •Транспорт глюкозы из крови в клетки
- •Нарушения переваривания и всасывания углеводов
- •Метаболизм фруктозы
- •Метаболизм галактозы
- •Метаболизм лактозы
- •Глава 17 пути метаболизма глюкозы
- •Гликолиз
- •Гликоген
- •Пентозофосфатный путь (пфп)
- •Глюконеогенез (гнг)
- •Аланин Аланин Аланин
- •Путь глюкуроновой кислоты
- •Глава 18 обмен гликогена
- •Синтез гликогена (гликогеногенез)
- •Глюкагон Адреналин
- •А денилатциклаза Аденилатциклаза
- •Протеинкиназа Протеинкиназа
- •Нарушения обмена гликогена
- •Глава 19 липиды тканей, переваривание и транспорт липидов
- •Глава 20 обмен триацилглицеролов и жирных кислот
- •Регуляция синтеза триацилглицеролов
- •Регуляция мобилизации триацилглицеролов
- •Ожирение
- •Обмен жирных кислот
- •Обмен кетоновых тел
- •Синтез жирных кислот
- •Глава 21 обмен сложных липидов
- •Глава 22 метаболизм холестерола. Биохимия атеросклероза
- •Биохимия атеросклероза
- •Глава 23 Обмен аминокислот. Динамическое состояние белков организма
- •Переваривание белков в желудочно-кишечном тракте
- •Наследственные нарушения транспорта аминокислот
- •Расщепление белков в тканях
- •Превращение аминокислот микрофлорой кишечника
- •Пути обмена аминокислот в тканях
- •Трансаминирование аминокислот
- •Биологическое значение трансаминирования
- •Дезаминирование аминокислот
- •Окислительное дезаминирование глутамата
- •Непрямое дезаминирование аминокислот
- •Декарбоксилирование аминокислот
- •Биогенные амины
- •Пути катаболизма углеродного скелета аминокислот
- •Глава 24 Образование и обезвреживание nh3 в организме
- •Тканевое обезвреживание аммиака
- •Общее (конечное) обезвреживание аммиака
- •Регуляция синтеза мочевины
- •Нарушения синтеза и выведения мочевины
- •Глава 25 Метаболизм отдельных аминокислот Метаболизм метионина
- •Реакция активации метионина
- •Синтез креатина
- •Метаболизм фенилаланина и тирозина
- •Нарушения обмена фенилаланина и тирозина
- •Глава 26 обмЕн нуклеотидов
- •Биосинтез пуриновых нуклеотидов
- •Биосинтез пиримидиновых нуклеотидов
- •Распад нуклеиновых кислот в желудочно-кишечном тракте и тканях
- •Нуклеопротеины
- •Нарушения обмена нуклеотидов Ксантинурия
- •Глава 27 регуляция и взаимосвязь метаболизма
- •Аллостерическая регуляция метаболических путей
- •Взаимосвязь метаболизма
- •Глава 28 биохимия печени
- •Роль печени в углеводном обмене
- •5. В печени происходит синтез глюкуроновой кислоты. Роль печени в липидном обмене
- •Роль печени в обмене аминокислот и белков
- •Обезвреживающая функция печени
- •Обезвреживание нормальных метаболитов
- •Обезвреживание ксенобиотиков
- •Распад гемоглобина
- •Катаболизм гема.
- •Желтухи. Дифференциальная диагностика
- •Желтуха новорожденных
- •Биохимические механизмы развития печеночной недостаточности
- •Биохимические методы диагностики поражений печени
- •Глава 29 Водно-электролитный обмен Распределение жидкости в организме
- •Состав жидкостей
- •Растворенные вещества
- •Характеристики жидкостей
- •Обмен воды
- •Регуляция объема внеклеточной жидкости
- •Роль системы ренин-ангиотензин
- •Активация системы
- •Предсердный натрийуретический фактор
- •Нарушения водно-электролитного обмена и кислотно-основного равновесия
- •Нарушения кислотно-основного равновесия
- •Минеральные компоненты тканей, биологические функции
- •Основные биологические функции
- •Натрий: биологическая роль, обмен, регуляция
- •Калий, биологическая роль, обмен, регуляция
- •Кальций, биологическая роль, обмен, регуляция
- •Фосфор, биологическая роль, обмен, регуляция
- •Эссенциальные микроэлементы
- •Глава № 30 биохимия крови
- •Общая характеристика
- •Функции крови
- •Особенности метаболизма в форменных элементах крови
- •Гемоглобин человека
- •Производные гемоглобина
- •Варианты гемоглобина в онтогенезе
- •Гемоглобинопатии
- •Обмен железа
- •Железодефицитные анемии
- •Белки плазмы крови
- •Характеристика белков сыворотки крови
- •Патологии системы свертывания крови. Гемофилии
- •Диссеминированное внутрисосудистое свертывание (двс-синдром)
- •Глава 31 биохимия почек
- •Особенности биохимических процессов в почечной ткани
- •Глава 32 особенности метаболизма в нервной ткани
- •Функции аксонального плазматического тока
- •Гемато-энцефалический барьер (гэб)
- •Общие особенности метаболизма нервной ткани
- •Обмен свободных аминокислот в головном мозге
- •Нейропептиды
- •Энергетический обмен в нервной ткани
- •Особенности углеводного обмена в ткани головного мозга
- •Липидный обмен в нервной ткани
- •Обмен липидов в нервной ткани имеет следующие особенности
- •Роль медиаторов в передаче нервных импульсов
- •Нейрохимические основы памяти
- •Спинномозговая жидкость (ликвор или цереброспинальная жидкость)
- •Глава 33 биохимия мышечной ткани
- •Белки мышечной ткани
- •Биохимические механизмы сокращения и расслабления мышц
- •Роль ионов кальция в регуляции мышечного сокращения
- •Утомление – состояние организма, возникающее вследствие длительной мышечной нагрузки и характеризующееся временным снижением работоспособности.
- •Глава 34 Биохимия соединительной ткани
- •Коллаген
- •Эластин
- •Протеогликаны и гликопротеины
- •Cписок литературы
- •Оглавление
- •Для заметок
- •Курс лекций по биохимии
Дезаминирование аминокислот
Дезаминирование аминокислот – реакция отщепления -аминогруппы от аминокислоты с выделением аммиака. Различают два типа реакций дезаминирования: прямое и непрямое.
Прямое дезаминирование – непосредственное отщепление аминогруппы от аминокислоты без промежуточных посредников. В живой природе возможны следующие типы прямого дезаминирования: окислительное, восстановительное, гидролитическое и путем внутримолекулярной перестройки. Но у человека дезаминирование происходит преимущественно окислительным путем в результате чего образуется соответствующая -кетокислота и выделяется аммиак. Процесс идет с участием ферментов оксидаз. Выделены оксидазы L-аминокислот, превращающие L-изомеры аминокислот, и D-оксидазы.
Окислительное дезаминирование глутамата
Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, который несколько отличается от типичных оксидаз L-аминокислот:
в качестве кофермента содержит НАД+ или НАДФ+;
обладает абсолютной специфичностью;
высокоактивна;
локализована в митохондриях.
Реакция идет в 2 этапа. Вначале происходит дегидрирование глутамата и образование -иминоглутарата, затем – неферментативное гидролитическое отщепление имминогруппы в виде аммиака, в результате чего образуется -кетоглутарат. Окислительное дезаминирование глутамата – обратимая реакция и при повышении концентрации аммиака может протекать в обратном направлении, как восстановительное аминирование -кетоглутарата.
Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Она является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы – АТФ, ГТФ, НАД(Ф)Н. Высокие концентрации АДФ активируют фермент. Таким образом, низкий энергетический уровень в клетке стимулирует разрушение аминокислот и образование -кетоглутарата, поступающего в ЦТК как энергетический субстрат.
Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом) и ингибироваться эстрогенами и тироксином.
Непрямое дезаминирование аминокислот
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно глутамату. Аминогруппы таких аминокислот перносятся на -кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования или непрямого дезаминирования. Он происходит с участием 2 ферментов: аминотрансферазы и глутаматдегидрогеназы. Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование – основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой аминокислоты из соответствующей -кетокислоты. Обратная последовательность реакций, при которой происходит синтез аминокислот из кетокислот, получила название трансреаминирования.
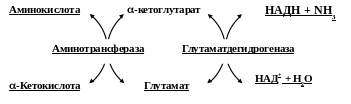
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует еще один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Образующийся при этом аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
