
ФИЗИЧЕСКОЙ ХИМИИ
.pdfvk.com/club152685050 | vk.com/id446425943
33
Вопросы к коллоквиуму № 1
1. Титриметрический анализ. Сущность титриметрического анализа.
Классификация методов титриметрического анализа. Стандартизация
растворов титрантов. Основные приемы титрования. Расчеты в
титриметрическом анализе. Расчет результата прямого титрования при разных способах выражения концентрации раствора. Расчет результата в методах обратного титрования. Кривые титрования. Основные методы титриметрического анализа.
2. Иодиметрия. Индикаторы. Рабочие растворы. Основные условия проведения реакции иода с тиосульфатом. Приготовление и установка титра тиосульфата натрия. Определение меди(II). Определение формальдегида или
йодного числа. Практическое применение.
3. Перманганатометрия. Установление титра перманганата калия.
Определение железа(II).
4. Кислотно-основное титрование. Характеристика метода. Кривые титрования смеси кислот и смеси оснований. Физико-химические методы обнаружения точки эквивалентности. Рабочие растворы. Определение гидроксида натрия и карбоната натрия при их совместном присутствии.
Кривые титрования и выбор индикатора. Определение гидрокарбоната
натрия и карбоната натрия при их совместном присутствии. Кривые
титрования и выбор индикатора. Кривые титрования сильной кислоты сильным основанием, выбор индикатора. Кривые титрования сильной кислотой слабого основания, выбор индикатора. Кривые титрования слабой кислоты сильным основанием, выбор индикатора. Кривые титрования слабой кислоты слабым основанием, выбор индикатора. Какие факторы или характеристики (константа диссоциации, температура, концентрация растворов, объем титруемого раствора, скорость титрования) влияют: а) на положение точки эквивалентности; б) на величину и положение скачка титрования?
Приготовление стандартного раствора соляной кислоты.
vk.com/club152685050 | vk.com/id446425943
34
5. Окислительно-восстановительное титрование. Уравнение Нернста, влияние различных факторов на величину окислительно-
восстановительного потенциала. Назвать самые сильные окислители и самые сильные восстановители в водном растворе и привести значения их стандартных потенциалов. Какие требования предъявляются к окислительно-
восстановительным реакциям, используемым в титриметрическом анализе?
Как связан интервал перехода редокс-индикатора с его стандартным окислительно-восстановительным потенциалом? Как подбираются редокс-
индикаторы? Привести конкретные примеры.
Как зависит величина скачка титрования в методах окисления— восстановления от концентрации исходных растворов, концентрации ионов водорода, разности стандартных потенциалов окислителя и восстановителя?
Привести примеры.
Какими способами фиксируется точка эквивалентности в методах окисления—восстановления? Привести конкретные примеры. В чем состоит различие между редокс-индикаторами и специфическими индикаторами,
применяемыми в методах окисления— восстановления?
Окислительно-восстановительное титрование. Определение молярной масса эквивалента в реакциях окисления-восстановления. Привести примеры.
Влияние ионной силы и температуры на протекание реакций окисления-восстановления.
Скорость и механизм реакций окисления-восстановления. Редокс-
индикаторы.
Перманганатометрия. Определение восстановителей, окислителей, и
др. Привести примеры, реакций и индикаторов.
Иодиметрия. Определение восстановителей, окислителей, кислот и веществ не обладающих окислительно-восстановительными свойствами.
Привести примеры, реакций и индикаторов.
vk.com/club152685050 | vk.com/id446425943
35
Как связан интервал перехода редокс-индикатора с его стандартным
окислительно-восстановительным потенциалом? Как подбираются редокс-
индикаторы? Привести конкретные примеры.
Какие способы установления конечной точки титрования в методах окисления—восстановления наиболее распространены: безиндикаторный, с
редокс-индикатором или с помощью специфического индикатора?
Какие требования предъявляются к окислительно-восстановительным
реакциям, используемым в титриметрическом анализе?
Дихроматометрия. Определение содержания железа (III).
Бромометрия. Определение фенола.
Перманганатометрия. Рабочие растворы. Практическое применение.
Кривые титрования. Индикаторы. |
|
Окислительно-восстановительные свойства |
воды. Константы |
равновесия окислительно-восстановительных реакций. Скорость и механизм реакций окисления-восстановления.
Влияние кислотно-основного взаимодействия, комплексообразования и образования малорастворимых соединений на редокс-потенциал.
Реакции окисления-восстановления. Окислительно-восстановительные потенциалы. Уравнение Нернста.
vk.com/club152685050 | vk.com/id446425943
36
Вопросы к коллоквиуму № 2
1. Комплексонометрическое титрование
Понятие о комплексонах. Рабочие растворы. Кривые титрования.
Индикаторы. Условия комплексонометрического титрования. Реакции комплексообразования. Равновесия в растворах. Константы устойчивости и изменение стандартной энергии Гиббса. Равновесия в растворах координационных соединений. Влияние температуры на равновесия в
растворах |
координационных |
соединений. Условные |
константы |
устойчивости. |
Скорость реакций |
комплексообразования |
в растворе. |
Определение кальция и магния. Определение кальция и магния при их совместном присутствии. Жесткость воды. Зависимость величины скачка титрования от константы устойчивости комплексного соединения,
температуры, концентрации и рН среды. Основные характеристики комплексных соединений.
2. Гравиметрический анализ
Осаждение и растворение малорастворимых соединений. Произведение растворимости и изменение стандартной энергии Гиббса при осаждении.
Условия выпадения осадка. Произведение растворимости при неполной диссоциации малорастворимых соединений. Произведение растворимости малорастворимых соединений.
Условное произведение растворимости. Растворение малорастворимых соединений. Растворение под действием сильных кислот. Растворение осадков вследствие комплексообразования. Влияние растворителя на растворимость. Влияние температуры на растворимость. Равновесия при осаждении двух малорастворимых соединений. Соосаждение. Адсорбция.
Окклюзия, методы борьбы с ней.
Сущность гравиметрического анализа. Форма осаждения. Условия выпадения осадка. Полнота осаждения. Чистота осадка. Промывание осадков. Гравиметрическая форма. Расчеты в гравиметрическом анализе.
vk.com/club152685050 | vk.com/id446425943
37
Количественное разделение методом осаждения. Практическое применение.
Общая оценка метода. Определение сульфат-иона. Определение влажности.
vk.com/club152685050 | vk.com/id446425943
38
Основная литература
1.Ю.Я. Харитонов Аналитическая химия, ч.1 и 2, М., Высшая школа, 2001
г.
2.В.П. Васильев. Аналитическая химия, ч. 1, ч. 2, М., Высшая школа, 1989.
3.В.П. Васильев. Задачник по аналитической химии, М., Высшая школа,
1989.
4.А.П. Крешков. Основы аналитической химии, ч.1 и ч.2, М., Химия, 1976.
Дополнительная литература
1.В.Н. Алексеев. Количественный анализ. М., Химия, 1972.
2.Я.И. Коренман. Практикум по аналитической химии. Воронеж., изд-во Воронежского ун-та, 1966., 244 с.
3.Ю.А. Золотов, Н.М. Кузьмин. Концентрирование микроэлементов. М.,
Химия, 1982., 284 с.
4.Ю.Ю. Лурье. Аналитическая химия промышленных сточных вод. М.,
Химия, 1984., 384 с.
5.Ю.А. Золотов, Е.Н. Дорохова, В.Н. Фадеева и др. Основы аналитической химии, в 2-х книгах, М., Высшая школа, 1996.
6.Е.Г. Власова, А.Ф. Жуков и др. Аналитическая химия. Химические ме-
тоды анализа. Под редакцией О.М. Петрухина. М., Химия, 1992., 400 с.
7.Ю.А. Золотов. Аналитическая химия: проблемы и достижения. М.,
Наука, 1992.
8.А.Т. Пилипенко, И.В. Пятицкий. Аналитическая химия, в 2-х книгах Книга 1 .М., Химия, 1990., 480 с.
Книга 2 .М., Химия, 1990., 481-846 с.
vk.com/club152685050 | vk.com/id446425943
39
ПРИЛОЖЕНИЯ

vk.com/club152685050 | vk.com/id446425943
40
Формулы для вычисления концентрации ионов водорода и значения рН водных растворов кислот, оснований и солей
Концентрация ионов водорода в водном растворе зависит от концентрации кислоты, основания, соли, от констант диссоциации слабых кислот и слабых оснований и от ионного произведения воды.
рК = - lgK pc = - lgc
Таблица 1
Формулы для вычисления концентрации ионов водорода или гидроксила в разбавленных растворах (без учета ионной силы раствора)
Раствор |
|
|
Формулы |
||||||||
Сильная кислота |
|
|
[H+] ≈ cкисл. |
||||||||
разбавленная |
|
|
|||||||||
|
рН = - lg cкисл. |
||||||||||
(например, НС1) |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||
Сильная щелочь |
|
|
[OH‾] ≈ cосн. |
||||||||
разбавленная |
|
|
|||||||||
|
рOН = - lg cосн. |
||||||||||
(например, |
|
||||||||||
|
рН = 14 - рОН |
||||||||||
NaOH) |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
||
|
[H ] |
|
|
|
|
|
|
|
|||
|
|
K |
кисл. |
с |
кисл. |
||||||
|
|
|
|
|
|
|
|||||
Слабая кислота |
рН |
рКкисл. lgcкисл. |
|||||||||
|
|
|
|
2 |
|
|
|
|
|||
(например, |
|
|
|
|
|
|
|
|
|
||
или рН |
рКкисл. |
рскисл. |
|||||||||
СН3СООН) |
|||||||||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
2 |
|
|
|
Слабая щелочь (например,
NH4OH)
Слабая кислота в присутствии ее соли (например, СН3СООН+
+ СН3СООNa)
[OH |
|
] |
|
K |
осн. |
с |
осн. |
|
||||
|
|
|||||||||||
|
|
|
|
|
|
|
|
|||||
рОН |
рК |
осн. |
lgc |
осн. |
|
|||||||
|
|
|
|
|
|
|||||||
|
|
|
|
2 |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||
или рОН |
рК |
осн. |
рс |
осн. |
||||||||
|
|
|
|
|
||||||||
|
|
|
|
|
2 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||
рН = 14 - рОН
[H ] Kкисл. скисл. ссоли
рН рКкисл. lg скисл. ссоли
или рН рКкисл. рскисл.
рссоли.
Пример
сHCl = 0,1 моль-экв/л
[H+] = 0,1 = 10-1; pH = 1
сNaOH = 0,1; OH‾ = 10-1 pOH = 1; pH = 14 - 1 = 13
|
c |
CH |
|
|
|
COOH |
|
|
0,1 10 |
1 |
|
|
||||||||||||||||||||||
|
|
3 |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
K |
CH |
|
|
COOH |
1,8 10 |
5 |
|
|
|
||||||||||||||||||||||||
|
3 |
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
[H |
|
] |
|
|
1,8 10 |
5 |
10 |
1 |
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
1,36 10 |
3 |
; pH 3 |
|
lg1,36 |
||||||||||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||||||||||
|
3 0,13 2,87 |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
c |
NH |
|
|
OH |
0,02 2 10 |
2 |
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
K |
NH |
|
|
OH |
|
1,8 10 |
5 |
|
|
|
|
|
|
|
|
|
||||||||||||||||||
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[OH |
|
] |
|
|
|
1,8 10 |
5 |
2 10 |
2 |
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
3,6 10 |
7 |
|
36 |
10 |
8 |
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
6 10 |
4 |
; pOH 4 0,78 3,22 |
||||||||||||||||||||||||||||||||
|
|
|
|
|||||||||||||||||||||||||||||||
pH 14 3,22 10,78 |
|
|
|
|
||||||||||||||||||||||||||||||
cCH |
3 |
COOH |
|
0,2 cCH |
3 |
COONa 0,1 |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
K |
CH |
3 |
COOH |
|
1,8 10 5 |
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[H ] 1,8 10 |
5 |
0,2 |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
0,1 |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
1,8 10 5 2 3,6 10-5 ; pH 5 lg3,6 5,44

vk.com/club152685050 | vk.com/id446425943
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
41 |
|
|||||||
|
[OH ] K |
|
|
|
|
|
|
|
|
сосн. |
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
осн. |
ссоли |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
Слабая щелочь в |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сосн. |
|
|
||||||||||
присутствии ее |
рОН рКосн. lg |
|
|
|
|||||||||||||||||||||||||||||
ссоли |
|||||||||||||||||||||||||||||||||
соли (например, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
NН4ОН+ |
или |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ NН4Сl) |
рОН рКосн. |
|
рсосн. |
||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||
|
рссоли. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
[H ] |
|
|
KH 2 O Kкисл. |
|
|
|
|
|
|
|||||||||||||||||||||||
Соль слабой |
|
|
|
|
|
|
|
|
|
|
ссоли |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
кислоты и |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
||
сильной щелочи |
рН 7 |
|
|
рКк. |
|
|
lg cсоли |
||||||||||||||||||||||||||
|
2 |
2 |
|||||||||||||||||||||||||||||||
(например, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
рКкисл рссоли |
|||||||||||||||||||||||||||||
СН3СООNa) |
рН 7 |
|
|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
[H ] |
|
K |
H |
|
O |
|
c |
соли. |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Соль слабого |
|
|
|
|
|
|
|
|
|
К |
осн |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
основания и |
рН 7 |
|
1 |
рК |
|
|
|
|
|
1 |
lg c |
|
|
|
|
||||||||||||||||||
сильной кислоты |
|
2 |
ос |
|
2 |
соли |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
(например, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
рс |
|
|
|
|
|
|
|
|
|
рК |
|
|
|
|
|
|
|
|
|
|||||||||||
NH4Cl) |
рН 7 |
|
соли |
|
осн. |
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
K |
|
|
|
|
|
|
|
|
|
|
K |
" |
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
[H ] |
|
|
H |
2 |
O |
|
кисл |
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
Соль слабой |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
с |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
двухосновной |
|
|
|
|
|
|
|
|
|
|
|
|
соли |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
кислоты |
рН 7 |
|
|
рК |
" |
|
|
|
lg c |
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
(например, |
|
2 |
|
к |
|
|
2 |
соли |
|||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
рК |
|
|
|
|
|
|
|
рc |
|
|
|
|
|
|
|
|
|||||||||||||
Na2CO3 |
|
|
|
|
" |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
рН 7 |
|
|
|
|
|
|
|
кисл |
|
|
|
|
|
|
|
|
соли. |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Кислая соль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[H ] |
|
|
|
K'кисл K"кисл |
|
|
|
|
|
|
|||||||||||||||||||||||
слабой |
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
двухосновнойкис |
|
рК ' |
|
|
|
|
|
|
рК |
" |
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
лоты (например, |
рН |
|
|
|
|
|
кисл |
|
|
|
|
|
|
|
|
кисл |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
NaHCO3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
c |
NH |
4 |
OH |
0,4 |
c |
NH |
4 |
Cl |
0,1 |
||||||||
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
[OH |
|
] 1,8 |
10 |
5 0,4 |
|
|
|||||||||||
|
|
|
0,1 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
1,8 10 |
5 |
4 |
7,2 10 |
-5 |
; |
|
|||||||||||
|
|
|
|
|
|
||||||||||||
pOH 5 lg7,2 4,14 |
|
||||||||||||||||
pH 14 4,14 9,86 |
|
|
|
||||||||||||||
cCH 3COONa 0,1
KCH 3COOH 1,8 10 5
|
[H ] |
|
|
10-14 1,8 10 |
5 |
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
0,1 |
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
1,8 10 18 |
1,35 10-9 ; |
|
|||||||||||||||||||||||
|
pH 9 lg3,6 5,44 |
|
|
|
|
|
|
|
|||||||||||||||||||||
|
c |
NH |
4 |
Cl |
|
0,1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10 |
14 |
0,1 |
|
|
|
10 |
5 |
|
||||||||||||
|
[H |
] |
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
1,8 10 |
5 |
|
|
1,35 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
7,4 10 |
6 |
; |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
pH 6 lg 7,4 5,13 |
|
|
|
|
|
|
|
|
||||||||||||||||||||
c |
Na |
|
CO |
|
0,1 K" |
|
|
|
CO |
|
|
6 10 11 |
|||||||||||||||||
|
2 |
3 |
|
|
|
|
|
|
H |
2 |
3 |
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
[H ] |
|
10 14 |
6 10 |
11 |
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
0,1 |
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||

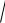 6 10 24 2,4 10 12 pH 12 lg 2,4 11,62
6 10 24 2,4 10 12 pH 12 lg 2,4 11,62
K'H 2 CO 3 3 10 7 ;
K"H 2 CO 3 6 10 11
[H ] 
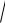 3 10 7 6 10 11
3 10 7 6 10 11
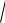 18 10 18 4,2 10 9 pH 9 lg 4,2 8,38
18 10 18 4,2 10 9 pH 9 lg 4,2 8,38
vk.com/club152685050 | vk.com/id446425943
42
|
|
|
|
|
|
|
|
|
|
Таблица 2 |
Интервалы перехода окраски кислотно-основных индикаторов |
||||||||||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
Показател |
|
Окраска |
||||
|
Интервал |
|
в кислой |
|
|
в щелочной |
||||
|
|
|
ь |
|
|
|||||
Индикатор |
перехода |
рКа |
|
среде, |
|
|
среде, |
|||
титровани |
|
|
||||||||
|
|
pH |
|
молекулярна |
|
ионная |
||||
|
|
|
я pT = рКа |
|
||||||
|
|
|
|
|
||||||
|
|
|
|
|
|
я форма |
|
|
форма |
|
Тимоловый голубой |
1,2-2,8 |
1,7 |
2,0 |
Красный |
|
|
Желтый |
|||
(1-й переход) |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
Метиловый оранжевый |
3,2-4,4 |
3,5 |
4,0 |
Красный |
|
|
Желтый |
|||
|
|
|
|
|
|
|
|
|
|
|
Метиловый красный |
4,2-6,2 |
5,0 |
5,5 |
Красный |
|
|
Желтый |
|||
|
|
|
|
|
|
|
|
|
|
|
Феноловый красный |
6,8—8,4 |
8,0 |
7,5 |
Желтый |
|
|
Красный |
|||
|
|
|
|
|
|
|
|
|
|
|
Тимоловый голубой |
8,0—9,6 |
9,2 |
8,5 |
Желтый |
|
|
Голубой |
|||
(2-й переход) |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
Фенолфталеин |
8,2—10,0 |
9,5 |
9,0 |
Бесцветный |
|
Красный |
||||
|
|
|
|
|
|
|
|
|
|
|
Тимолфталеин |
9,4-10,6 |
9,6 |
10,0 |
Бесцветный |
|
Синий |
||||
|
|
|
|
|
|
|
|
|
|
|
Ализариновый желтый |
9,7-10,8 |
10,1 |
11,0 |
Желтый |
|
|
Сиреневый |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 3 |
Окислительно-восстановительные индикаторы |
||||||||||
|
|
|
|
|
|
|
||||
Индикатор |
|
Ео, В |
|
Цвет формы индикатора |
||||||
|
|
окисленная |
восстановленная |
|||||||
|
|
|
|
|
||||||
Нейтральный красный |
|
- 0,325 (рН 7) |
|
красный |
|
бесцветный |
||||
|
|
0,240 (рН 0) |
|
|
|
|
|
|
|
|
Индигокармин |
|
- 0,125 (рН 7) |
|
синий |
|
|
» |
|||
|
|
0,291 (рН 0) |
|
|
|
|
|
|
|
|
Метиленовая синяя |
|
0,011(рН 7) |
|
» |
|
|
|
» |
||
|
|
0,532 (рН 0) |
|
|
|
|
|
|
|
|
Толуиленовый синий |
|
0,115(рН7) |
|
» |
|
|
|
» |
||
|
|
0,601 (рН 0) |
|
|
|
|
|
|
|
|
Вариаминовый синий |
|
0,71 |
|
фиолетовый |
|
|
» |
|||
Дифениламин |
|
0,76 |
|
» |
|
|
бесцветный |
|||
Дифенилбензидин |
|
0,76 |
|
» |
|
|
|
» |
||
п-Этоксихризоидин |
|
0,76 |
|
бледно-желтый |
|
|
красный |
|||
Дифениламин-4- |
|
0,84 |
|
сине- |
|
бесцветный |
||||
сульфоновая кислота |
|
|
|
|
фиолетовый |
|
|
|
|
|
N-Фeнилaнтpaнилoвaя |
|
1,00 |
|
фиолетовый |
|
|
» |
|||
кислота |
|
|
|
|
|
|
|
|
|
|
Ферроин |
|
1,06 |
|
бледно-голубой |
|
|
красный |
|||
Нитроферроин |
|
1,25 |
|
» |
|
|
|
» |
||
