
- •150104, 150702, 200503, Направления 223200
- •С одержание
- •9. Лабораторная работа №7. Определение константы скорости инверсии сахара………………………………………………....31
- •Поверхностные явления лабораторная работа № 1 адсорбция уксусной кислоты углем
- •Цель работы – изучение зависимости величины адсорбции уксусной кислоты от ее концентрации, построение изотермы адсорбции и определение постоянных a0 и b в уравнении Ленгмюра. Порядок выполнения работы
- •Лабораторная работа № 2 определение поверхностного натяжения жидкостей
- •Электролиты
- •Электропроводность электролитов
- •Кондуктометрическое титрование
- •Электродвижущие силы
- •Кинетика химических реакций
- •Определение константы скорости реакции омыления уксусно-этилового эфира
- •Определение константы скорости инверсии сахара
- •394026 Воронеж, Московский просп., 14
- •Методические указания
Электролиты
ЛАБОРАТОРНАЯ РАБОТА № 3
Электропроводность электролитов
Способность электролитов проводить электрический ток характеризуется сопротивлением или электропроводностью. Сопротивление проводника R (Ом) пропорционально его длине l (см) и обратно пропорционально поперечному сечению S (см2):
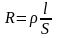 (1)
(1)
где -
удельное сопротивление, зависящее от
природы проводника и температуры.
Величина, обратная удельному сопротивлению,
называется удельной электропроводностью,
обозначается æ и
определяется проводимостью столбика
раствора электролита длиной 1 см и
сечением 1 см2. При этом размерность
удельной электропроводности
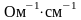 .
Тогда согласно определению
=1/æ, следовательно,
.
Тогда согласно определению
=1/æ, следовательно,
R = 1/Sæ
и (2)
æ .
.
Для характеристики раствора электролита, кроме удельной электропроводности, большое значение имеет так называемая эквивалентная электропроводность , связанная с удельной соотношением:
= (æ/c) ,
(3)
,
(3)
где c – концентрация электролита, выраженная в г-экв/л. Эквивалентная электропроводность численно равна электропроводности такого объема раствора, который содержит 1 г-экв электролита и помещен между параллельными электродами, отстоящими друг от друга на расстоянии 1 см. Эквивалентная электропроводность слабого
электролита связана с подвижностью ионов и степенью диссоциации уравнением:
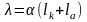 (4)
(4)
где - степень диссоциации; lk – подвижность катиона; la – подвижность аниона. При бесконечном разведении степень диссоциации возрастает, приближаясь к 1. Одновременно возрастает и эквивалентная проводимость, достигая предельного значения 0 в бесконечно разбавленном растворе:
0 = lk + la . (5)
Сравнивая (4) и (5), получаем
=
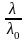 .
Константа диссоциации слабого бинарного
одновалентного электролита, например
уксусной кислоты, может быть найдена
таким образом:
.
Константа диссоциации слабого бинарного
одновалентного электролита, например
уксусной кислоты, может быть найдена
таким образом:
HA
H+ + A-,
 . (6)
. (6)
Если c – концентрация электролита, - степень диссоциации, то равновесные концентрации будут иметь следующие значения:
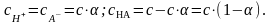
Подставляя эти значения в (6), получаем:
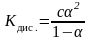 .
.
Зная, что = , имеем выражение для константы диссоциации:
 . (7)
. (7)
Для вычисления электропроводности по уравнению (2) необходимо опытным путем найти сопротивления R и отношение l/S. Последнее зависит лишь от формы и размеров электродов, их относительного расположения, но не от природы электролита и концентрации, т.е. является
11
константой сосуда, в котором производятся измерения (постоянная электролитической ячейки).
Д ля
определения сопротивления исследуемый
раствор наливают в сосуд с двумя
платиновыми электродами, покрытыми
платиновой чернью. Измерение сопротивления
R слоя электролита,
заключенного между электродами,
осуществляется путем сравнения этого
неизвестного сопротивления с известным
с помощью мостика Кольрауша, где AB
– измерительная проволока; R1
и R2 – плечи мостика;
Rэ – магазин
сопротивлений (известное сопротивление);
Rх – сопротивление
сосуда с раствором электролита.
ля
определения сопротивления исследуемый
раствор наливают в сосуд с двумя
платиновыми электродами, покрытыми
платиновой чернью. Измерение сопротивления
R слоя электролита,
заключенного между электродами,
осуществляется путем сравнения этого
неизвестного сопротивления с известным
с помощью мостика Кольрауша, где AB
– измерительная проволока; R1
и R2 – плечи мостика;
Rэ – магазин
сопротивлений (известное сопротивление);
Rх – сопротивление
сосуда с раствором электролита.
Изменяя сопротивление Rэ и передвигая контакт D, находят для него такое положение, при котором нуль-индикатор показывает отсутствие тока. Этому положению контакта соответствует равенство отношений Rх/Rэ и R1/R2, т.е. на участке CD не будет проходить ток, если выполняется равенство
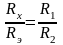 .
.
На практике часто применяют более удобный в обращении мост Р-38. Сосуд (электролитическая ячейка) с платиновыми электродами, наполненный электролитом, присоединяют к контактам Rх. Правила обращения с мостом Р-38 приведены на внутренней стороне крышки прибора.
Цель работы – установление зависимости удельной и эквивалентной электропроводности уксусной кислоты от концентрации, определение константы диссоциации последней.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
При всех измерениях электропроводности первоначально находят константу сосуда l/S по измерению сопротивления раствора электролита-эталона, удельная электропроводность которого известна в широком интервале концентраций и температур. Обычно для этой цели используют раствор хлорида калия. Сосуд для измерения электропроводности ополаскивают дистиллированной водой и 2-3 раза исследуемым раствором. Затем наливают такое количество раствора, чтобы уровень жидкости превышал на 3-5 мм верхний край электродов. При всех измерениях объем жидкости в сосуде должен быть одним и тем же, поэтому наполнять сосуд следует с помощью мерного цилиндра. Наливают 50 мл 0,001 н. раствора хлорида калия и измеряют его сопротивление R, взяв среднее значение из трех определений. По уравнению (2) находят величину l/S:
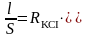 æKCI
æKCI
Зависимость удельной электропроводности 0,001 н. раствора KCI от температуры приведена в таблице:
t, C |
18 |
20 |
25 |
æ, |
0,000127 |
0,000133 |
0,0001473 |
Зная константу сосуда, можно определять удельную и эквивалентную электропроводности любого электролита.
Для выполнения работы в сосуд для измерения электропроводности наливают 50 мл 1н. уксусной кислоты и определяют сопротивление раствора, взяв среднее из трех значений. Закончив измерения с 1н. раствором, отбирают 25 мл этого раствора и добавляют 25 мл воды к оставшимся 25 мл 1 н. раствора уксусной кислоты. Полученный разбавлением 0,5 н. раствор взбалтывают и снова измеряют сопротивление, как указано выше. Подобное последовательное разбавление повторяют еще три раза, получая 0,25; 0,125; 0,0625 н. растворов уксусной кислоты и соответственно измеряя их сопротивление. По формулам (2) и (3) рассчитывают удельную и эквивалентную электропроводности, а по уравнению (7) – константу диссоциации уксусной кислоты для приведенных значений концентраций. Величину предельной эквивалентной электропроводности (0) уксусной кислоты вычисляют по уравнению (5), подставив вместо lk подвижность иона водорода:
lH+ = 315(1 + 0,0154(t –18)),
а вместо la – подвижность аниона уксусной кислоты:
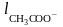 = 35,5(1 + 0,0236(t – 18)),
= 35,5(1 + 0,0236(t – 18)),
где t – температура опыта, C.
Вычисленная константа диссоциации несколько изменяется с концентрацией. Полностью независимой от концентрации является константа диссоциации, выраженная через активность (Ka).
Результаты измерений и вычислений представляют в виде сводной таблицы и двух кривых, изображающих зависимость:
удельной электропроводности от концентрации;
эквивалентной электропроводности от концентрации.
ЛАБОРАТОРНАЯ РАБОТА № 4
