
- •Практикум Общие правила работы в лаборатории
- •Техника безопасности и меры предосторожности
- •1. Основные понятия и законы химии
- •1.1. Семинар: Основные законы и понятия химии
- •1.2. Лабораторная работа №1. Определение эквивалентной и молекулярной массы металла
- •1.3. Контрольные вопросы
- •2. Термодинамика химической реакции
- •2.1. Семинар: Энергетика химических процессов
- •2.2. Лабораторная работа №2 Термодинамика химических реакций
- •2.2.1. Калориметрическое измерение энтальпии реакции нейтрализации
- •2.2.2. Химическая реакция в открытой системе
- •2.2.3. Образование структур при нагревании жидкости
- •2.3. Контрольные вопросы
- •3. Кинетика химической реакции
- •3.1. Семинар: Скорость химических реакций и химическое равновесие
- •3.2. Лабораторная работа №3. Скорость химических реакций
- •3.2.1. Зависимость скорости разложения тиосульфат-ионов от концентрации реагирующих веществ
- •3.2.2. Зависимость скорости реакции от температуры
- •4.2. Семинар: Электролитическая диссоциация
- •4.3. Лабораторная работа №4. Электролиты
- •4.3.1. Определение среды растворов солей
- •4.3.2. Изучение влияния температуры на равновесие гидролиза
- •4.3.3. Исследование поведения двух солей в растворе
- •4.3.4. Исследование буферных растворов
- •4.3.5. Изучение влияние среды раствора на состав ионов хрома (VI)
- •4.3.6. Приготовление растворов заданной концентрации. Титрование
- •4.4. Контрольные вопросы
- •4.5. Семинар: Растворимость малорастворимых соединений
- •5. Окислительно-восстановительные процессы
- •5.1. Семинар: Окислительно-восстановительные реакции
- •5.2. Окислительно-восстановительные процессы
- •6.2. Лабораторная работа №6. Комплексные соединения. Растворы комплексных солей
- •6.2.1. Изучение реакции образования и свойств аммиаката меди (II)
- •6.2.2. Изучение реакций комплексных соединений кобальта (II)
- •6.2.3. Качественные реакции ионов железа (II),(III)
- •6.3. Контрольные вопросы
1.2. Лабораторная работа №1. Определение эквивалентной и молекулярной массы металла
Цель. Освоение экспериментального прибора и применение основных законов химии для определения молекулярной массы металла.
В основе определения лежит реакция:
![]()
Ознакомиться с прибором, привести его в начальное состояние: бюретка должна находиться на таком расстоянии от поверхности лабораторного стола, чтобы ее можно было опустить вниз на 20 – 30 см (рис.1).
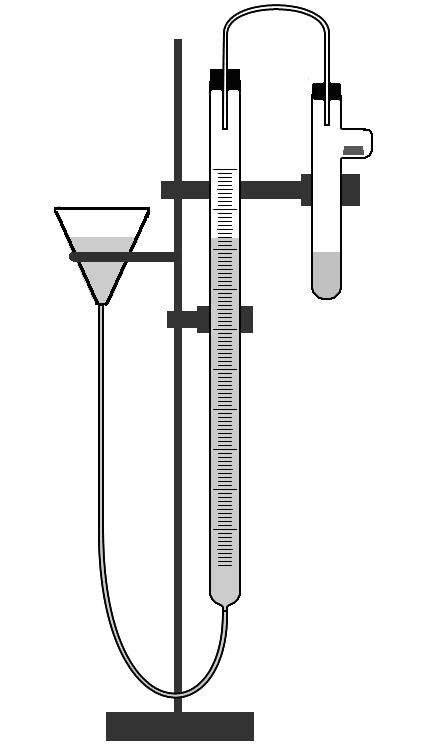
Рис. 1. Прибор для определения молярной массы
Отводную трубку пробирки и пробку, закрывающую отводную трубку необходимо досуха протереть фильтровальной бумагой. Образец металла (массу металла записать в таблицу 1) поместить в отводную трубку и расположить примерно на ее середине. После этого плотно закрыть пробирку.
Провести проверку прибора на герметичность. Для этого передвинуть бюретку на 10 – 15 см. и наблюдать за изменением уровня воды в бюретке в течение 1 – 2 минут. Если высота уровня остается постоянной, то прибор герметичен, если нет, то нужно более плотно вставить пробки в бюретку, пробирку и отводную трубку.
С помощью бюретки уравнять уровни воды в бюретках и записать показания бюретки, т. е. начало отсчета. Показания бюретки нужно определять по нижнему краю мениска воды.
После проведения этих приготовлений прибора к работе, можно начинать опыт. Для этого приподнять пробирку и постучать пальцем по отводной трубке пробирки, чтобы образец металла переместился из отводной трубки в раствор кислоты.
После окончания реакции между металлом и кислотой и охлаждением реакционного сосуда выровнять уровни воды в бюретках и записать положение уровня воды в бюретке, тем самым, определив значение Vк - конечную точку отсчета объема выделившегося водорода.
Результаты эксперимента занести в таблицу 1.
Таблица 1
Экспериментальные данные
Vн мл |
Объем начальный |
Vк мл |
Объем конечный |
Ратм. мм рт. ст |
Атмосферное давление |
Р0 мм рт. ст. |
Нормальное давление |
p Н2О, мм рт. ст. |
Парциальное давление насыщенного пара |
tком, 0С |
температура |
M,г |
Масса образца |
Вычисление:
Согласно закону эквивалентов молярная масса эквивалента металла:
![]() (1)
(1)
Объем водорода приводим к н.у, используя объединенный газовый закон:
![]() (2)
(2)
Учитывая парциальное давление насыщенного пара, вычисляем давление водорода:
![]() (3)
(3)
Изменение уровня жидкости в бюретке соответствует объему, выделившегося водорода при реальных условиях:
![]() (4)
(4)
В формулу (1) поставим данные из формул (2,3,4) с учетом размерности:
![]()
После
расчета молярной массы эквивалента
металла по результатам проведенного
опыта надо идентифицировать металл по
его молярной массе. Для этого по формуле
![]() рассчитать молярную массу для трех
значений валентности (степени окисления)
n,
равных 1, 2 и 3.
рассчитать молярную массу для трех
значений валентности (степени окисления)
n,
равных 1, 2 и 3.
По таблице Д. И. Менделеева выбирается металл, проявляющий соответствующую валентность, для которого расхождение с табличными данными не превышает 1 – 2 г/моль.
После этого надо рассчитать теоретическое значение Мэ(теор.) и ошибку экспериментального определения молярной массы эквивалента металла η по формулам:
![]()
О соответствии полученных результатов с данными периодической системы можно утверждать, если погрешность определения не превышает 5 %.
