
МИНОБРНАУКИ РОССИИ
Нижнекамский химико-технологический институт (филиал)
федерального государственного бюджетного образовательного учреждения
Высшего профессионального образования
«Казанский национальный исследовательский технологический университет»
Кафедра химической технологии органических веществ
КОНТРОЛЬНЫЕ ЗАДАНИЯ
ПО ДИСЦИПЛИНЕ
«ОБЩАЯ ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ»
ДЛЯ СТУДЕНТОВ,
ОБУЧАЮЩИХСЯ ЗАОЧНО
ПО СПЕЦИАЛЬНОСТИ
«ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ»
Разработал ст. преп. кафедры ХТОВ Ионова Н. И.
Нижнекамск 2012
Контрольная работа состоит из четырех заданий. Первые 3 задания являются практическими и отвечают следующим темам: Равновесие химических реакций, Стехиометрия химических превращений и Химические реакторы. Четвертое задание требует ответа на теоретический вопрос. В конце работы необходимо указать список использованной литературы.
Стехиометрия химических превращений.
Стехиометрические уравнения показывают, в каких соотношениях вещества вступают в химическое взаимодействие.
Общий вид стехиометрического уравнения:
![]()
Уравнение устанавливает соотношение между количеством превратившихся веществ:
![]()
Степень превращения вещества – отношение количества превращенного вещества к его первоначальному количеству (1):

Степень
превращения может быть определена для
любого исходного реагента, например,

Из соотношения (1) и определений ХА и ХВ, получим связь между степенями превращения двух исходных веществ:

Можно определить количество любого вещества Ni в реагирующей смеси:
![]()
Если реакция протекает без изменения объема реакционной смеси или не происходит изменения общего количества реагирующих веществ, то степень превращения можно выразить через концентрации:

Для сложной реакции кроме степени превращения вводят дополнительные характеристики процесса: селективность процесса и выход продукта.
Селективность – это отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству исходного реагента, пошедшего на все реакции.
Для двух параллельных реакций:
![]()
селективность по продукту R
![]()
Для двух последовательных реакций:
![]()
селективность по продукту R
![]()
Выход продукта для продукта R
![]()
Уравнение, связывающее степень превращения исходного вещества, выход продукта и его интегральную селективность, имеет вид
![]()
Смещение химического равновесия.
Сместить химическое равновесие – это значит изменением внешних условий добиться преимущественного протекания прямой или обратной реакций. Общие закономерности этого явления были сформулированы Ле- Шателье в 1887 г.:
Если на систему, находящуюся в равновесии, оказывается воздействие извне, то равновесие смещается в сторону той реакции, протекание которой максимально ослабляет внешнее воздействие.
Чаще всего приходится сталкиваться со смещением равновесия в результате следующих изменений условий:
1)температура
Изменение температуры, в отличие от других внешних воздействий, влияет на значение константы равновесия. Повышение температуры вызывает ускорение той реакции, протекание которой сопровождается поглощением тепла (эндотермическая реакция). Напротив, понижение температуры благоприятствует протеканию экзотермической реакции – реакции, сопровождающейся выделением тепла.
2)давление
Повышение давления ускоряет ту реакцию, в которой происходит уменьшение количеств газообразных веществ, а понижение давления – реакцию, сопровождающуюся увеличением количеств газообразных веществ. Если количество газов в ходе реакции не изменяется, то изменение давления не оказывает влияния на положение химического равновесия.
3)концентрации
Добавление в реакционную систему какого-либо компонента смещает равновесие в сторону той реакции, где тот компонент расходуется. Отвод какого-либо вещества из реакционной системы, напротив, ускоряет реакцию, в которой это вещество образуется.
Реакторы идеального вытеснения.
РИВ-н – реакторы непрерывного действия, в которых осуществляется ламинарный гидродинамический режим.
В РИВ температура по длине реактора изменяется, что соответственно ведет к изменению константы скорости реакции. При расчете РИВ температуру, константу скорости считают постоянными.
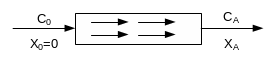
Внешний поток реагентов движется в одном заданном направлении, не перемешиваясь и вытесняя подобно поршню находящийся впереди частицы потока.
![]()
Время пребывания всех частиц в таком реакторе постоянно.
![]()
Все характеристики (концентрация, температура, степень превращения) изменяются плавно по объему реактора. Параметры процесса непостоянны во времени и по высоте трубы.

1)изменение концентрации реагентов;
2)изменение скорости реакции;
3)изменение степени превращения.
Данные уравнения позволяют определить время пребывания реагента для достижения заданной степени превращения, а затем и размеров реактора.
Для реакции нулевого порядка:
![]()
Для реакции первого порядка:
![]()
Для реакции второго порядка:
![]()
Реакторы идеального полного смешения (РИС-н).
РИС
– реактор непрерывного действия, в
котором осуществляется режим
гидродинамического действия. В нем
потоки реагентов смешиваются друг с
другом и с продуктами химического
превращения.

Во время его работы соблюдается стационарный режим, т.е. постоянство характеристик во времени. Нестационарный режим наблюдается во время пуска и остановки. В РИС-н перемешивающие устройства работают так интенсивно, что попадающие в реактор потоки реагента равномерно и мгновенно перемешиваются по объему всего реактора. В результате чего выравниваются параметры, которые характеризуют процесс.
Характеристические графики РИС-н во времени и объеме реактора.

СА0, СА – начальная и конечная концентрации реагентов в реакторе.
WA0, WA – начальная и конечная скорости процесса в реакторе.
Если известна кинетика процесса, то возможно рассчитать время, которое необходимо для достижения требуемой степени превращения.
Для
необратимой реакции нулевого порядка
![]()
![]()
Для реакции первого порядка:
![]()
Зависит только от степени превращения и не зависит от концентрации СА0.
Для реакции второго порядка:

