
1.2. Основные законы химии.
М.В.Ломоносов в 1748 г. открыл и в последующем экспериментально подтвердил один из основных законов химии закон сохранения массы: масса веществ, вступающих в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Относительные атомные и молекулярные массы являются мерой масс атомов и молекул, поэтому они позволяют сделать вывод о соотношении масс атомов различных элементов в молекуле сложного вещества.
В молекуле воды Н2О содержатся два атома водорода и один атом кислорода, следовательно, массовое отношение водорода и кислорода в воде равно 2:16 (Ан = 1,008 а.е.м., А0 = 16,00 а.е.м.).
Соотношения атомных масс элементов в соединениях устанавливает закон постоянства состава, выведенный Прустом: каким бы способом ни было получено вещество, его химический состав остается постоянным.
В каждом сложном веществе, независимо от способа его получения, сохраняются неизменными соотношения чисел атомов и масс атомов, входящих в его состав элементов. Закон постоянства состава отражает именно атомный состав вещества: в молекулу вещества объединяется определенное число именно атомов одного или различных элементов. Молекулу воды создают два атома водорода и один атом кислорода.
Закон кратных отношений, открытый Дальтоном, гласит: если два элемента образуют между собой несколько соединений, то массы атомов одного элемента, приходящиеся на одну и ту же массу атомов другого элемента, соотносятся между собой как небольшие целые числа.
Пример. Сера образует оксиды - диоксид SO2 и триоксид SO3. Относительные атомные массы серы и кислорода равны соответственно 32 и 16. Массовое отношение серы и кислорода в SO2 равно 32:32, а в SO3 32: 48. Отсюда следует, что на каждые 32 массовые части серы в этих соединениях приходится 32 и 48 массовых частей кислорода, т.е. соотношение массовых частей 2:2 и 2: 3.
Закон Авогадро: в равных объемах различных газов при одинаковых физических условиях содержится одно и то же число молекул.
Из
положений о том, что один моль любого
вещества включает число частиц этого
вещества, равное числу Авогадро, и что
равные числа частиц различных газов
при одинаковых физических условиях
содержатся в равных объемах этих
газов, вытекает следствие: равные
количества любых газов при одинаковых
физических условиях занимают равные
объемы. В частности, объем одного моля
любого газа имеет при р, Т = const
одно и то же значение. Объем газа (при
р, Т = const),
содержащий 1 моль вещества или число
частиц этого вещества, равное числу
Авогадро, называется молярным
объемом, обозначается
Vm.
При
нормальных условиях (p=101,3
кПа, t=00)
молярный объем идеального газа равен
Vm=2,241383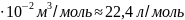 .
.
Массы равных объемов различных газов при одинаковых температуре и давлении относятся друг к другу, как молекулярные (молярные) массы этих газов.
m1/m2 = M1/M2
где m1 и m2 - массы газов, M1 и М2 - молярные массы газов.
Отношение массы одного газа к массе того же объема другого газа, взятых при одинаковых температуре и давлении, называется относительной плотностью D первого газа по второму.
D = m1/m2, тогда D = M1/М2, откуда M1= D M2
Молярная масса газа равна его относительной плотности, умноженной на молярную массу второго газа, по которому определялась плотность.
Часто молярную массу газа вычисляют, исходя из его плотности по водороду или по воздуху, принимая МН2 = 2 г/моль, Мвозд = 29 г/моль, тогда получим следующие уравнения для вычисления молярных масс: Мг= 2 DH; Мг= 29 Dвозд,
Задача. Плотность газа по воздуху равна 2,562. Вычислите массу 10-3м3 газа при нормальных условиях (н.у.).
