
- •Расчётно-графическое задание 4 расчёт характеристик поляризации разреженного водяного пара
- •1. Краткие теоретические сведения
- •1.1. Введение
- •1.2. Электрические свойства вещества
- •1.3. Характеристики процесса поляризации
- •Поляризуемость и ее составляющие (1, 2,3) (Леше а.,1987). Для перевода в si значения необходимо умножить на 40
- •Выражение (11) в скалярной форме можно записать в виде
- •Поле Лорентца
- •1.4. Диэлектрическая проницаемость вещества
- •1.5. Формула Клаузиуса – Моссотти и молярная рефракция
- •Молярная рефракция
- •1.6. Теория поляризации полярных газов. Разреженный газ
- •Теория Дебая
- •1.7. Теория поляризации конденсированных сред Формула Онзагера
- •Формула Кирквуда
- •Теория Фрелиха и ее модификации
- •1.8. Растворы
- •2. Содержание задания
- •Часть I. (Общие понятия)
- •Часть II (экспериментальные данные водяного пара)
- •Часть III (Конденсированное состояние вещества)
- •Часть IV (Молярная рефракция газообразного вещества)
- •3. Контрольные задачи
- •Литература, рекомендуемая для самостоятельной работы
Поляризуемость и ее составляющие (1, 2,3) (Леше а.,1987). Для перевода в si значения необходимо умножить на 40
Молекула |
1, , м3 |
2, , м3 |
3, , м3 |
, , м3 |
CO2 |
4,10 |
1,93 |
1,93 |
2,65 |
NH3 |
2,42 |
2,18 |
2,18 |
2,26 |
H2S |
4,21 |
3,21 |
3,93 |
3,78 |
SO2 |
5,49 |
2,72 |
3,49 |
3,90 |
HCl |
3,13 |
2,39 |
2,39 |
2,64 |
Cl2 |
6,6 |
3,62 |
3,62 |
4,61 |
Ориентационная и деформационная поляризации показаны на рис. 4, где Е0 – напряженность внешнего электрического поля, Е поле, создаваемое ориентируемыми зарядами.
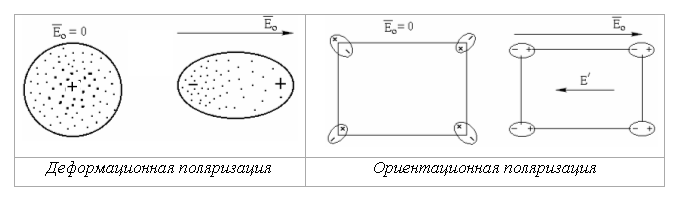
Рис. 4. Деформационная и ориентационная поляризации
В табл. 2 и 3 приведены значения поляризуемостей некоторых молекул.
Таблица 2
Средние значения поляризуемости молекул (П.Эткинс, Т. 2, 1980). Для перевода в SI необходимо умножить значения 0 ( 8.8541912 Ф/м)
Молекула |
, 10-30, м3 |
Молекула |
, 10-30, м3 |
СО2 |
33,3 |
C6H6 |
129,7 |
Н2О |
18,6 |
H2 |
9,93 |
NH3 |
27,8 |
N2 |
22,1 |
Cl4 |
127 |
He |
2,5 |
CH4 |
32,7 |
Ar |
20,1 |
Таблица3
Средние значения поляризуемости молекул (Кр. справ., физ.-хим. величин, 1983). Для перевода в SI значения необходимо умножить на 40
Молекула |
, 10-30, м3 |
Молекула |
, 10-30, м3 |
СО2 |
2,594 |
HCl |
2,561 |
Н2О |
1,444 |
H2 |
0,802 |
NH3 |
2,145 |
N2 |
1,734 |
SO2 |
3,774 |
He |
0,203 |
Cl4 |
10,14 - 10,04 |
Ar |
1,626 |
H2S |
3,642 |
Xe |
3,999 |
Диэлектрическая восприимчивость вещества d
Диэлектрическая восприимчивость – поляризуемость единицы объема вещества. В гауссовой системе единиц dn. В СГСЭ диэлектрическая восприимчивость – величина безразмерная. В Международной системе единиц (СИ) диэлектрическая восприимчивость записывается в виде
d (n/0). (4)
В СИ диэлектрическая восприимчивость также является безразмерной величиной, так как (СИ) 40(СГСЭ).
Молярная поляризация вещества Рм
Молярная поляризация вещества – поляризуемость моля частиц – определяется по формуле
Рм d V0 nV0/0 (NА/0). (5)
Молярная поляризация вещества в Си и СГСЭ измеряется в единицах объема на моль: в СИ – м3моль-1, в СГСЭ – в см3моль-1.
У полярного диэлектрика по сравнению с неполярным молярная поляризация в значительной степени зависит от температуры. С повышением температуры поляризуемость неполярной молекулы несколько уменьшается вследствие уменьшения напряженности поля в веществе. (Следует отметить, что данный вопрос практически не изучен.).
При внесении молекулы в электрическое поле происходит изменение ее дипольного момента: полярные молекулы увеличивают значение дипольного момента от до р, неполярные молекулы приобретают индукционный дипольный момент. Дополнительный (индукционный) дипольный момент появляется благодаря деформационной поляризуемости молекул и называется деформационным дипольным моментом рдеф:
рдеф.i деф.i Fi, (6)
где деф.i – деформационная поляризуемость i-й молекулы; Fi напряженность электрического поля в месте расположения i-й молекулы.
Деформационная поляризуемость молекулы не является постоянной величиной. В сильных электрических полях (в лазерных лучах, внутри вещества) деформационная поляризуемость молекулы (при допущении, что в слабых полях деф = эл) определяется по формуле
деф = эл + (1/2!)1 F + (1/3!)2 F2 + …, (7)
где i гиперполяризуемость молекулы i-го порядка. Подставив (7) в выражение (6), получим Выражение для рдеф может быть представлена в виде
рдеф =элF + (1/2)1F2 + (1/6)2F3+... (8)
В случае слабых электрических полей эл деф, поэтому
рдеф элF. (9)
Из выражения (9) следует, что поляризуемость молекулы представляет собой физическую величину, равную индукционному дипольному моменту, появляющемуся в поле единичной напряженности. Следовательно, поляризуемость в СИ измеряется в Клм2В-1 (Фм2) или в Кл2м2Дж-1 (Atkins P.W.,1990), в СГС – в единицах объема, т. е. в см3:
1 = 1p/1F = 1 ед. СГСЭq 1 ед. L СГСЭl / 1 ед. СГСЭq / 1ед. L2 = L3.
Нетрудно заметить, что поляризуемость в СИ и СГСЭ соотносятся следующим образом:
(СИ) 40(СГСЭ)10-6. (10)
Следует отметить, что в учебной литературе поляризуемость молекулы в СИ часто измеряется единицах объема (м3) и называется геометрической поляризуемостью. Использование двух понятий поляризуемости нежелательно, так как в этом случае формулы для характеристик поляризации, связанные с поляризуемостью, имеют различный вид:
pдеф.i деф.i Fi; pдеф.i 0деф.i Fi; р деф.i 40деф.i Fi.
Именно по этой причине в большинстве случаев используется гауссова система единиц.
Примечание. Некоторые соотношения и принятые обозначения характеристик поляризации в СИ и СГСЭ (Киттель Ч., 1987):
(СГСЭ): D E + 4P Е pдеф / F; P E;
(СИ) : D 0E + P 0 )0 pдеф / F; P 0E;
(СИ) (СГСЭ); (СИ) 4 (СГСЭ); (СИ) 40(СГСЭ) 10-6..
Дипольный момент молекулы
Дипольный момент молекулы в веществе принято обозначать р, а дипольный момент молекулы в вакууме – . При внесении молекулы в электрическое поле распределение зарядовой плотности молекулы изменяется: неполярные молекулы приобретают индукционный дипольный момент рдеф, полярные молекулы увеличивают значение дипольного момента от до р. В общем случае величина дипольного момента i-й молекулы в среде
рi I + рдеф.i. (11)
