
- •Российский университет дружбы народов
- •К практическим занятиям по биохимии
- •Авторский коллектив:
- •Предисловие как пользоваться этим учебным пособием?
- •Список сокращений и условных обозначений
- •Техника безопасности при работе в биохимической лаборатории
- •1. Общие требования безопасности
- •Классификация химических реактивов в биохимической лаборатории
- •2. Требования безопасности перед началом работ
- •3. Требования безопасности во время работы
- •4. Требование безопасности в аварийных ситуациях
- •5.Требование безопасности по окончании работы
- •Раздел 1: Аминокислоты и простые белки Введение
- •1.1 Проверка знаний по органической химии
- •1.2. Цветные реакции на белки и аминокислоты. Реакции осаждения и денатурации белков а. Цветные реакции на белки и аминокислоты
- •Б. Реакции осаждения и денатурации белков
- •1.3. Количественное определение белка биуретовым методом. Построение калибровочных кривых
- •1 .4. Диализ белков. Бумажная хроматография аминокислот
- •А. Диализ
- •1.5. Коллоквиум I по теме «Аминокислоты и простые белки»
- •Раздел 2: Сложные белки, нуклеиновые кислоты и ферменты Введение
- •2.1 Действие амилазы на крахмал. Влияние температуры на активность амилазы а. Действие амилазы на крахмал
- •Б. Изучение влияния температуры на скорость ферментативной реакции
- •2.2. Количественное определение активности щелочной фосфатазы в сыворотке крови с п-нитрофенилфосфатом
- •2.3. Коллоквиум II по теме: «Сложные белки, нуклеиновые кислоты и ферменты» Вопросы, для самостоятельной подготовки
- •Варианты письменной части коллоквиума
- •Варианты заданий на компьютерном тестировании
- •Правильные ответы
- •Раздел 3: Витамины, липиды, гормоны Введение
- •3.1. Количественное определение витаминов с и р.
- •3.3. Влияние гормонов на содержание глюкозы в крови
- •3.4. Коллоквиум III по теме «Витамины, липиды, гормоны»
- •Раздел 4: Метаболизм. Биоэнергетика клеток. Химия и обмен углеводов Введение
- •4.1. Специфичность действия ферментов распада углеводов: амилазы и сахаразы
- •4.2. Количественное определение глюкозы. Построение «сахарных кривых»
- •4.3. Определение активности сукцинатдегидрогеназы в мышцах. Количественное определение пирувата в моче
- •4.4 Коллоквиум IV по теме: «Метаболизм. Биоэнергетика клеток. Химия и обмен углеводов»
- •Правильные ответы
- •Раздел 5: Обмен липидов и его регуляция Введение
- •5.1. Кинетика действия липазы.
- •5.2. Количественное определение фосфатидилхолинов (лецитинов) по фосфору
- •I. Приготовление рабочего раствора сыворотки.
- •II. Определение концентрации фосфатидолхолинов по содержанию фосфора.
- •5.3. Количественное определение холестерина в сыворотке крови
- •5.4. Количественное определение малонового диальдегида
- •5.5. Коллоквиум по теме «Обмен липидов»
- •Раздел 6: Переваривание белков и обмен аминокислот
- •6.1. Количественный анализ желудочного сока. Определение свободной, связанной, общей соляной кислоты и общей кислотности желудочного сока.
- •6.2. Количественное определение аспартатаминотрансферазы и аланинаминотрансферазы в сыворотке крови
- •6.3. Доказательство проявления активности аланин-аминотрансферазы (АлАт) методом бумажной хроматографии
- •6.4. Экспресс-метод определения повышенного содержания фенилаланина в плазме крови
- •6.5. Количественное определение мочевины в моче ферментативным уреазным/фенол-гипохлоритным методом
- •6.6. Количественное определение креатинина в моче
- •6.7. Коллоквиум по теме: «Обмен простых белков» Вопросы, для самостоятельной подготовки
- •Варианты письменной части коллоквиума
- •Правильные ответы
- •Раздел 7: Обмен хромопротеинов и нуклеопротеинов. Биохимия крови и мочи. Биосинтез нуклеиновых кислот и белков. Введение
- •7.1. Определение общего билирубина в сыворотке крови
- •7.2. Количественное определение мочевой кислоты в моче
- •7.3. А. Определение активности -амилазы в моче
- •7.3. Б. Составные части мочи в норме и при патологии
- •7.4. Определение активности холинэстеразы в сыворотке крови
- •7.5. Определение активности лактатдегидрогеназы в сыворотке крови
- •7.6. Коллоквиум по теме: «Обмен хромопротеинов и нуклеопротеинов. Биохимия крови и мочи. Биосинтез нуклеиновых кислот и белка». Вопросы, для самостоятельной подготовки
- •Варианты письменной части коллоквиума
- •Правильные ответы
- •Раздел 8: Подготовка к экзамену
- •8.1. Основные вопросы, выносимые на обсуждение
- •8.2. Пример экзаменационного тестового задания по курсу биохимии
- •59. Найти соответствие между процессом и его графическим изображением
- •60. Цикл мочевинообразования установил
- •Ответы к экзаменационному тесту
- •Раздел 9: Приложения
- •9.1. Термины, различающиеся по смыслу, но сходные по написанию и звучанию
- •9.2. Стандартные биохимические наборы и реактивы, используемые в практикуме
- •9.3. Рекомендуемая литература
- •Содержание
- •Раздел 7: Обмен хромопротеинов и нуклеопротеинов. Биохимия крови и мочи. Биосинтез нуклеиновых кислот и белков. 126
- •Раздел 8: Подготовка к экзамену 148
- •Раздел 9: Приложения 161
2.2. Количественное определение активности щелочной фосфатазы в сыворотке крови с п-нитрофенилфосфатом
Щелочная фосфатаза содержится в тканях и крови, гидролизует эфиры фосфорной кислоты и в норме поступает в кровь из печени, костной ткани, селезенки, почек, тонкого кишечника и плаценты.
Клинико-диагностическое значение
В клинической практике обычно определяют активность щелочной фосфатазы в сыворотке крови. Активность возрастает при тяжелом рахите, заболеваниях печени (механическая желтуха, острые гепатиты, циррозы), различных заболеваниях костной системы и снижается при хроническом гломерулонефрите, квашиоркоре, гипотиреозе и цинге.
Цель работы
Определить активность щелочной фосфатазы в сыворотке крови и сравнить результаты с нормой.
Принцип метода
Щелочная фосфатаза катализирует гидролиз моноэфиров ортофосфорной кислоты. В качестве субстрата используют бесцветный раствор п-нитрофенилфосфата. В результате реакции освобождается п-нитрофенол, окрашенный в щелочной среде в желтый цвет. В качестве буфера используют 1 М раствор диэтаноламина с хлористым магнием (0,5 мМ). Останавливают реакцию 0,5 М раствором NaОН. Скорость образования в результате реакции окрашенного п-нитрофенола пропорциональна активности щелочной фосфатазы. Активность щелочной фосфатазы сильно зависит от субстрата и от буферной системы, в которой проводится анализ. В силу этого недопустимо сравнивать результаты, полученные в различных буферных системах. Соответственно, и нормальные значения активности щелочной фосфатазы при определении в различных буферных системах существенно различаются.
Реакция протекает по уравнению:
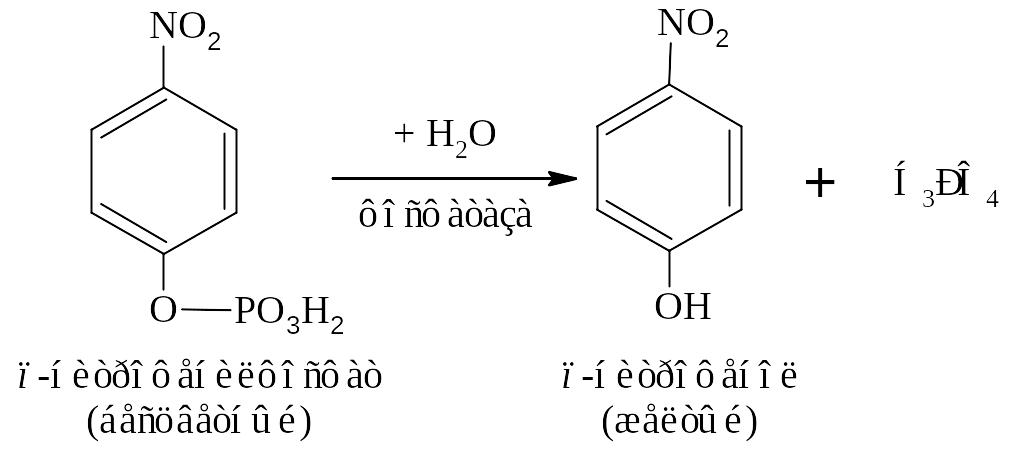
Выполение работы (см. приложение)
Реагенты |
Опыт |
Контроль |
5 мМ раствор субстрата п-нитрофенилфосфата в буфере, мл |
1,0 |
1,0 |
Вода дистиллированная, мл |
— |
0,05 |
Выдерживают 5 минут при температуре 37С в термостате |
||
Сыворотка крови, мл |
0,05 |
— |
Тщательно перемешивают, замечают время и инкубируют ровно 5 минут при температуре 37С в термостате |
||
Раствор NaOH (0,5 М), мл |
1,5 |
1,5 |
Фотометрируют против Н2О ( = 405 нм, толщина кюветы 0,5 см). D405 |
|
|
Dоп - Dк |
|
|
Расчеты
Активность щелочной фосфатазы в Е/л (международные единицы активности, мкмоль.мин-1.л-1) рассчитывают по формуле:
![]() =
=
где: V1 – конечный объем пробы, мл
106 – коэффициент пересчета моль в мкмоль
V2 – объем сыворотки, мл
18,3![]() 103
–коэффициент
молярной экстинкции п-нитрофенола,
л.см-1.моль-1
103
–коэффициент
молярной экстинкции п-нитрофенола,
л.см-1.моль-1
l – толщина кюветы, см
t – время инкубации пробы, мин
Норма: взрослые: при температуре анализа 25С – 40-170 Е/л
при температуре анализа 37С – 70-270 Е/л
У детей определение активности щелочной фосфатазы не имеет диагностического значения.
Выводы
Тестовые задания по теме: «Ферменты»
1) Ответить на каждый вопрос однозначно: «да» или «нет»
Специфичность действия сложных ферментов определяется коферментом.
Активный центр фермента состоит из субстратсвязывающего и каталитического участков.
Скорость ферментативной реакции не зависит от концентрации субстрата.
Ферменты ускоряют протекание как прямой, так и обратной реакции.
Скорость ферментативной реакции всегда увеличивается с увеличением рН среды.
Пепсин обладает абсолютной специфичностью действия.
Всегда ли происходит образование фермент-субстратного комплекса в процессе ферментативной реакции?
Зависит ли скорость ферментативного процесса от количества присутствующего фермента?
Влияют ли ионы тяжелых металлов на активность фермента?
Можно ли разделить ферменты методом высаливания сульфатом аммония?
Известны ли ферменты, обладающие стереоспецифичностью действия?
Связано ли действие некоторых лекарственных препаратов с ингибированием отдельных ферментов?
Все ферменты состоят из субъединиц.
Константа Михаэлиса выражается в единицах концентрации субстрата.
Изоферменты катализируют одну и ту же химическую реакцию.
Первая цифра в шифре фермента обозначает, к какому классу он относится.
В основе классификации ферментов лежит тип катализируемой реакции.
Изоферменты имеют различную электрофоретичекую подвижность.
Осуществляют ли лигазы расщепление соединений по двойным связям?
Существуют ли мультиферментные комплексы?
Изменяется ли константа Михаэлиса в присутствии конкурентного ингибитора?
Можно ли измерять скорость ферментативной реакции по изменению свойств молекулы кофермента?
Всегда ли ингибирование фермента необратимо?
Используют ли препараты очищенных ферментов в терапевтических целях?
Обратимость ферментативной реакции зависит от:
|
К классу оксидоредуктаз не относится фермент:
|
2) Выбрать один правильный ответ
Фермент, не относящийся к гидролазам:
|
Конкурентные ингибиторы:
|
3) Найти соответствие между типом ингибирования ферментативной реакции и его графическим изображением
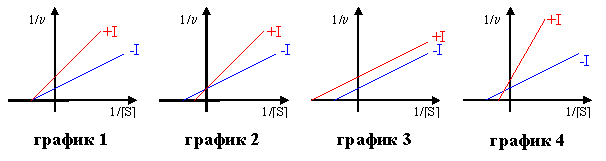
А. конкурентное
Б. неконкурентное
В. смешанное
Г. бесконкурентное
