- •Введение.
- •1.Термогравиметрия.
- •1.1.Измерение температуры.
- •1.2.Оценка кривой дта.
- •1.3.Оценка кривой дтг.
- •1.4.Оценка кривой тг
- •1.5.Установка “Дериватограф-к q-1500d”
- •2.2.2 Интерфейсная программа.
- •. Главное окно интерфейсной программы.
- •. Главное окно лабораторной версии интерфейсной программы.
- •1.6.Калибровка установки в целом.
- •Термогравиметрические кривые прокаливания оксида алюминия (инертное вещество) в малой печи.
- •Термогравиметрические кривые прокаливания оксида алюминия (инертное вещество) в большой печи.
- •Теоретическая термогравиметрическая кривая разложения пентогидрата сульфата меди.
- •. Теоретическая термогравиметрическая кривая разложения сульфата меди при квазиизотермическом методе измерения.
- •Экспериментальные термогравиметрические кривые разложения пентагидрата сульфата меди.
- •1.7.Применение установки для исследования разложения карбоната кальция.
- •. Термогравиметрические кривые разложение карбоната кальция (мокрый мел).
- •. Термогравиметрические кривые карбоната кальция (мокрый мел), удаление воды.
- •1.8.Применение установки для исследования разложения сульфата алюминия.
- •Термогравиметрические кривые разложения сульфата алюминия.
- •2.6. Применение установки для исследования цемента.
- •Термогравиметрические кривые невысохшего цемента (удаление воды).
- •Список литературы
Термогравиметрические кривые прокаливания оксида алюминия (инертное вещество) в малой печи.

Термогравиметрические кривые прокаливания оксида алюминия (инертное вещество) в большой печи.
Применение установки для исследования разложения пентагидрата сульфата меди.
Рассмотрим преимущества квазиизотермического метода исследования на примере разложения пентагидрата сульфата меди.
Растяженность ступени может привести к такой ошибке, при которой две следующие друг за другом ступени процесса распада могут слиться, или, в предельном случае, образовать общую ступень. Это и происходит в случае распада пентагидрата сульфата меди.
Из пробы первые четыре моля кристаллизационной воды отделяются независимо друг от друга в форме 2+2 моля, но это обстоятельство из-за близости ступеней кривой однозначно не распознаётся.
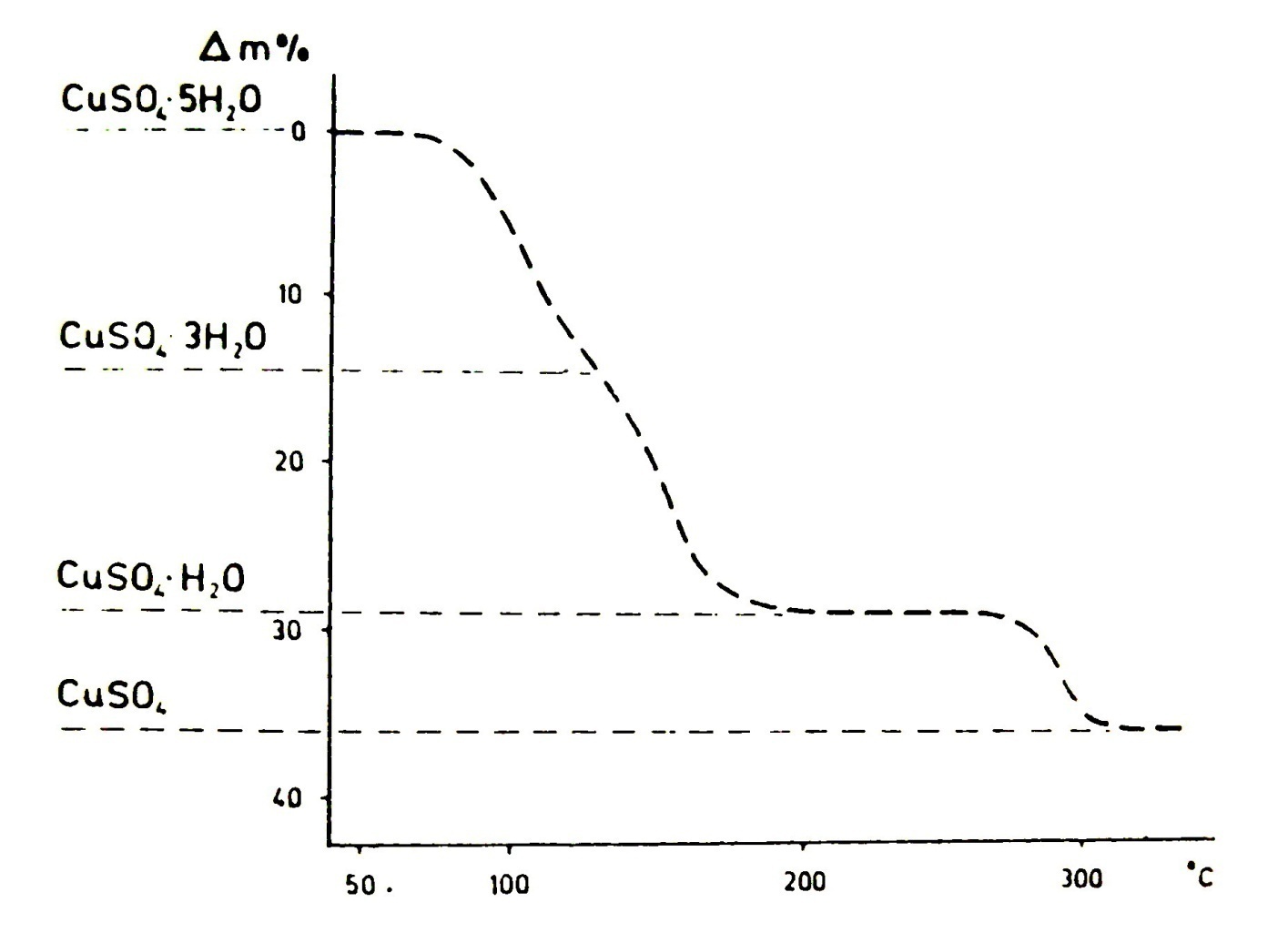
Теоретическая термогравиметрическая кривая разложения пентогидрата сульфата меди.
Первый источник ошибок, т.е. удлинение температуры распада, вызывается, прежде всего, перепадом температуры внутри пробы, а это является последствием применения динамического нагрева. Чем быстрее нагрев во время исследований, тем более ярко наблюдается это явление. При медленном нагреве, или при изотермическом исследовании, ошибка наблюдается значительно реже. Желаемый нагрев со скоростью 0.1-0.2oС/мин в практических исследованиях осуществляется из-за большой потребности времени. Лишь незначительную часть такого времени исследования составило бы то время, за которое происходил бы процесс распада, а большая часть времени уходила бы на медленный нагрев без распада образца.
Квази-изотермическое регулирование с большой скоростью (2-5oС/мин) увеличивает температуру пробы до начала распада. Но, начиная с этого момента, увеличение температуры прекращается, вернее пробор регулирует температуру так, чтобы уменьшение веса происходило с очень малой, постоянной скоростью. Величину скорости уменьшения веса перед началом замера можно установить путем изменения порога чувствительности усилителя.
Исследуя процесс отщепления кристаллизационной воды пентагидрата сульфата меди квази-изотермическим методом, можно получить термограмму, показанную на рисунке 4-2. Можно установить две очевидные разницы между ходом кривых динамического и квазиизотермического исследования. Если в случае динамического нагрева температура распада удлиняется, то при квази-изотермических измерениях процессы распада происходят при постоянной температуре. Второе отличие заключается в том, что в случае квази-изотермического измерения дважды два моля кристаллизационной воды пентагидрата сульфата меди появляются в форме двух, независимых друг от друга ступеней, несмотря на то, что разница температур между двумя ступенями составляет всего только 10oС. [13]

. Теоретическая термогравиметрическая кривая разложения сульфата меди при квазиизотермическом методе измерения.

Экспериментальные термогравиметрические кривые разложения пентагидрата сульфата меди.
1.7.Применение установки для исследования разложения карбоната кальция.
Распад карбоната кальция при условиях, аналогичных указанным в предыдущем опыте, был исследован квази-изотермическим методом. Результаты приведены на Рисунке 5-4, где кривые динамического нагрева изображены пунктирной линией. Как видно по кривым, при квази-изотермическом измерении распад карбоната кальция происходит при постоянной температуре, в случае проведения исследования как в тарельчатом держателе проб, так и в открытом и накрытом тигле. Различия между кривыми наблюдаются из-за того, что преобразования происходят в первом случае при 640, во втором при 700, а в третьем - при 780oС. Это является последствием того, что имеется различие в возможности удаления освободившейся окиси углерода карбоната кальция из окружающей пробу среды, и в результате этого из внутренней части зерен тоже. Двуокись углерода, образовавшаяся в результате разложения карбоната кальция на тарельчатом прободержателе без особых трудностей, непрерывно может удаляться из среды пробы. В соответствии с этим при 640oС преобразование полностью происходит. Температура разложения, равная 640oC, свидетельствует о том, что в процессе разложения в среде пробы парциальное давление СО2 в воздухе составило всего 5 торр. Кривая 2 показывает распад при более высокой температуре. Причина этого - отличная от предыдущего случая форма прободержателя. В случае 3 наблюдается дальнейшее увеличение температуры, что является последствием закрытия тигля крышкой. Температура 780оС, наблюдаемая в случае кривой 3, соответствует парциальному давлению двуокиси углерода, равному окружающему - 120 торр.
Из полученных результатов можно сделать вывод, что форма прободержателя значительно влияет на температуру разложения. Но в результате других обстоятельств измерения: величины навески, зернистости пробы и его растворимости, тоже могут привести к отклонениям аналогичного характера. Если в случае одинаковых условий эксперимента, например, величина карбоната кальция в пробе изменяется от 1% до 90%, то сугубо это обстоятельство значительно отодвинет место ступени в сторону высших или низших температур.
Лабиринтовый и канонический прободержатели
|
|

Теоретическая термогравиметрическая кривая разложения карбоната кальция при квазиизотермическом методе исследования
При использовании обычных тиглей от начала разложения в атмосфере, окружающей пробу, парциальное давление газообразного продукта составляет приблизительно 1 атмосферу. Это значит, что разложение вещества происходит в чистой, почти 100%-ной собственной газовой атмосфере. С целью образования газовой атмосферы, исследуемое вещество необходимо поместить в держатель проб, не препятствующий непрерывному удалению продуктов распада, но в то же время полностью препятствующий продиффундированию воздуха в тигель, предполагая вероятность того, что скорость разложения достигает определенной минимальной величины. Это достигается применением лабиринтового держателя проб, изображенного на рисунке 5, который состоит из трех тиглей и трех крышек. Тигли и кромки крышек плотно прилегают друг к другу. При сборке держателя проб между пространством, окружающим пробу и внешней средой образуется длинный, узкий лабиринтовый зазор, следовательно выполняется то требование, что газообразные продукты разложения беспрепятственно могут удаляться, но извне воздух не может продиффундировать внутрь.
Согласно исследованиям, приведенным с модельным карбонатом кальция, в случае скорости распада, равной 0.4 мг/мин, лабиринтовый тигель-держатель проб в процессе эксперимента практически создает 100%-атмосферу СО2.
В случае кривых, изображенных на Рисунке 1, причиной отклонения (сдвига) ступени в сторону меньших или больших температур является то, что концентрация газообразных продуктов разложения в пространстве около пробы изменяется в зависимости от условий проведения эксперимента. При использовании этих тиглей, после начала разложения, концентрация газа сохраняется постоянной и пробу окружает чистый продукт разложения, с давлением в одну атмосферу.
Из этого следует, что температура исследований, приведенных в этом тигле, не зависит от тех факторов, которые обычно влияют на концентрацию продуктов разложения в пространстве, окружающем пробу. Место ступени становится независимым от того, содержит ли пробы карбонат кальция величиной в 1 или 100 процентов, не зависит от зернистости пробы, от величины навески и других факторов. Эти исследования называют квазиизобарными.
В экспериментальных условиях квазиизотермического и квазиизобарного исследований, при измерении с новой программой нагрева и в новых тигелях-прободержателях, процессы изменения веса происходят при достаточно хорошо определяемой температуре. Это соответствует той температуре разложения, при которой газ, образовавшийся при разложении пробы, достигает давления величиной в 1 атмосферу, вернее величины атмосферного давления. В таких условиях, термографиметрическая температура разложения не зависит от условий исследования, она исключительно определяется материальными свойствами пробы.
При квазиизотермических и квазиизобарных условиях получаем кривую 4, которая показывает разложение карбоната кальция при 890оС, т.е. при температуре, при которой - согласно литературным данным - парциальное давление двуокиси углерода, образовавшейся при разложении карбоната кальция, достигает одной атмосферы.[13]