
- •Глава 8. Физико-химические методы очистки сточных вод
- •8.1. Коагуляция и флокуляция
- •8.2. Флотация
- •8.3. Адсорбция
- •8.4. Ионный обмен
- •8.5. Экстракция
- •8.6. Обратный осмос и ультрафильтрация
- •8.7. Десорбция, дезодорация и дегазация
- •8.8. Электрохимические методы
- •Глава 9. Химические методы очистки сточных вод
- •9.1. Нейтрализация
- •9.2.Окисление и восстановление
- •9.3. Удаление ионов тяжелых металлов
- •Глава 10. Биохимические методы очистки сточных вод
- •10.1. Общие положения
- •10.2. Закономерности распада органических веществ
- •10.3. Влияние различных факторов на скорость биохимического окисления
- •10.4. Очистка в природных условиях
- •10.5. Очистка в искусственных сооружениях
- •10.6. Анаэробные методы биохимической очистки
- •10.7. Обработка осадков
- •10.8. Рекуперация активного ила
- •Глава 11. Термические методы очистки сточных вод
- •11.1. Концентрирование сточных вод
- •11.2. Выделение веществ из концентрированных растворов
- •11.3. Термоокислительные методы обезвреживания
10.2. Закономерности распада органических веществ
Для того чтобы происходил процесс биохимического окисления органических веществ, находящихся в сточных водах, они должны попасть внутрь клеток микроорганизмов. К поверхности клеток вещества поступают за счет конвективной и молекулярной диффузии, а внутрь клеток — диффузией через полупроницаемые цитоплазматические мембраны, возникающей вследствие разности концентраций веществ в клетке и вне ее. Однако большая часть вещества попадает внутрь клеток при помощи специфического белка-переносчика. Образующийся растворимый комплекс вещество-переносчик диффундирует через мембрану в клетку, где он распадается, и белок-переносчик включается в новый цикл переноса.
Основную роль в процессе очистки сточных вод играют процессы превращения вещества, протекающие внутри клеток микроорганизмов. Эти процессы заканчиваются окислением вещества с выделением энергии и синтезом новых веществ с затратой этой энергии.
Внутри клеток микроорганизмов происходит непрерывный и очень сложный процесс химических превращений. В строгой последовательности с большой скоростью протекает большое число реакций. Скорость реакций и их последовательность зависят от вида и содержания ферментов, которые выполняют роль катализаторов. Ферменты ускоряют только те реакции, которые протекают самопроизвольно, но с очень малой скоростью.
Ферменты (или энзимы) представляют собой сложные белковые соединения с молекулярной массой, достигающей сотен тысяч и миллионов. По строению молекулы ферменты подразделяются на одно- и двух компонентные. Первые из них являются простыми белками — протеинами, вторые — сложными белками — протеидами, молекула которых состоит из двух частей: первая часть, белковая, называется носителем, или апоферментом, вторая — небелковая, называется коферментом. Каталитической активностью обладает кофермент, а белковый носитель увеличивает его активность.
Каталитические реакции протекают на поверхности молекул ферментов, на которой возникают активные центры. По сравнению с химическими катализаторами ферменты способны действовать в более "мягких условиях", т. е. при невысоких температурах, нормальном давлении и реакции среды, близкой к нейтральной. Другой особенностью ферментов является то, что каждый из них взаимодействует только с определенным химическим соединением и катализирует одно из многих превращений, которым подвергается данное химическое соединение. При изменении состава и концентрации веществ требуются ферменты иного состава.
Таким образом, каждую реакцию катализирует один соответствующий фермент. При этом продукт одной реакции служит субстратом для следующей. Все это является существенным отличием ферментного катализа.
Скорость биохимических реакций определяется активностью ферментов, которая зависит от температуры, рН и присутствия в сточной воде различных веществ. С повышением температуры скорость ферментативных процессов повышается, но до определенного предела. Для каждого фермента имеется оптимальная температура, выше которой скорость реакции падает. Для разрушения сложной смеси органических веществ необходимо 80-100 различных ферментов.
К числу7 веществ (активаторов), которые повышают активность ферментов, относятся многие витамины и катионы Са2+, Mg2+, Mn2+. В то же время соль тяжелых металлов, синильная кислота, антибиотики являются ингибиторами. Они блокируют активные центры фермента, препятствуя его реакции с субстратом, т. е. резко снижают активность. Скорость образования и распада ферментов зависит от условий роста микроорганизмов и определяется скоростью поступления в клетку веществ, ингибирующих и активирующих биохимические процессы.
Клетки каждого вида микробов имеют определенный набор ферментов. Некоторые из них независимо от субстрата постоянно присутствуют в клетках микроорганизмов. Такие ферменты называются конститутивными. Другие ферменты синтезируются в клетках вследствие изменений в окружающей среде, например, изменения состава или концентрации загрязнений сточных вод. Эти ферменты появляются в период приспособления организмов к изменению среды, поэтому называются адаптивными. Сроки адаптации (приспособления) различны и продолжаются от нескольких часов до десятков и сотен дней.
Если в сточных водах находится несколько веществ, то процесс окисления будет зависеть от содержания и структуры всех растворенных органических веществ. В первую очередь будут окисляться те вещества, которые необходимы для создания клеточного материала и для получения энергии. Другие вещества потребляются микроорганизмами в зависимости от набора ферментов с равными или разными скоростями окисления одновременно или последовательно. Порядок окисления вещества сказывается на продолжительности очистки сточных вод. При последовательном окислении вещества продолжительность очистки определяется суммой длительности окисления каждого вещества в отдельности.
Внутри клетки химические соединения подвергаются различным анаболическим и катаболическим превращениям. Анаболические превращения приводят к синтезу новых клеточных компонентов, а катаболические являются источниками необходимой для клетки энергии. Суммарные реакции биохимического окисления в аэробных условиях схематично можно представить в следующем виде:
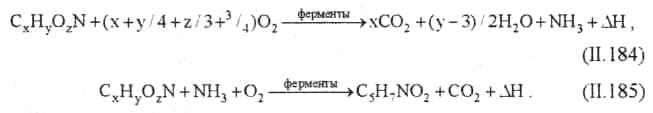
Реакция (II. 184) показывает характер окисления вещества для удовлетворения энергетических потребностей клетки, реакция (II. 185) — для синтеза клеточного вещества. Затраты кислорода на эти реакции составляют БПКполн сточной воды. Если процесс окисления проводить дальше, то начинается превращение клеточного вещества:
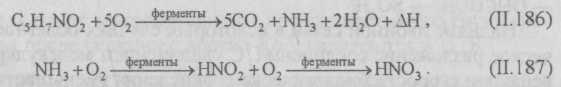
где CxHyOzN — все органические вещества сточных вод; C5H7NO2 — среднее соотношение основных элементов в клеточном веществе бактерий; ∆Н — энергия.
![]()
Большое число биохимических реакций осуществляется с помощью кофермента А. Кофермент А (или КоА, КоА — SH, кофермент ацилирования) является производным b-меркаптоэтиламида пантотеновой кислоты и нуклеотида — аденозин-3,5-дифосфата (C21H36O167P3S). Его молекулярная масса 767,56. Чистый КоА — белый аморфный порошок, хорошо растворимый в воде, является сильной кислотой, с тяжелыми металлами образует нерастворимые в воде меркаптиды, легко окисляется (I2 , Н2О2, КМnО4, а также кислородом воздуха) с образованием дисульфидов, особенно в присутствии следов тяжелых металлов. КоА активирует карбоновые кислоты, образуя с ними промежуточные соединения, ацилпроизводные КоА.
Микроорганизмы способны окислять многие органические вещества, но для этого требуется разное время адаптации. Легко окисляются бензойная кислота, этиловый и амиловый спирты, гликоли, хлоргидриды, ацетон, глицерин, анилин, сложные эфиры и др. Так, одно-, двух- и трехатомные спирты, а также вторичные спирты хорошо окисляются, а третичные спирты окисляются с небольшой скоростью. Различной скоростью окисления обладают хлорпроизводные органические соединения, а нитросоединения плохо окисляются. Наличие функциональных групп увеличивает способность к биологическому разрушению соединений в такой последовательности: — СН3 , — ООССН3 , — СНО, — СН2ОН, — СНОН, — СООН, — CN, — NH2, — ОНСООН, — SO3H.
Наличие двойной связи в некоторых случаях облегчает биологическое разложение соединений. С увеличением молекулярной массы вещества скорость биологического окисления уменьшается. Поверхностно-активные вещества окисляются с разной скоростью. Биологически "жесткие" ПАВ — трудноокисляемые, а "мягкие" — легкоокисляемые. Таким образом, не все вещества окисляются с одинаковой скоростью.
Установлено, что вещества, находящиеся в сточных водах в коллоидном или мелкодисперсном состоянии, окисляются с меньшей скоростью, чем вещества, растворенные в воде. В сточных водах из смеси веществ в первую очередь окисляются те вещества, которые лучше усваиваются микроорганизмами.
Метаболизм некоторых веществ. Окисление органических веществ до СО2 и Н2О происходит в несколько стадий. Окисление углеводов описывается сложной схемой:
![]()
Цикл трикарбоновых кислот (цикл Кребса, цикл лимонной кислоты, ЦТК) состоит из серии последовательных реакций, катализируемых десятью различными ферментами. Последовательность реакций описана ниже.
Ацетил-КоА под действием фермента конденсируется с щавелево-уксусной кислотой, образуя лимонную кислоту, которая под действием фермента изомеризуется в цис-аконитовую кислоту, а затем в изолимонную кислоту; которая подвергается окислительному декар-боксилированию. Этот процесс протекает в две стадии: сначала происходит дегидрирование изолимонной кислоты с образованием щавелево-янтарной кислоты, которая затем декарбоксилируется, превращаясь в кетоглутаровую кислоту. Далее происходит окислительное декарбоксилирование кетоглутаровой кислоты и образуется сук-цинил-КоА. который превращается в свободную янтарную кислоту. Далее идет дегидрирование янтарной кислоты с образованием фума-ровой кислоты, которая превращается в яблочную кислоту. После дегидрирования возникает щавелево-уксусная кислота, которая может вновь конденсироваться с ацетил-КоА (СН3—СО—S—КоА).
Окисление метана и этанола. Метан окисляется по схеме
СН4→ СН3ОН → НСНО → НСООН → СО2. (II. 190)
Этиловый спирт микроорганизмы превращают в уксусную кислоту, которая после реакции с ацетил-КоА включается в ЦТК:
СН3СН2ОН→ СН3СНО → СН3СООН → Ацетил-КоА → ЦТК. (II. 191)
Окисление углеводородов осуществляется следующим образом:
![]()
Пути метаболизма ароматических соединений очень многообразны. Распад этих соединений связан с разрывом кольца. На это бактериям требуется кислород. Различают три типа разрыва ароматического кольца. По первому типу кольцо разрываетя между двумя соседними гидроксилированными атомами углерода. Например, под действием фермента разрыв кольца пирокатехина приводит к образованию цис, цис-нуконовой кислоты. По этому пути распадаются фенол, бензойная кислота, нафталин, фенантрен, антрацен и др.
Окисление фенола начинается с его гидроксилирования в орто-положении, при этом образуется пирокатехин (дифенол).
Большинство ароматических соединений образует сначала пирокатехин (или пирокатехиновую кислоту), который преобразуется в β-кетоадипиновую кислоту. Эта кислота с участием КоА включается в цикл трикарбоновых кислот:
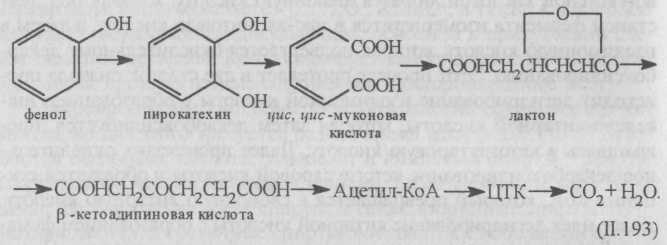
Второй путь разрыва кольца ароматических соединений — это разрыв связи между гидроксилированным и негидроксилированным углеродными атомами. В этом случае под действием фермента пирокатехин распадается на полуальдегид 2-оксимуконовой кислоты, который далее превращается в уксусную, щавелево-уксусную, муравьиную (ацетальдегид) кислоты.
Третий путь характеризуется разрывом кольца между гидроксилированным атомом углерода и атомом углерода, к которому присоединена карбоксильная или другая группа.
Нитрификация и денитрификация. При очистке сточных вод под действием нитрифицирующих бактерий протекают процессы нитрификации и денитрификации. Нитрифицирующие бактерии окисляют азот аммонийных соединений сначала до нитритов, а потом до нитратов. Этот процесс называется нитрификацией и протекает в две стадии. Он является конечной стадией минерализации азотсодержащих органических веществ. Присутствие нитрат-ионов в очищенной сточной воде является одним из показателей полноты очистки:
![]()
Количество активного ила, необходимого для нитрификации, рассчитывают, исходя из содержания органических веществ, концентрации азота и аммиака в сточных водах, активности ила. Учитывают также способность роста и размножения микроорганизмов активного ила в условиях изменения нагрузки и окислительно-восстановительного потенциала ила.
Под действием денитрифицирующих бактерий связанный кислород отщепляется от нитритов и нитратов и вновь расходуется на окисление органических веществ. Этот процесс называется денитрификацией. Условиями осуществления процесса денитрификации являются: наличие органических веществ, небольшой доступ кислорода, нейтральная или слабощелочная реакции.
Денитрификация — процесс многостадийный и может протекать с образованием аммиака, молекулярного азота либо оксидов азота. При очистке сточных вод денитрификация протекает главным образом с образованием азота (резко образуется NH3):

Азотсодержащие соединения разлагаются с выделением азота в виде аммиака. Например, карбамид (мочевина) разлагается по уравнению:
![]()
Разложение органических соединений может происходить через образование аминокислот, которые далее выделяют аммиак при протекании различных процессов.
Окисление серосодержащих веществ. Серу, сероводород, тиосульфаты, политионаты и другие серосодержащие соединения серные бактерии окисляют до серной кислоты и сульфатов. Наличие в сточной воде азота, фосфора, калия и небольших количеств железа, магния, меди, цинка, бора, марганца и других веществ в некоторых случаях сильно интенсифицирует развитие серных и тионовых бактерий. Тионовые бактерии разлагают сероводород, серу, тиосульфат и др. Конечный продукт окисления — серная кислота или сульфаты.
Процесс окисления сернистых соединений тионовыми бактериями может быть представлен следующими схемами:
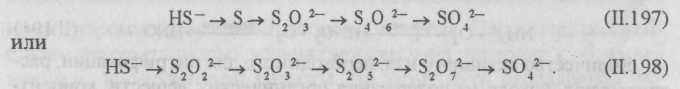
Установлено, что окисление сульфида кальция идет быстрее, чем сульфида натрия.
При окислении сероводорода сначала образуется сера, которая накапливается в клетках в виде запасного вещества:
2H2S+O2 → 2H2O+2S+∆H. (II. 199)
Затем при недостатке H2S идет реакция:
2S+3O2+2H2O → 2H2SO4+∆H. (II.200)
Восстановление сульфатов — основной путь образования сероводорода в природе. Восстанавливаются и органические соединения:
4CH3COCOOH+H2SO4→ 4CH3COOH+4CO2+H2S. (II.201)
При окислении тиоцианатов (роданидов) вначале образуются сульфиды и цианаты. Цианаты далее гидролизируются до CO2 и NH3, а сульфиды окисляются до сульфатов:
![]()
Окисление железа и марганца. Железобактерии получают энергию в результате окисления солей двухвалентного железа до соединений трехвалентного железа:
4FeCO3+O2+6H2O → 4Fe(OH)3+4CO2+∆H. (II.2O3)
Имеются микроорганизмы, которые восстанавливают Fe3+ до Fe2+:
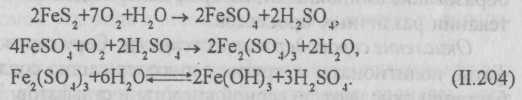
Двухвалентный марганец окисляется в четырехвалентный:
Mn2+ + 1/2O2 + 2HO- → MnO2+H2O. (II.205)
Соли тяжелых металлов губительно влияют на бактерии, но есть такие микроорганизмы, которые отличаются устойчивостью и адаптируются.
Уравнение кинетики ферментативных реакций. Это уравнение было предложено Михаэлисом и Ментеном. Оно определяет скорость протекания реакций внутри клеток микроорганизмов.
При выводе уравнения кинетики рассматривается следующая реакция:
![]()
Здесь k1, k2, k3 — константы скоростей процессов. В ходе этой реакции молекулы вещества S взаимодействуют с ферментом Е, образуя фермент-субстратный комплекс ES. Затем этот комлекс превращается в конечный продукт Р с регенерацией фермента. Вторая реакция также обратима, т. е. возможно из Р и Е вновь образование комплекса ES, но в данном случае в стационарных условиях концентрация ES остается практически постоянной, т. е. определяющую роль в кинетике играет реакция превращения ES в продукт.
В стационарных условиях скорость образования фермент-субстратного комплекса равна скорости его распада, т. е. на основании закона действующих масс константа равновесия первой реакции равна:
Kp=k1/k2=[ES]/([S][E]). (II.207)
Если начальная концентрация фермента (точнее, активных центров фермента) равна Ео, то уравнение материального баланса для него будет:
[E0]=[E]+[ES]. (II.208)
Таким образом, рассматривая уравнения (II.207) и (II.208), получим:

Отсюда концентрация фермент-субстратного комлекса равна:
[ES] = k1[E0][S] / (k2+k3+k1[S]). (II.209)
Разделив числитель и знаменатель на к, и обозначив (k2+k3)/k1=kм, получим:
[ES] = [E0][S]/(Km+[S]). (II.210)
Скорость образования продукта Р может быть записана так:
![]()
Из двух последних уравнений следует:
dP/dτ =k3[ES] =k3[E0][S ] /(Kм+[S] ). (II. 212)
Из этого уравнения видно, что при малых значениях [S] скорость ферментативной реакции изменяется приблизительно линейно с ростом концентрации субстрата. Максимальное значение скорости равно k3[E0]. В этом случае равновесие реакции сдвинуто вправо и практически весь фермент находится в виде комплекса ES. Это наблюдается при значительном избытке субстрата. В этих условиях скорость реакции не зависит от концентрации субстрата.
Обозначив dP/dτ=V, a k3[E0]=Vмакс, получим уравнение Михаэлиса — Ментен:
V=Vмакс[S]/(Kм+[S]). (II.213)
Константу Км называют константой Михаэлиса — Ментен. Она характеризует зависимость скорости ферментативной реакции от концентрации субстрата в стационарном состоянии процесса. Константа имеет размерность моль/л.
Если V=0,5Vмакс , то К =[S]. Отсюда следует, что константа Км численно равна концентрации субстрата, при которой скорость ферментативной реакции составляет половину максимально возможной.
Для определения значения константы Км исследуют зависимость скорости реакции по концентрации субстрата в широком диапазоне [S]. Зависимость выражают графически, откладывая на оси ординат 1/V, а на оси абсцисс 1/[S]. В случае применимости к исследуемой реакции уравнения Михаэлиса — Ментен зависимость 1/V=f(l/[S]) будет изображаться прямой линией. Причем прямая отсекает на оси ординат отрезок, равный l/Vмакс, а на оси абсцисс 1/Км (рис. II-66).
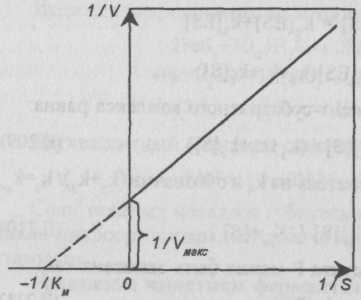
Рис. II-66. Определение константы Км.
Прирост биомассы. В процессе очистки сточных вод происходит процесс прироста биомассы, который зависит от химической природы загрязнений, вида и возврата микроорганизмов, БПК и ХПК, от концентрации фосфора и азота в сточной воде, от ее температуры. Прирост биомассы зависит также от скорости размножения микроорганизмов и имеет сложную зависимость от времени. Для периодического процесса в общем виде процесс роста микроорганизмов во времени изображается кривой, показанной на рис. II-67.
В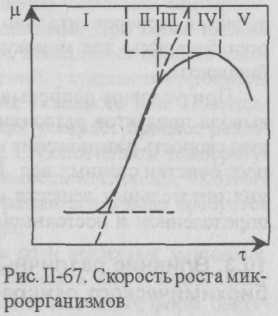 зависимости от скорости выделяют
несколько фаз роста микроорганизмов.
Фаза I
— приспособления (лаг-фаза), когда клетки
увеличиваются в размерах, но число их
не возрастает. Фаза II
— экспоненциального роста, когда клетки
делятся с максимальной скоростью. Фаза
III
— замедления роста, в ней наблюдается
истощение питательных веществ. Фаза IV
— стационарного роста, численность
микроорганизмов остается неизменной.
Фаза V
— отмирания.
зависимости от скорости выделяют
несколько фаз роста микроорганизмов.
Фаза I
— приспособления (лаг-фаза), когда клетки
увеличиваются в размерах, но число их
не возрастает. Фаза II
— экспоненциального роста, когда клетки
делятся с максимальной скоростью. Фаза
III
— замедления роста, в ней наблюдается
истощение питательных веществ. Фаза IV
— стационарного роста, численность
микроорганизмов остается неизменной.
Фаза V
— отмирания.
Наклон кривой (рис. II-67) показывает мгновенную скорость роста, которая меняется в различные промежутки времени. Фаза II является периодом самого быстрого развития микроорганизмов. Питательных веществ достаточно, и скорость роста не тормозится продуктами распада. Прирост биомассы происходит с постоянной скоростью по прямой линии. Тангенс угла наклона этой прямой обозначают mмакс и называют удельной экспоненциальной скоростью роста.
Удельная скорость роста специфична для каждого вида микроорганизмов и среды. Зависимость ее от концентрации субстрата определяется уравнением Моно:
![]()
Константа Км всегда больше 0, поэтому дробь меньше единицы и μмакс не может быть достигнута. Только при S>Km удельная скорость близка к μмакс.
Для приближенных расчетов прирост биомассы (Пр) можно определить по формуле:
Пр = К (ХПК-БПК). (II.215)
Коэффициент К, характеризующий качество ила, для ПСВ определяется эксперементально и изменяется в пределах 0,1-0,9. Прирост биомассы для монокультуры всегда меньше, чем для культур биоценоза.
При условии непрерывного поступления свежего субстрата и вывода продуктов разложения веществ можно поддерживать высокую скорость размножения микробов и проводить непрерывный процесс очистки сточных вод. Для этого необходимо, чтобы концентрация питательных веществ и продуктов распада поддерживалась на определенном и постоянном уровне.
