
- •Аннотация
- •1. Введение
- •1.1 Общие правила выполнения лабораторных работ.
- •1.2. Лабораторное оборудование.
- •1.3 Вычисления.
- •1.4 Количество и концентрация вещества.
- •Общие указания по выполнению лабораторных работ.
- •Работа 1. Ознакомление с некоторыми операциями лабораторной практики и измерительными приборами.
- •Работа 2. Классы неорганических соединений.
- •Работа 3. Определение молярной массы диоксида углерода.
- •Работа 4. Электронная структура атомов и одноатомных ионов.
- •Работа 5. Кинетика химических реакций.
- •Работа 6. Химическое и адсорбционное равновесие.
- •Работа 7. Концентрация растворов.
- •Работа 8. Свойство водных растворов электролитов.
- •Работа 9.Гидролиз солей.
- •Работа 10. Окислительно-восстановительные реакции.
- •Работа 11. Основы электрохимии.
- •Работа 12. Электролиз.
- •Работа 13. Общие химические свойства металлов.
- •Работа 14. Свойства d-элементов 4-го периода.
- •Работа 15. Свойства элементов, применяемых в полупроводниковой технике.
- •Работа 16. Определение жесткости и умягчение воды.
- •Работ 17 Органические соединения.
- •Работа. 18. Свойства элементов подгруппыViв иViiв
- •Работа 19. Свойства элементов подгруппыViiib.
- •Работа 20. Свойства элементов подгруппыIva.
- •Работа 21, Свойства элементовVAиVia.
Работа 2. Классы неорганических соединений.
Введение.
Проведение лабораторного занятия по данной теме диктуется необходимостью обобщения сведений по классам неорганических веществ, углубление изученного в средней школе материала, а также усвоение современной номенклатуры неорганических веществ.
Неорганические вещества по своему химическому составу и свойствам можно разделить на несколько классов:
Простые вещества.
Оксиды.
Основания (гидроксида).
Кислоты.
Соли.
Оксиды.
Простейшим классом неорганических соединений являются оксиды.
Оксиды - это соединение любого элемента с кислородом, в котором кислород непосредственно соединен с элементом:
![]() и
др.
и
др.
(если связь осуществляется между атомами кислорода К-О-О-К то такие соединения называют пероксидами).
Оксиды делятся на:
1. Основные - соединения кислорода с металлами. В основных оксидах металлы, как правило, проявляют валентность 1,2 реже 3. Основными они называются потому, что каждому из них соответствует основание (гидроксид):
|
|
Оксид натрия |
|
Гидроксид натрия |
|
|
Оксид магния |
|
Гидроксид магния |
|
|
Оксид кальция |
|
Гидроксид кальция |
Если металл проявляет переменную валентность, то при названии оксида в скобках указывается валентность металла:
|
|
Оксид меди (I) |
|
Оксид меди (II) |
|
|
Оксид железа (II) |
|
Оксид железа (III) |
Главным свойством основных оксидов является их способность взаимодействовать с кислотами с образованием соли и воды.
![]()
Кислотные оксиды соединения кислорода с неметаллами, а также с некоторыми металлами, которые в кислотных оксидах проявляют высшую (или близкую к высшей) положительную степень окисления 1, 6, 7). Такие оксиды называются кислотными (или ангидридами кислот), потому что каждому из них соответствует кислота:
|
Оксид: |
Соответствующая оксиду кислота: | ||
|
|
оксид серы (IV) сернистый ангидрид |
|
сернистая кислота |
|
|
оксид серы (VI) сернистый ангидрид |
|
серная кислота |
|
|
оксид фосфора (V) фосфорный ангидрид |
|
фосфорная кислота |
Главным свойством кислотных оксидов (особенно оксидов неметаллов) является их способность взаимодействовать с основаниями с образованием соли и воды:
![]()
3.
Амфотерные -.оксиды металлов, которые
могут взаимодействовать как с кислотами,
так и со щелочами. Эти оксиды проявляют
свойства кислотных и основных оксидов.
Амфотерный характер носят оксиды
некоторый металлов, II, II1, IV
и некоторых других групп периодической
системы элементов:
![]() - оксид цинка;
- оксид цинка;![]() -
оксид алюминия;
-
оксид алюминия;![]() - оксид бериллия;
- оксид бериллия;![]() - оксид хрома (III);
- оксид хрома (III);
![]() - оксид свинца (II) и др.
- оксид свинца (II) и др.
![]()

В водных растворах щелочей такие оксиды, как правило, дают комплексные соединения:

Все
перечисленные оксиды образуют соли;
поэтому они называются солеобразующими
оксидами, в отличии от несолеобразующих
оксидов, к которым относятся
![]() - оксид азота (I),
- оксид азота (I),![]() - оксид азота (II),
- оксид азота (II),
![]() -
оксид углерода (II)
и некоторые другие.
-
оксид углерода (II)
и некоторые другие.
Гидроксиды.
Гидроксиды
- соединения оксида с водой, полученные
прямым или косвенным способом.
![]() - гидроксидам относятся основания,
амфотерные гидроксиды, кислоты.
- гидроксидам относятся основания,
амфотерные гидроксиды, кислоты.
Основания
- вещества, молекулы которых состоят из
атома металла и гидроксильных групп:
![]() ,
,![]() ,
,![]() ;
или веществ, которые образуют в водном
растворе из отрицательных ионов только
гидроксид ион:
;
или веществ, которые образуют в водном
растворе из отрицательных ионов только
гидроксид ион:
![]()
Основания,
растворенные в воде, называются щелочами
![]() - гидроксид натрия; КОН - гидроксид
калия;
- гидроксид натрия; КОН - гидроксид
калия;![]() -
гидроксид бария;
-
гидроксид бария;![]() -
гидроксид кальция. Металлы, образующие
в воде гидроксиды (K,
Na,
Ca,
Вa
и др.), расположены в главных подгруппах
I
и II
группе периодической системы. К
растворенным в воде основаниям относится
и гидроксид аммония
-
гидроксид кальция. Металлы, образующие
в воде гидроксиды (K,
Na,
Ca,
Вa
и др.), расположены в главных подгруппах
I
и II
группе периодической системы. К
растворенным в воде основаниям относится
и гидроксид аммония
![]() ,
но щелочью он не является. Если металл,
образующий основание, может проявлять
переменную валентность, то при названии
гидроксида в скобках указывается
валентность:
,
но щелочью он не является. Если металл,
образующий основание, может проявлять
переменную валентность, то при названии
гидроксида в скобках указывается
валентность:![]() -
гидроксид железа (II),
-
гидроксид железа (II),
![]() -
гидроксид железа (III).
-
гидроксид железа (III).
Главным свойством оснований является их способность взаимодействовать с кислотами с образованием соли и воды:
![]()
Амфотерные оксиды.
Это вещества, которые взаимодействуют как с кислотами, так и щелочами, с образованием соли.
![]()

В водном растворе щелочей амфотерные гидроксиды чаще всего образуют комплексные соли:

Кислоты.
Кислоты - вещества, состоящие из атомов водорода, способных замещаться на металл, или вещества которые образуют в водном растворе из положительных ионов только ионы водорода (гидроксония):
![]() ;
;

По
числу атомов водорода, способных
замещаться на металл, различают кислоты:
одноосновные (![]() - соляная кислота,
- соляная кислота,![]() - азотная кислота,
- азотная кислота,![]() - синильная кислота,
- синильная кислота,![]() - уксусная кислота и др.), двухосновные
(
- уксусная кислота и др.), двухосновные
(![]() -
серная кислота,
-
серная кислота,![]() - сероводородная кислота), трехосновные
(
- сероводородная кислота), трехосновные
(![]() - фосфорная кислота,
- фосфорная кислота,![]() - борная кислота).
- борная кислота).
По
химическому составу кислоты делятся
на кислородные
![]() ,
,![]() ,
,![]() и т.д. и бескислородные
и т.д. и бескислородные![]() ,
,![]() ,
,![]() ,
,![]() .
.
Главным химическим свойством кислот является их способность к взаимодействию с основаниями с образованием соли и воды:
![]()
Соли.
Различают 5 типов солей: средние или нормальные, кислые, основные, двойные и комплексные.
Средние
или нормальные соли - продукт полного
замещения водорода кислоты на металл:
![]() - сульфат натрия,
- сульфат натрия,![]() - карбонат кальция.
- карбонат кальция.
Кислые соли - продукт неполного замещения водорода кислоты на металл. Кислые соли дают только многоосновные кислоты при недостаточном количестве основания:

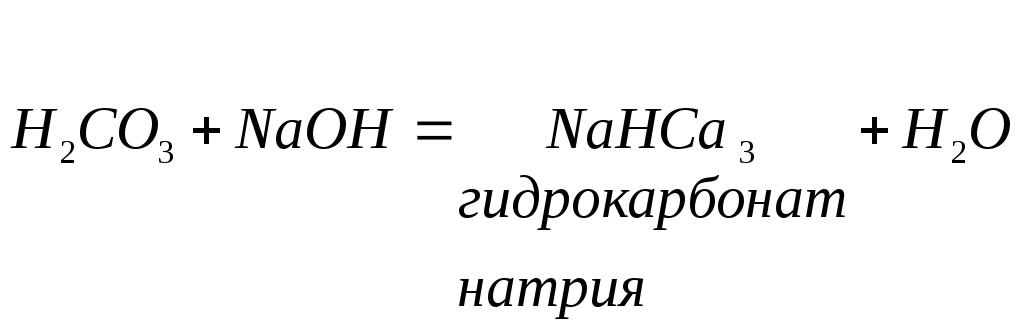
При добавлении избытка щелочи кислая соль может быть переведена в среднюю соль:
![]()
Основные соли - продукт неполного замещения гидроксид - ионов в основании на кислотный остаток. Они могут быть образованы только много кислотными основаниями (основания, содержащие несколько гидроксильных групп)
![]()
![]()
Перевести основную соль в среднюю можно, действуя на нее кислотой.

Двойные соли образуются при замещении кислорода многоосновной кислоты двумя различными катионами:
|
|
|
|
|
карбонат натрия - калия |
сульфат калия - алюминия |
хлорид калия - магния |
Двойные соли, как правило, существуют только в кристаллическом состоянии.
Комплексные
соли - такие вещества, в состав которых
входит комплексный ион. Примерами
комплексных солей могут быть продукты
растворения амфотерных гидроксидов в
щелочах:
![]() -
тетрагидроксоалюминат натрия,
-
тетрагидроксоалюминат натрия,![]() -
тетрагидроксоцинкат натрия.
-
тетрагидроксоцинкат натрия.
Номенклатура солей и кислот.
Для наименования солей пользуются русской и международной номенклатурой.
Русское
название соли составляется из названия
кислоты и названия металла:
![]() -
углекислый кальций. Для кислых солей
вводится добавка "кислый":
-
углекислый кальций. Для кислых солей
вводится добавка "кислый":![]() - кислый углекислый кальций. Для названия
основных солей добавка "основная":
- кислый углекислый кальций. Для названия
основных солей добавка "основная":![]() - основная сернокислая медь.
- основная сернокислая медь.
Наибольшее
распространение получила международная
номенклатура. Названия солей по этой
номенклатуре состоят из названия атома
и названия катионов:
![]() - нитрат калия. Если металл имеет разную
валентность, то ее указывают в скобках:
- нитрат калия. Если металл имеет разную
валентность, то ее указывают в скобках:![]() - сульфат железа (II),
- сульфат железа (II),![]() - сульфат железа (III).
- сульфат железа (III).
Для
солей кислородосодержащих кислот в
название вводят суффикс "ат", если
кислотообразующий элемент проявляет
высшую валентность:
![]() -нитрат калия; суффикс "ит", если
кислотообразующий элемент проявляет
низшую валентности
-нитрат калия; суффикс "ит", если
кислотообразующий элемент проявляет
низшую валентности![]() - нитрит калия. В тех случаях, когда
кристалообразующий элемент образует
кислоты более чем в двух валентных
состояниях, применяют суффикс "ат".
При этом, если он проявляет высшую
валентность, добавляют префикс "пер":
- нитрит калия. В тех случаях, когда
кристалообразующий элемент образует
кислоты более чем в двух валентных
состояниях, применяют суффикс "ат".
При этом, если он проявляет высшую
валентность, добавляют префикс "пер":![]() -
перхлорат калия, если низшую - то применяют
суффикс "ид" и префикс "гипо":
-
перхлорат калия, если низшую - то применяют
суффикс "ид" и префикс "гипо":![]() -
гипохлорит калия. Для солей, образованных
кислотами, содержащими разное количество
воды, добавляются префиксы "мета"
и "орто". Например:
-
гипохлорит калия. Для солей, образованных
кислотами, содержащими разное количество
воды, добавляются префиксы "мета"
и "орто". Например:![]() -
метафосфат натрия (соль метафосфорной
кислоты),
-
метафосфат натрия (соль метафосфорной
кислоты),![]() - ортофосфат натрия (соль ортофосфорной
кислоты).
- ортофосфат натрия (соль ортофосфорной
кислоты).
В
название кислой соли вводят приставку
"гидро":
![]() - гидрофосфат натрия (если в молекуле
один атом водорода) и приставку "гидро"
с греческими числительными (если
атомов водорода больше одного):
- гидрофосфат натрия (если в молекуле
один атом водорода) и приставку "гидро"
с греческими числительными (если
атомов водорода больше одного):![]() - дигидрофосфат натрия. В названия
основных солей вводится приставка
"гидроксо". Например,
- дигидрофосфат натрия. В названия
основных солей вводится приставка
"гидроксо". Например,![]() - хлорид гидроксожелеэа (II).
- хлорид гидроксожелеэа (II).
Формулы кислот и названия их атомов.
|
Формула |
Анион |
Название аниона | |
|
Международное |
Русское | ||
|
|
|
фторид |
фтористый |
|
|
|
хлорид |
хлористый |
|
|
|
бромид |
бромистый |
|
|
|
йодид |
йодистый |
|
|
|
сульфид |
сернистый |
|
|
|
гидросульфид |
кислый сернистый |
|
|
|
нитрит |
азотистокислый |
|
|
|
нитрат |
азотокислый |
|
|
|
ацетат |
уксуснокислый |
|
|
|
перманганат |
марганцовокислый |
|
|
|
сульфат |
сернокислый |
|
|
|
гидросульфат |
кислый сернокислый |
|
|
|
карбонат |
углекислый |
|
|
|
гидрокарбонат |
кислый углекислый |
|
|
|
сульфит |
сернокислый |
|
|
|
гидросульфит |
кислый сернокислый |
|
|
|
метасиликат |
метокремневокислый |
|
|
|
ортосиликат |
ортокремневокислый |
|
|
|
фосфат |
фосфорнокислый
|
|
|
|
гидрофосфат |
кислый фосфорнокислый однозамещенный |
|
|
|
дигидрофосфат |
кислый фосфорнокислый двузамещенный |
|
|
|
гипохлорит |
хлорноватокислый |
|
|
|
хлорит |
хлористокислый |
|
|
|
хлорат |
хлорноватокислый |
|
|
|
хромат |
хромовокислый |
|
|
|
дихромат |
двухромовокислый |
|
|
|
дифосфат |
двуфосфорнокислый |
|
|
|
перхлорат |
Хлорнокислый |
Экспериментальная часть.
ОПЫТ 1. Получение оксидов и испытание их характеристик.
Оксид и гидроксид магния.
Поместите в пробирку небольшое количество оксида магния и прибавьте туда же 5-10 мл воды. Взболтайте содержимое пробирки и испытайте реакцию среды 1-2 каплями раствора фенолфталеина. Отметьте реакцию среды. Составьте уравнение реакции и сделайте вывод о характере оксид;
1.2.
Оксид кальция
![]() .
.
Небольшой кусочек мела взять железными щипцами и прокалить над пламенем горелки в течение 3-5 минут. Охлажденный прокаленный кусочек поместить в фарфоровую чашку и залить небольшим количеством воды. Испытать индикатором (фенолфталеином), отметить окраску и сделать вывод о характере среды. Написать уравнение реакции.
ОПЫТ 2. Получение кислот.
2.1
Угольная кислота
![]() .
.
Из аппарата Киппа пропустить углекислый газ в пробирку с водой в течение нескольких минут. Испытать раствор индикатором (метилоранжем или лакмусом). Написать уравнение реакции.
ОПЫТ 3. Получение оснований.
3.1
Гидроокись кальция
![]() .
.
К оксиду кальция прилить немного капель воды, размешать, испытать
индикатором. Записать реакцию среды и составить уравнение реакции.
3.2
Гидроокись алюминия
![]() .
.
В
пробирку налейте 2-3 мл раствора соли
алюминия и прибавьте примерно такой же
объем раствора
![]() .
Содержимое пробирки распределите в
две пробирки. В одну из пробирок при
взбалтывании прилейте по каплям 10%
раствор соляной кислоты до полного
растворения осадка. Во вторую пробирку
прилейте 10% раствор гидроокиси натрия
также до полного растворения осадка.
Составьте уравнения реакций. Сделайте
вывод о характере гидроксида алюминия.
.
Содержимое пробирки распределите в
две пробирки. В одну из пробирок при
взбалтывании прилейте по каплям 10%
раствор соляной кислоты до полного
растворения осадка. Во вторую пробирку
прилейте 10% раствор гидроокиси натрия
также до полного растворения осадка.
Составьте уравнения реакций. Сделайте
вывод о характере гидроксида алюминия.
ОПЫТ 4. Получение солей.
4.1. Взаимодействие кислот с основными оксидами.
В три конические пробирки внести по несколько кристаллов оксида меди и оксида магния. Прибавить по 5-6 капель соляной или серной кислоты. В случае необходимости применить нагревание. Отметить цвета получившихся растворов и написать уравнения реакций.
4.2 Взаимодействие металла с солью другого металла в две пробирки внести по 12-15 капель раствора сульфата меди и нитрата свинца. В первую положить немного металлического железа, во вторую - цинка. Наблюдать происходящие реакции, составить уравнения. Сделать вывод, в каких случаях происходит постепенное вытеснение металлов из их солей.
4.3. Получение основной соли.
К раствору сульфата меди по каплям прибавлять раствор гидроксида натрия до образования осадка. Содержимое пробирки нагреть и наблюдать изменение цвета осадка. Составить уравнение реакции.
4.4 Получение кислой соли.
Наполнить
пробирку на 1/2 ее объема известковой
водой (раствор![]() )
и пропустить через нее диоксид углерода
из аппарата Киппа (под тягой). Отметить
появление осадка карбоната кальция.
Продолжать пропускать диоксид углерода
до растворения осадка, которое, происходит
вследствие образования кислой соли
)
и пропустить через нее диоксид углерода
из аппарата Киппа (под тягой). Отметить
появление осадка карбоната кальция.
Продолжать пропускать диоксид углерода
до растворения осадка, которое, происходит
вследствие образования кислой соли![]() .
Составить уравнения реакций.
.
Составить уравнения реакций.
Получение нормальной соли из кислой.
К полученному в опыте 4.4. раствору кислого карбоната кальция прилить несколько капель известковой воды. Наблюдать образование осадка. Составить уравнение реакции.
Контрольные вопросы и задачи:
Какие из приведенных оксидов являются основными:
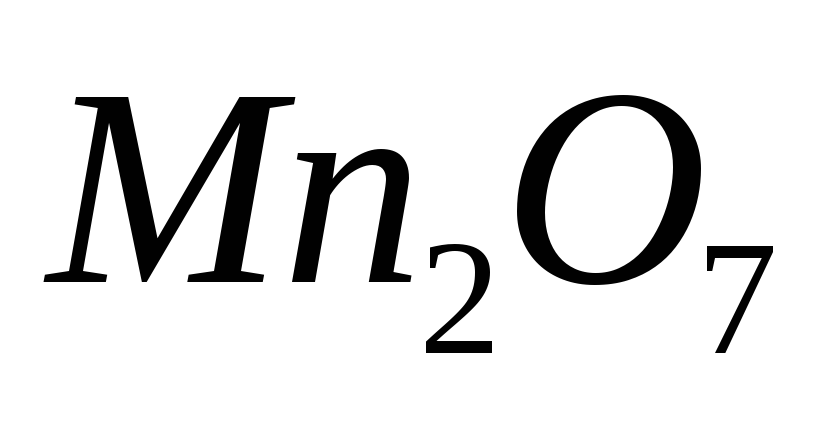 ,
, ,
, ,
,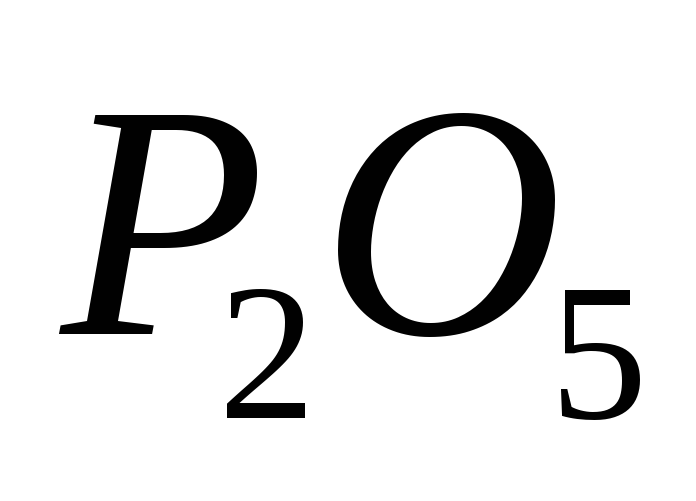 ,
, ?
?Исходя из валентности хрома в соединениях, решите, какой из оксидов носит кислотный характер:
 ,
,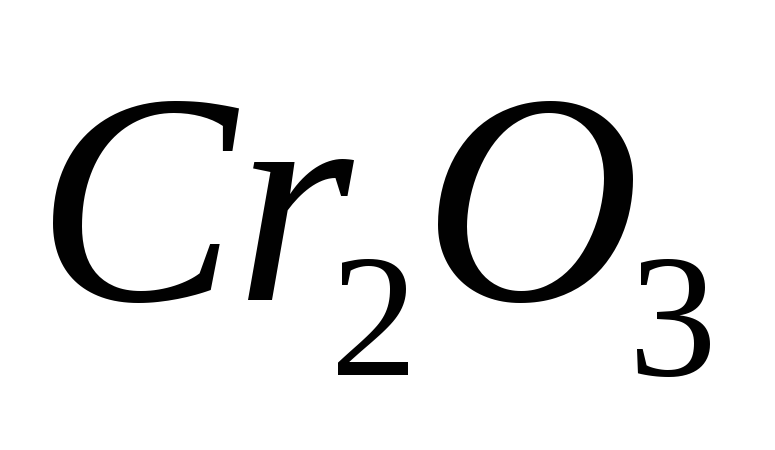 ,
, ?
?Какие из перечисленных оксидов будут реагировать с
 :
: ,
,
 ,
,
 ,
,
 ,
,
 ?
?Какие из перечисленных гидроксидов являются амфотерными:
 ,
,
 ,
,
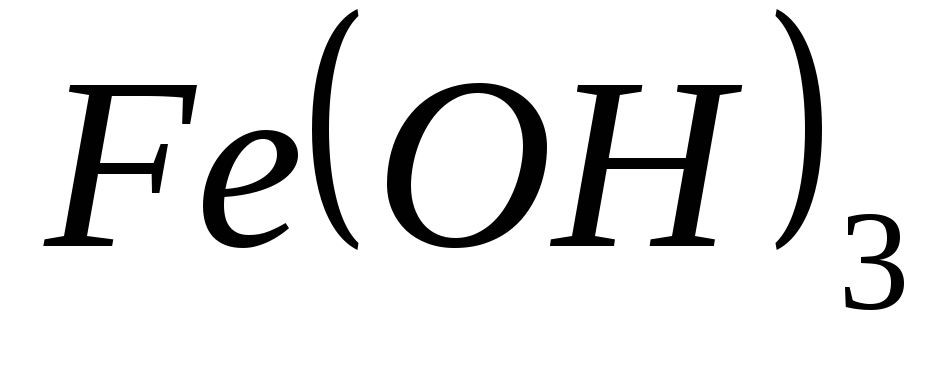 ,
,
 ,
,
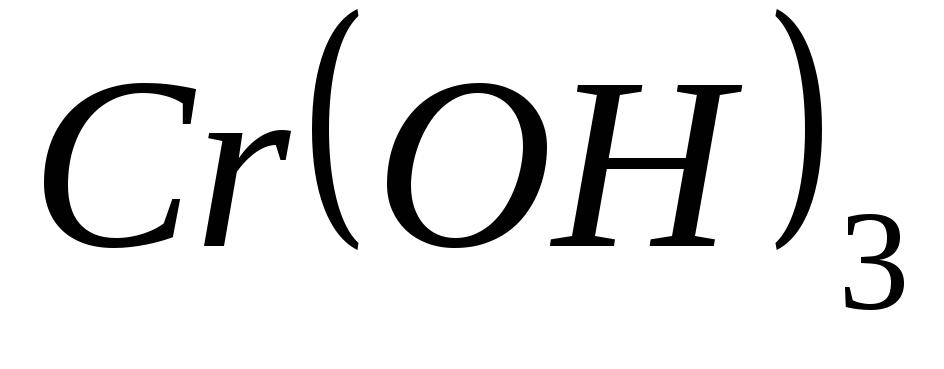 ,
,
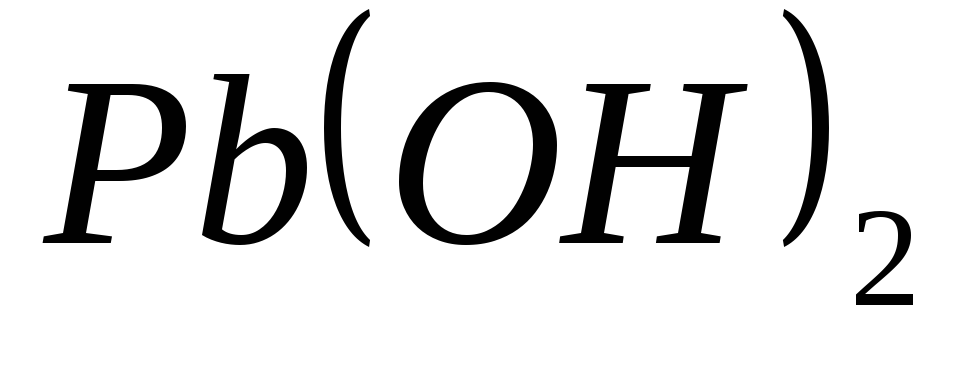 ,
,
 ?
?Какие из приведенных кислот могут образовывать кислые соли:
 ,
,
 ,
,
 ,
,
 ,
,
 ?
?Рассчитать, сколько миллилитров
 (при нормальных условиях) получится
при сжигании 1,6 г серы?
(при нормальных условиях) получится
при сжигании 1,6 г серы?Сколько мл
 раствора
раствора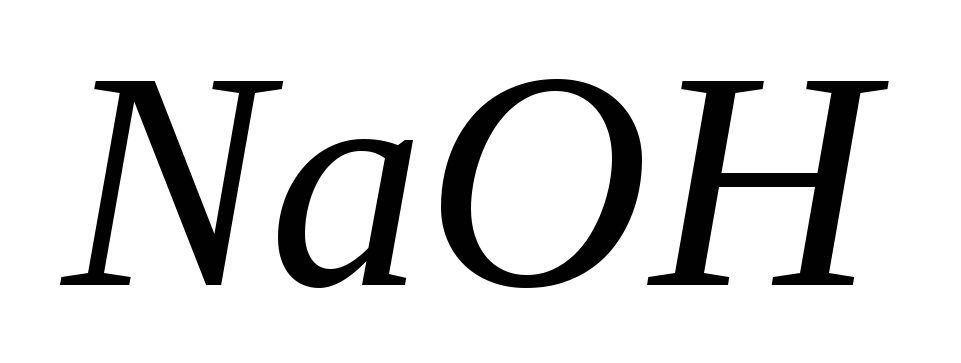 потребуется для нейтрализации 20 мл
потребуется для нейтрализации 20 мл раствора
раствора ?
?Как изменяется характер оксидов и гидроксидов в группах сверху вниз?
Напишите формулу ванадиевой кислоты, вольфрамата кальция, перхлората калия.
